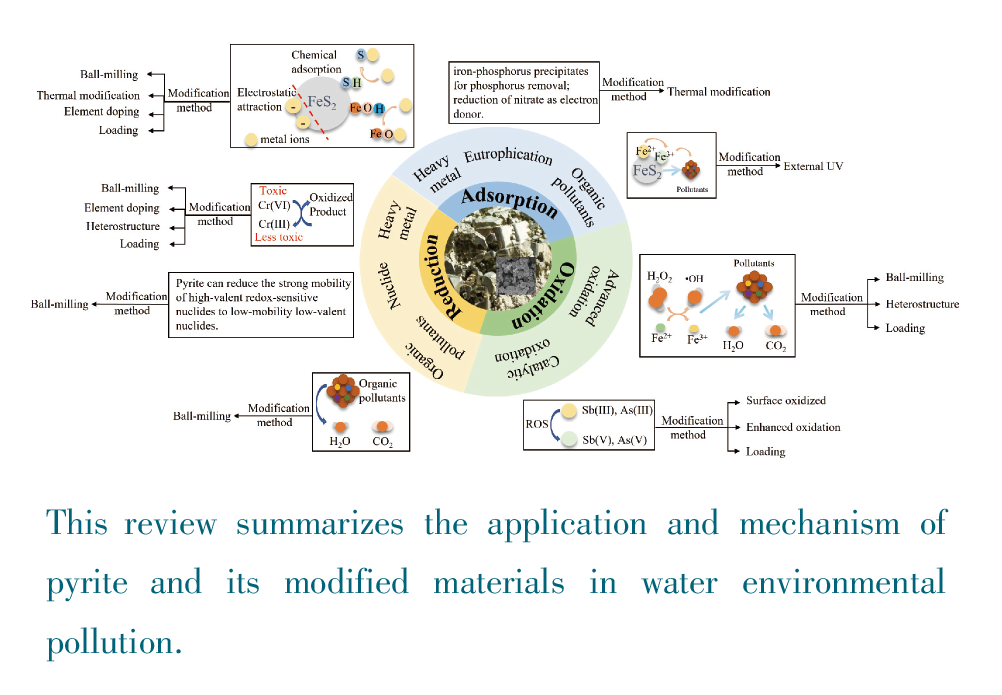
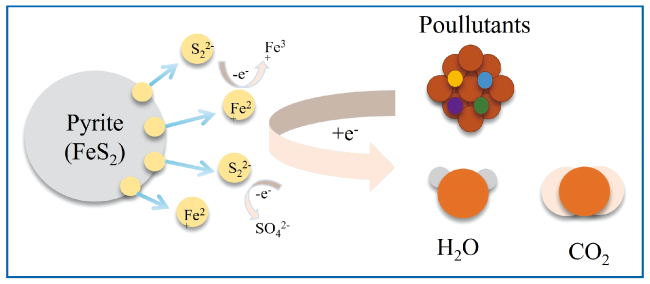
1 引言
2 黄铁矿的吸附作用
2.1 黄铁矿吸附作用机理及应用
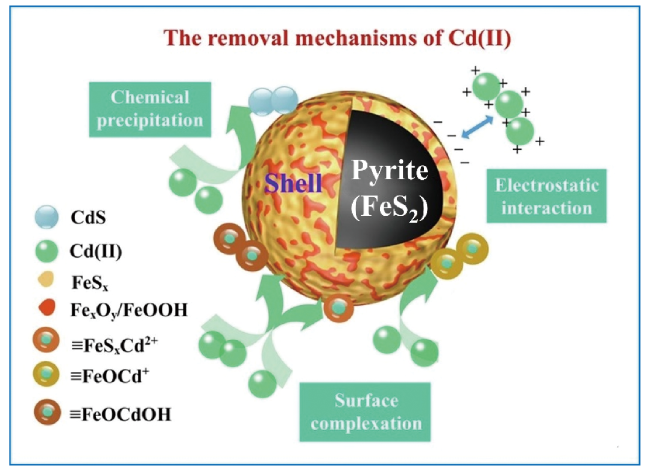
2.1.1 黄铁矿对重(类)金属吸附去除
2.1.2 黄铁矿对无机盐的吸附去除
2.1.3 黄铁矿吸附去除有机污染物
2.2 黄铁矿类材料的改进及吸附能力的增强
2.2.1 改进型黄铁矿吸附去除重(类)金属
表1 黄铁矿改性材料吸附去除重(类)金属Table 1 Adsorption and removal of heavy metals by pyrite modified materials |
| Modification method | Modification material | Target metal | Removal performance | ref |
|---|---|---|---|---|
| Ball-milling | BM-ZVI/FeS2 | Sb(V) | 134 mg/g | 20 |
| BM-FeS2 | Pb(Ⅱ) | 34.10 mg/g | 42 | |
| BM-FeS2 | Cr(Ⅵ),Cd(Ⅱ),Pb(Ⅱ) | 4.75 mg/g, 2.87 mg/g, 4.91 mg/g | 46 | |
| Thermal modification | SV-FeS2 | Ni(Ⅱ) | 6.45 mg/g | 21 |
| FeS2/α-Fe2O3 | Sb(V) | 347.2 mg/g | 43 | |
| Element doping | Ni-FeS2 | Se(Ⅳ) | 15.79 mg/g | 44 |
| Loading | PY+AC-FA | Hg(Ⅱ) | 239.26 μg/g | 45 |
2.2.2 改进型黄铁矿吸附去除无机盐
2.2.3 改进型黄铁矿吸附去除有机污染物
3 黄铁矿的催化氧化作用
3.1 黄铁矿催化氧化作用机理及应用
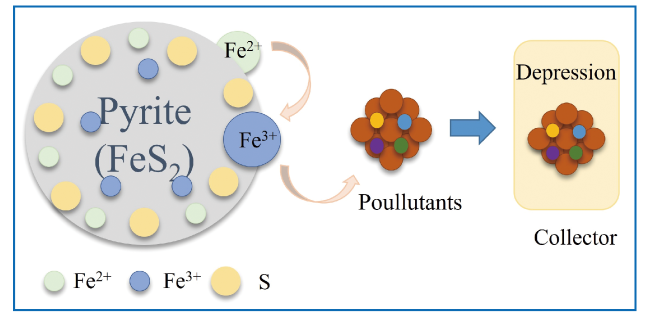
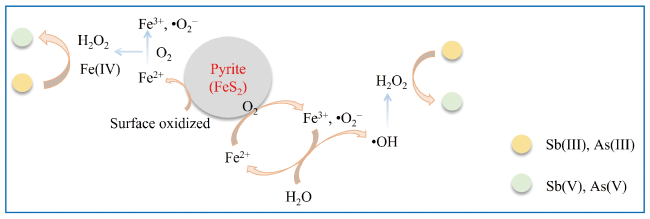
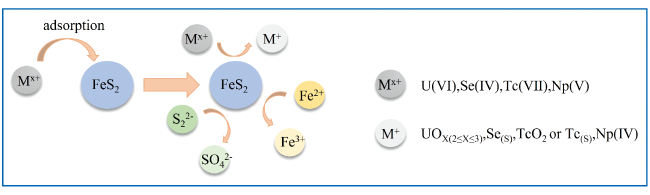
3.1.1 黄铁矿对重(类)金属的氧化去除
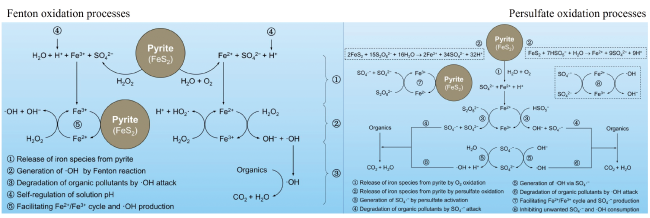
3.1.2 黄铁矿催化氧化降解有机污染物
3.2 黄铁矿类材料改进及催化氧化能力的增强
3.2.1 改进型黄铁矿催化氧化去除重(类)金属
表2 黄铁矿改性材料催化氧化去除重(类)金属Table 2 Removal of heavy metals by oxidation of pyrite modified materials |
3.2.2 改进型黄铁矿催化氧化降解有机污染物
表3 改进型黄铁矿催化氧化降解有机物Table 3 Modified pyrite catalytic oxidation degradation of organic compounds |
| Modification method | Modification material | Target metal | Removal performance | ref |
|---|---|---|---|---|
| Ball-milling | Pyrite nanoparticles | Acid orange 7 | 16 mg/g | 77 |
| nano-pyrite | Sulfadiazine | 10 mg/g | 82 | |
| Heterostructure | FeS2/Fe2O3+TA | Carbamazepine | 1.3 mg/g | 78 |
| TiO2/FeS2 | Methylene blue | 6.1 mg/g | 83 | |
| Fe3O4@FeS2@C@MoS2 | Tetracycline | 12.5 mg/g | 84 | |
| ZnCo2O4/MnO2/FeS2 | Methyl orange | 3.84 mg/g | 85 | |
| FeS2/rGO | Methylene blue | 41.67 mg/g | 86 | |
| FeS2-Fe1-xS | Acid orange 7 | 15 mg/g | 87 | |
| CuO-FeS2 | Brilliant green | 2 mg/g | 88 | |
| Loading | FeS2/H2O2+AC, BC, CNTS | Ciprofloxacin | 89 mg/g, 71 mg/g, 68 mg/g | 80 |
4 黄铁矿的还原及催化还原作用
4.1 黄铁矿还原及催化还原作用机理及应用
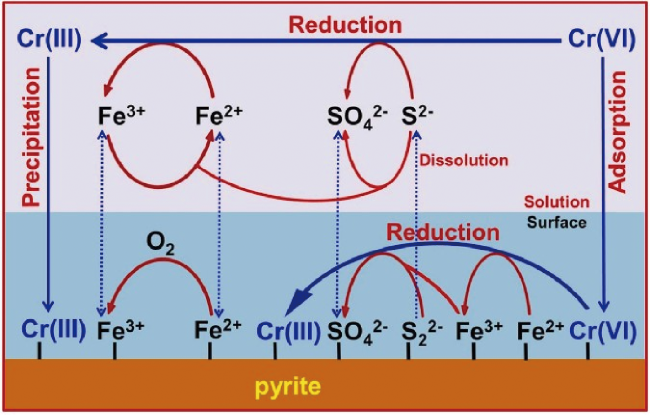
4.1.1 黄铁矿对重金属的还原去除
4.1.2 黄铁矿对无机盐的还原去除
4.1.3 黄铁矿催化还原降解有机污染物
4.2 黄铁矿类材料的改进及还原能力的增强
4.2.1 改进型黄铁矿还原去除重金属
表4 黄铁矿改性材料还原去除重金属Table 4 Removal of heavy metals by reduction with pyrite modified materials |
| Modification method | Modification material | Target metal | Removal performance | ref |
|---|---|---|---|---|
| Ball-milling | BM-FeS2@BC | Cr(Ⅵ) | 134 mg/g | 103 |
| Element doping | Ni-FeS2/FeS2 | Cr(Ⅵ) | 40 mg/g | 104 |
| Heterostructure | FeS2/Fe2O3 | Cr(Ⅵ) | 37.5 mg/g | 6 |
| α-FeOOH/FeS2 | Cr(Ⅵ) | 25 mg/g | 105 | |
| Loading | FeS2+Sepiolite | Cr(Ⅵ) | 14.27 mg/g | 102 |
| FeS2/Fe0 | Cr(Ⅵ) | 16.67 mg/g | 106 | |
| FeS2/biochar | Cr(Ⅵ) | 10 mg/g | 107 | |
| pyrite-marcasite-magnetite | Cr(Ⅵ) | 50 mg/g | 108 |