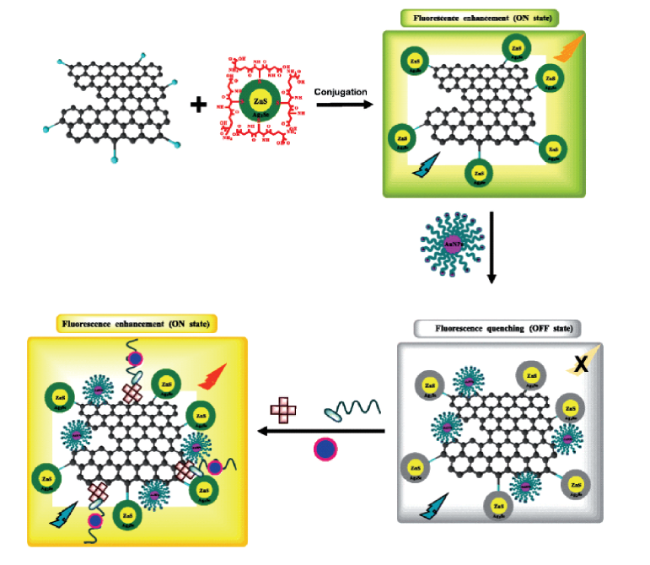
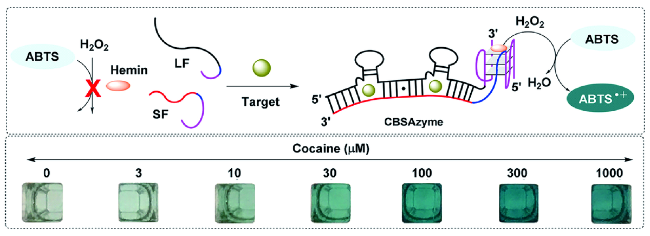
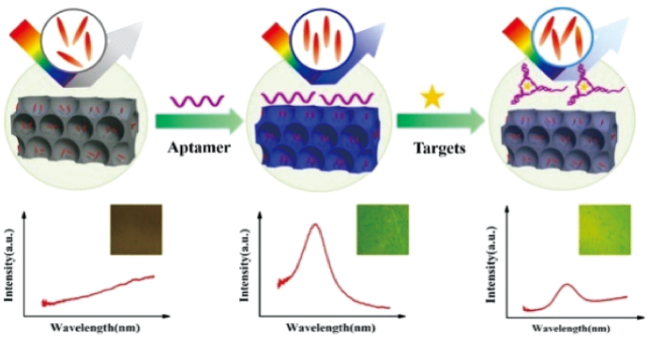
1 引言
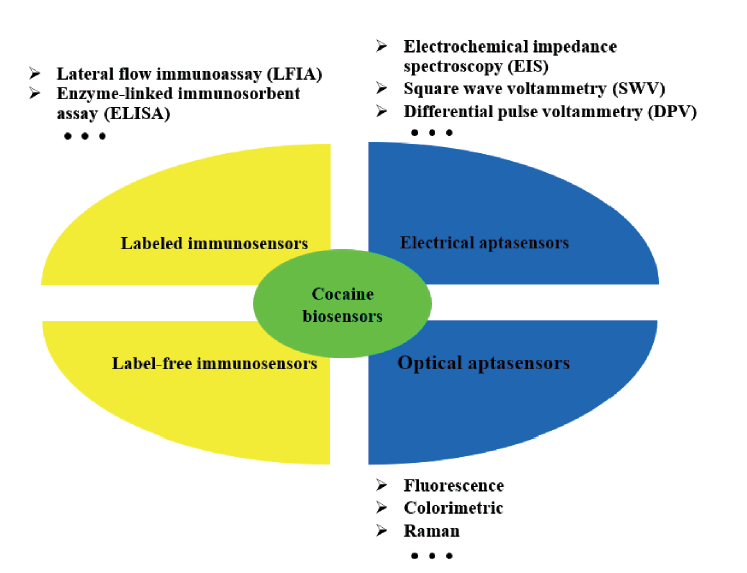
2 用于可卡因检测的免疫传感器
表1 不同可卡因免疫传感器及其检出限对比Table 1 A comparison of different cocaine immunosensors and their limits of detection |
| Approach of detection | Used sample | Linear detection range (mol/L) | Limit of detection (mol/L) | ref |
|---|---|---|---|---|
| Electrochemical-based ELISA | Water/Saliva/Urine | — | 4.95×10-13 | 19 |
| Colorimetric Immuno-microarray | Oral fluids | 3.63×10-9~9.9×10-7 | 3.63×10-9 | 21 |
| LFIA | Urine | 1.65×10-8~1.65×10-6 | 1.65×10-8 | 26 |
| LFIA | Saliva | 1.65×10-8~3.30×10-6 | 1.62×10-9 | 27 |
| Electrochemical | Urine/Sweat/Saliva/Serum | 1.65×10-8~8.25×10-7 | 1.19×10-8 | 30 |
| Fluorescence | PBS buffer | — | 2.30×10-11 | 31 |
| Electrochemical | PBS buffer | 0.50×10-6~2.50×10-5 | — | 34 |
| SHG | PBS buffer | — | 7.5×10-11 | 35 |
2.1 标记免疫传感器
2.1.1 酶联免疫吸附测定
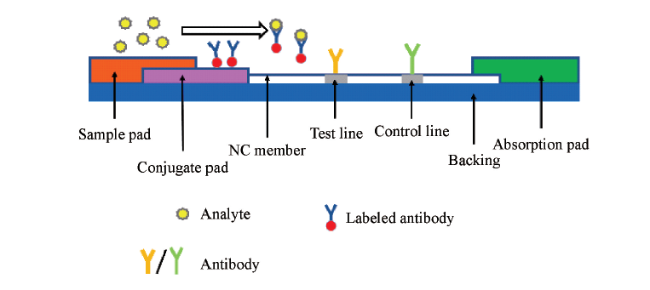
2.1.2 侧向流动免疫分析法
2.1.3 其他免疫传感器
2.2 非标记免疫传感器
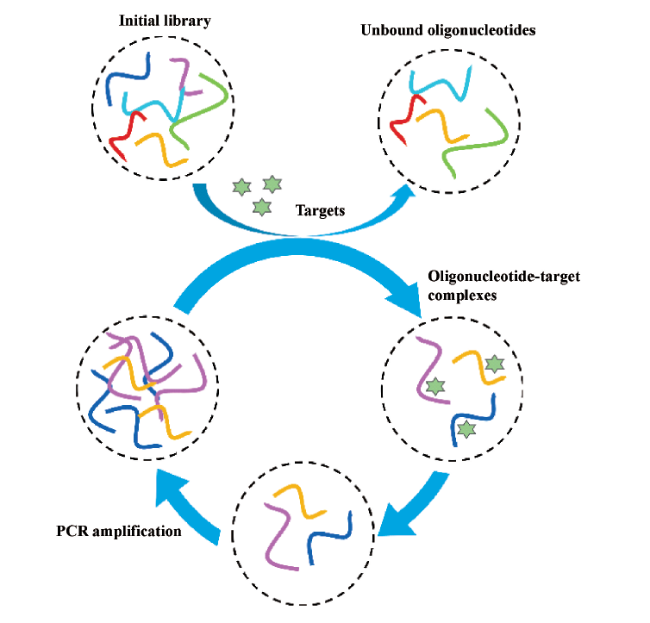
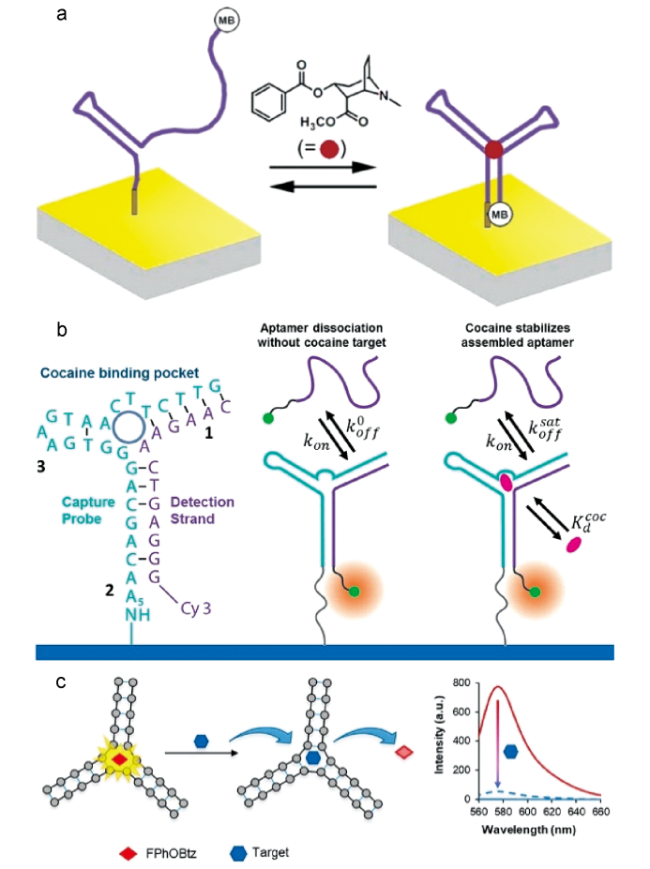
3 用于检测可卡因的适配体传感器
表2 不同可卡因适配体传感器及其检出限对比Table 2 A comparison of different cocaine aptasensors and their detection limits |
| Method | Linear range (mol/L) | Detection limit (mol/L) | ref |
|---|---|---|---|
| Fluorescence | — | 5×10-6 | 62 |
| Fluorescence anisotropy | — | — | 63 |
| Fluorescence | 0~1×10-5 | 5×10-8 (in 10% saliva) | 64 |
| Fluorescence | 5×10-10~8×10-8 | 8.4×10-11 | 65 |
| Fluorescence | 0~1×10-10 | 5.4×10-13 | 66 |
| Cas-12a based fluorescence | 4.7×10-7~1.5×10-2 | 3.4×10-7 | 67 |
| EWF-based fluorescence | 1×10-5~5×10-3 | 1.05×10-5 | 68 |
| Fluorescence | 1×10-6~5×10-4 | 2.5×10-7 | 69 |
| Fluorescence | 1×10-7~1×10-4 | 4.6×10-9 | 72 |
| Fluorescence | 1×10-8~1×10-4 | 8×10-10 | 73 |
| Colorimetric | — | 8.25×10-9 mol (visual) 7.79×10-9 mol (camera) | 75 |
| Colorimetric | 2×10-10~2.5×10-8 | 9.7×10-10 | 76 |
| Colorimetric | — | 1.32×10-8 mol (visual) 1.17×10-8 mol (camera) | 77 |
| Colorimetric | 0~1×10-6 | 7.49×10-9 | 78 |
| Colorimetric | 1×10-9~1.5×10-7 | 5×10-10 | 79 |
| Colorimetric | 1×10-8~1.5×10-7 | 3.3×10-9 | 80 |
| Colorimetric | 2×10-9~1×10-7 | 4.4×10-10 | 81 |
| Colorimetric | — | 1×10-5 | 82 |
| Colorimetric | 1×10-5~5×10-3 | 5×10-5 (in urine) 2×10-4 (in sweat) | 83 |
| SWV | 5×10-8~1×10-6 and 1×10-6~3.5×10-5 | 2.1×10-8 | 86 |
| SWV | — | — | 87 |
| EIS/DPV | 3.3×10-12~3.3×10-9 | 1.29×10-12 (EIS) 2.22×10-12 (DPV) | 89 |
| EIS | 1×10-15~1×10-12 and 1×10-12~1×10-7 | 3.33×10-16 | 90 |
| EIS | 9×10-11~8.5×10-8 | 2.9×10-11 | 91 |
| DPV | 3.3×10-10~3.3×10-5 | 1×10-10 | 92 |
| SWV | 3.3×10-11~3.3×10-6 | 9×10-12 | 93 |
| DPV | 1×10-11~7×10-11 | 2.6×10-13 | 94 |
| DPV | 4×10-11~1.5×10-7 | 1.5×10-11 | 95 |
| EMPAS | 2×10-6~5×10-5 | 9×10-7 | 96 |
| EMPAS | 5×10-7~5×10-6 | 3×10-7 | 97 |
| Interfacial capacitance sensing | 1.45×10-14~1.45×10-11 | 7.8×10-15 | 98 |
| FET | — | 1×10-9 | 99 |
| Conductance change | 1×10-9~1×10-5 | 1×10-9 | 102 |
| α-HL nanopore | 5×10-8~1×10-4 | 5×10-8 | 103 |
| Personal glucometer | 1×10-8~6×10-7 | 5.2×10-9 | 104 |
| LC optical sensor | 1×10-9~1×10-5 | 1×10-9 | 106 |
| LC optical sensor | 1×10-10~1×10-5 | — | 108 |
| LPFG | 2.5×10-5~7.5×10-5 | 2.5×10-5 | 109 |
| PIERS | 5×10-9~1×10-5 | 5×10-9 | 110 |
| ECL | 1×10-10~1×10-7 | 6×10-11 | 111 |