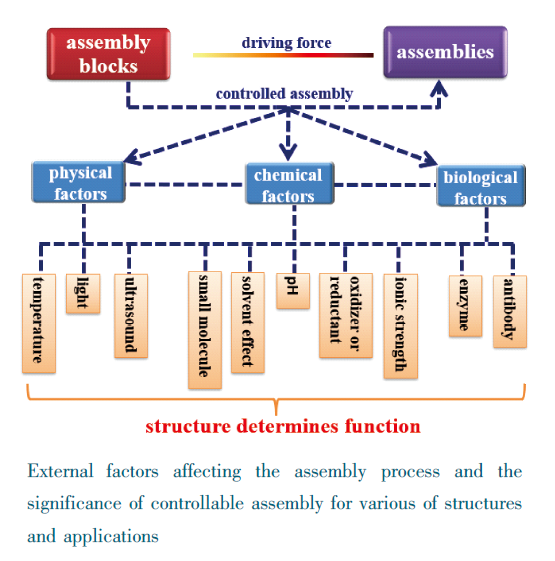
1 引言
2 二苯丙氨酸二肽基微纳材料的可控组装
2.1 物理类因素(温度、光、超声)
2.1.1 温度
2.1.2 光
2.1.3 超声
2.2 化学类因素(外源小分子、离子强度、溶剂效应、pH)
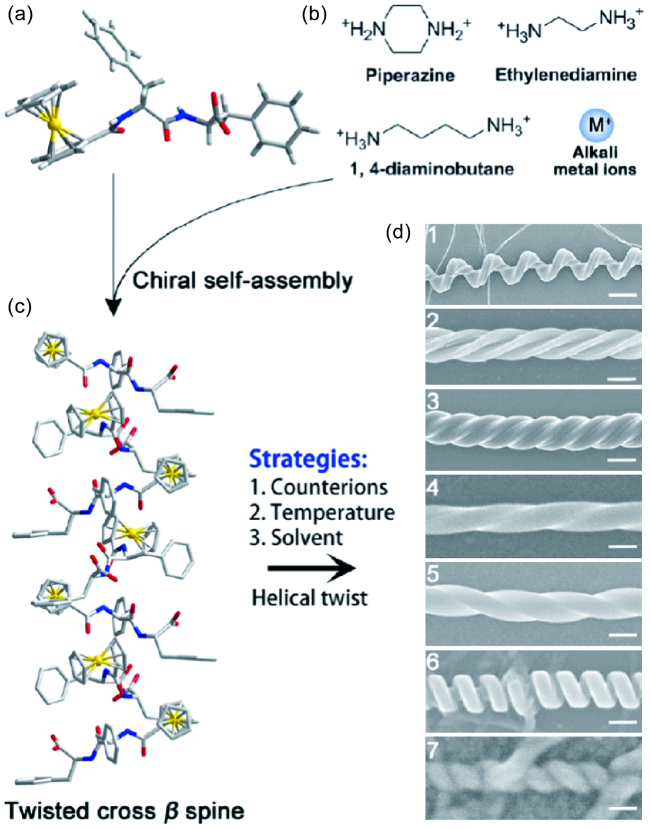
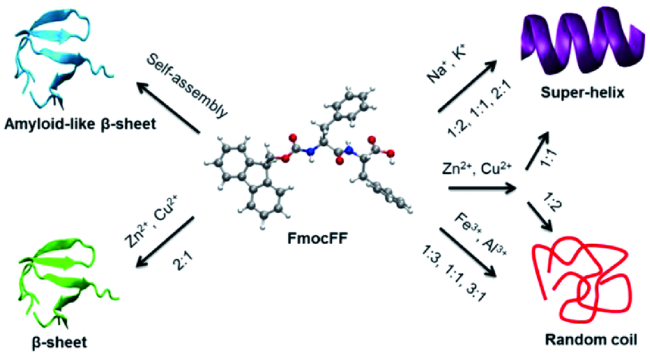
2.2.1 外源小分子
2.2.2 离子强度
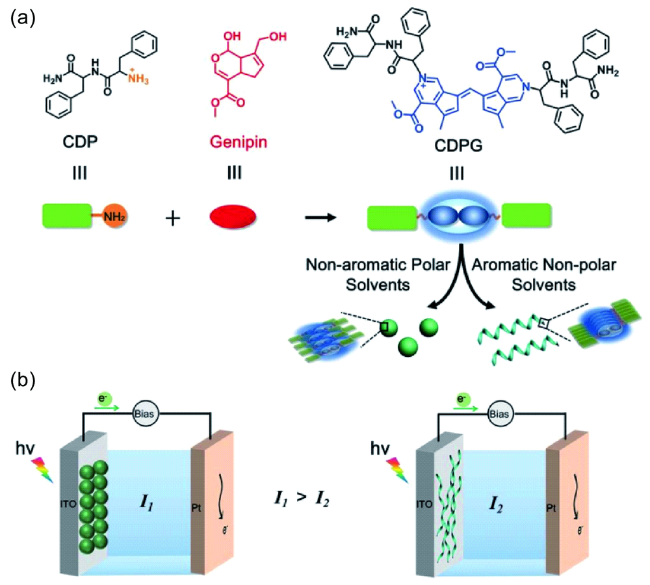
2.2.3 溶剂效应
2.2.4 pH
2.3 生物类因素(酶)
3 二苯丙氨酸二肽基组装体的应用
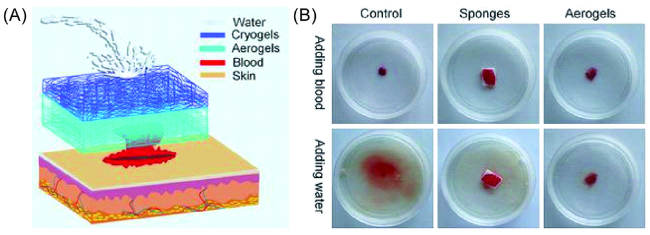
3.1 生物医学
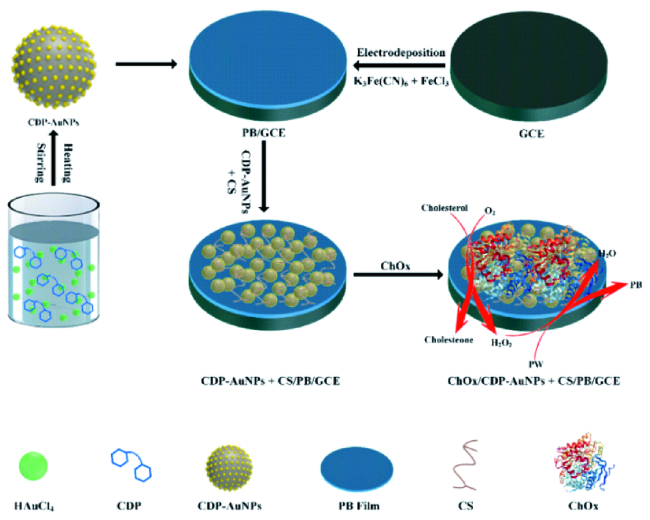
3.2 生物传感
3.3 光电材料
3.4 光波导
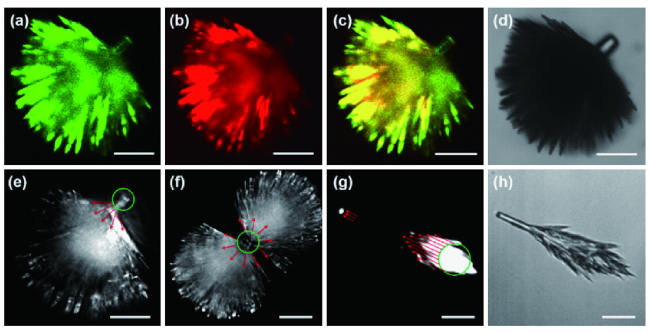
图9 (a~c) 罗丹明B掺杂的二苯丙氨酸(FF)枝化结构激光共聚焦图像及(d)明场图像; FF-RhB枝化结构的(e~g)光波导照片和(h)明场照片,标尺为 20 μm[98]Fig. 9 (a~c) CLSM images and (d) bright-field image of rhodamine B doped diphenylalanine branched structure. (e, f) Photoluminescence images of rhodamine B-doped diphenylalanine branched structures excited at the rod position. (g) Photoluminescence image and (h) bright-field image of rhodamine B-doped diphenylalanine branched structures excited at the tips of the branches. All the scale bars represent 20 μm[98] |
3.5 催化
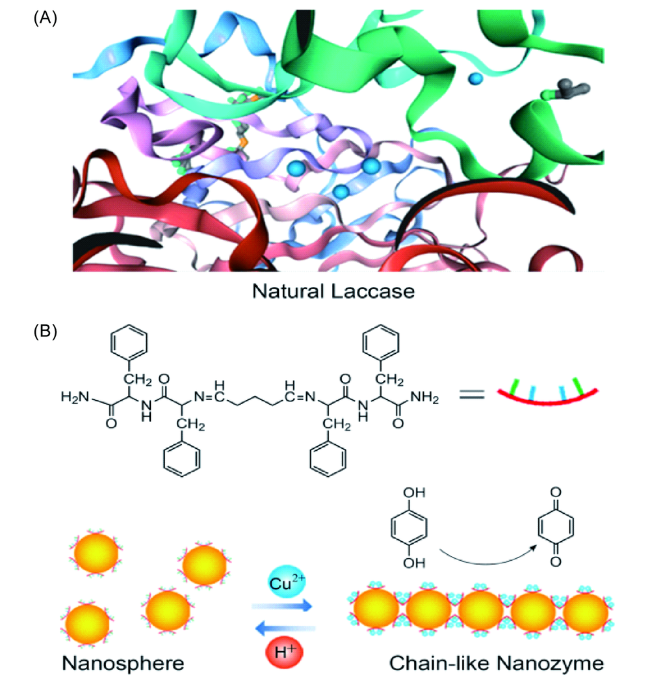
图10 (A) 天然漆酶的结构式以及(B) 二肽基超分子装配体在Cu2+和H+的调控下可逆转化及催化过程的示意图[33]Fig.10 (A) Highlighted crystal structure of fungus laccase from Trametes versicolor (PDB: 1GYC). (B) Chemical structure of CDPGA, schematic illustration of reversible transformation of nanospheres to nanochains modulating by Cu2+ and H+, and switchable enzyme-like catalytic oxidation of hydroquinone to benzoquinone[33] |