1 生物大分子聚集的生理及病理现象
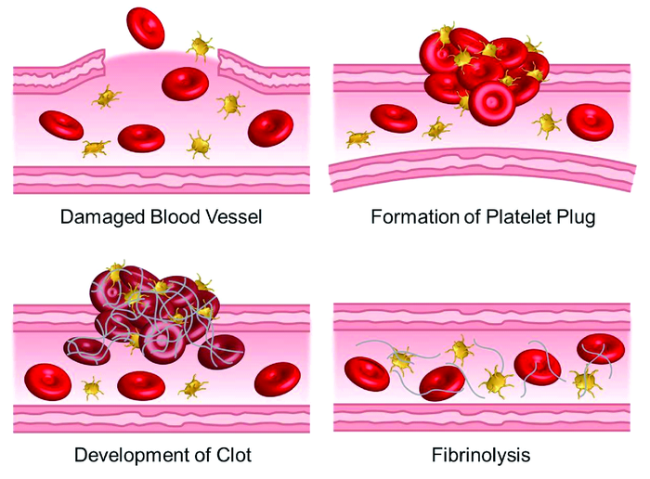
1.1 凝血现象
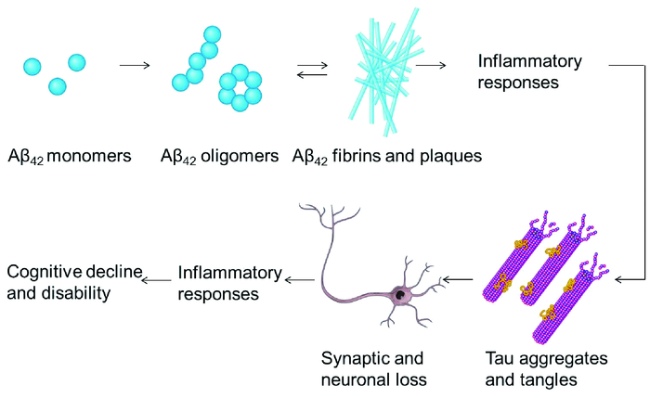
1.2 阿尔茨海默病
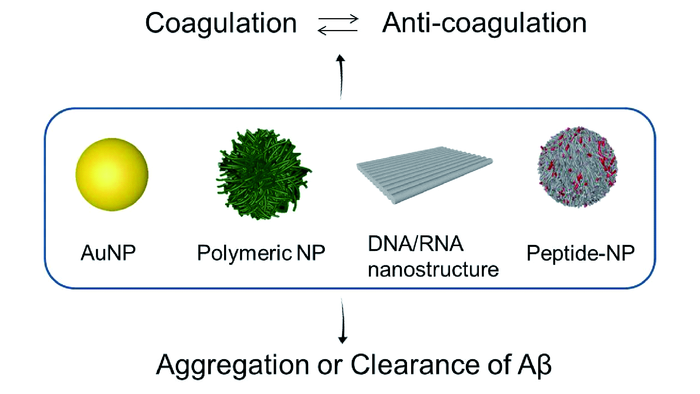
2 对生物凝聚态具有调控作用的纳米材料
2.1 金属纳米颗粒
2.2 高分子纳米颗粒
2.3 自组装核酸纳米材料
2.4 自组装多肽纳米材料
3 纳米材料对生物凝聚态的调控
3.1 纳米材料对凝血现象的调控——促进血液凝聚
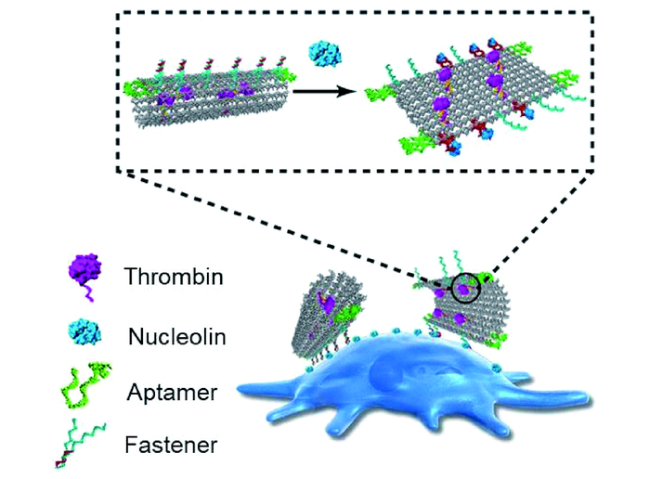
3.2 纳米材料对凝血现象的调控——纳米抗凝剂的开发
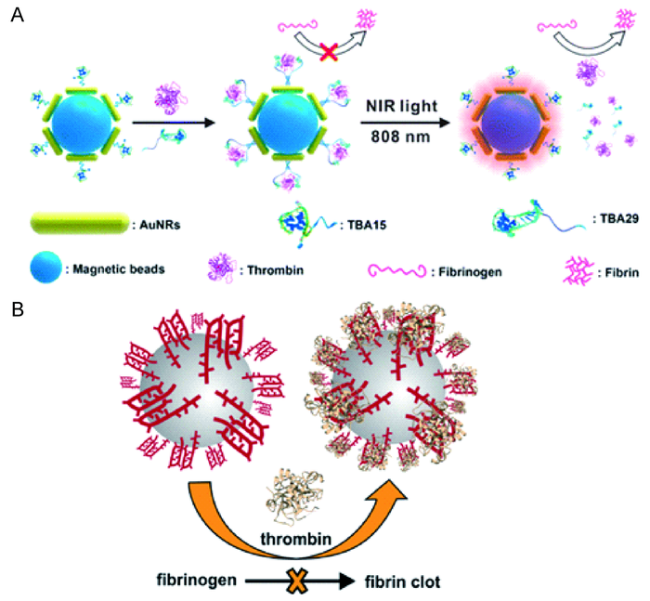
图4 纳米抗凝剂。(A)金纳米棒和磁珠为核心共组装的“闭环”核酸适配体结构[34]及(B)DNA适配体-高分子胶束[37]用于抗凝 Fig.4 Nano-anticoagulants. (A) Thrombin Inhibition by the MB/AuNRs-Closed-Loop Structure [34]. Copyright 2015, American Chemical Society.(B) Self-assembled DAPA-NPs and the thrombin inhibition[37]. Copyright 2017, American Chemical Society |
3.3 纳米材料对于阿尔茨海默病的诊断与治疗
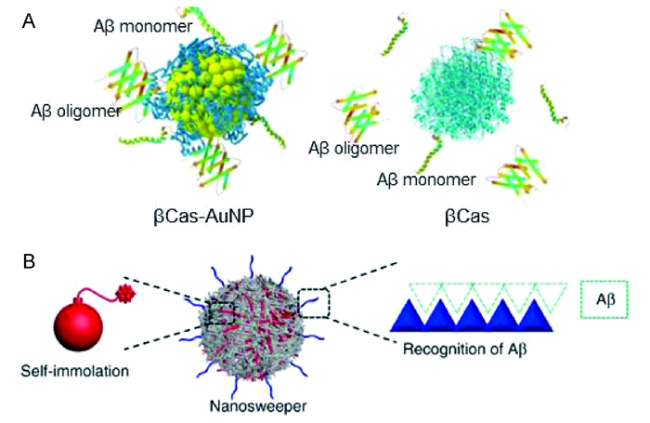
图5 用于Aβ调控与清除的纳米材料。(A)酪蛋白包被的金纳米颗粒用于增强Aβ亲和作用[41]。(B)基于多肽的自组装纳米颗粒用于捕获和清除Aβ聚集[42] Fig.5 Nanomaterials for Aβ regulation and clearance. (A) Enhanced binding of Aβ with βCas promoted by the AuNP substrate[41]. Copyright 2019, Nature Publishing Group.(B) Peptide nanoparticle captures Aβ by hydrogen-bonded co-assembly and internalizes a substantial amount into cells carrying Aβ[42]. Copyright 2018, Nature Publishing Group |