由于MIL-101(Cr)-NH
2的笼状结构,甚至其麦芽糖(亲水基团)官能化结构,在人血清中富集对应于42种糖蛋白中的116种糖肽和65种糖蛋白中的111种糖肽。这些结果促使我们关注孔隙参数,如大小和形状(笼、1D通道、3D交叉点等)以及亲水亲合力。在通过Fe
3O
4@Mg-MOF-74富集后,即使当糖肽、BSA和HRP的质量比为1∶800∶800时,通过MALDI-TOF MS仍可以鉴定出8个匹配的糖肽信号
[38]。效率的显著提高可归因于1D通道(与MIL-101的笼状结构相比)和适当的孔径(延伸其孔径将导致富集效率的急剧降低)。Ji等
[39]用γ-环糊精作为结构单元与K
+和乙二醇二缩水甘油醚组装LCD-MOF。在选择性评估中,LCD-MOF能有效去除对糖肽的离子有抑制的非糖肽信号,从而达到增强糖肽信号的目的。即使当人体免疫球蛋白的胰蛋白酶酶解物处于3.3 fmol的极低水平时,也可以检测到S/N>3的4种糖肽,低于两性离子HILIC材料(10 fmol)的浓度。使用稳定同位素二甲基标记方法,计算LCD-MOFs 富集糖肽后的回收率为84% ~103%。对于100 mg胰蛋白酶小鼠肝脏酶解物,在用LCD-MOFs富集后,通过LC-MS/MS可鉴定290种糖蛋白和344种糖肽。由于亲水性γ-CD作为配体,所得到的纳米尺寸LCD-MOF复合材料具有所需的亲水性。同时证实了糖肽和LCD-MOF之间存在多种相互作用(氢键、静电和偶极相互作用)。Zhang等
[40]基于亲水相互作用,用MIL-101(Cr)-NH
2对糖肽进行富集测试。由于其高比表面积、多孔结构和强亲水性等特性,可有效富集标准糖蛋白消化物,从10 mL人体血清中鉴定出42种糖蛋白及116个独特的N-糖基化位点。氨基官能化的MOFs可以用官能团或分子进一步修饰,用于选择性富集糖肽。Ma等
[41]在室温下用TMSN
3和
tBuONO对MIL-101(Cr)-NH
2进行处理形成叠氮化物官能化的MIL-101(Cr)-N
3。MIL-101(Cr)-N
3和1-炔丙基-O-麦芽糖发生“点击化学反应”合成MIL-101(Cr)-maltos。该材料可富集浓度低至50 fmol 的免疫球蛋白,观察到至少9种糖肽。当免疫球蛋白的浓度低至1 fmol时,可以在S/N>3时检测到两种糖肽。检测限远低于大多数亲水性吸附剂,如二氧化硅基两性离子聚合物(10 fmol)。由于极度温和的叠氮化步骤和“点击化学反应”的通用性,这种后合成方法对于从氨基衍生的MOFs的快速官能化是通用的,但对MOFs有一定要求,需能与叠氮基发生反应。Ma等
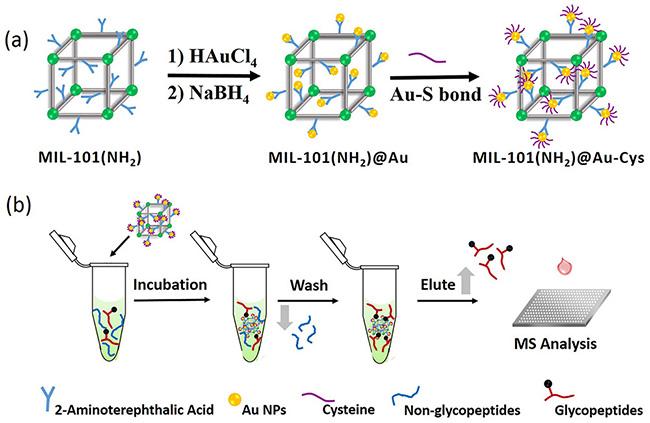
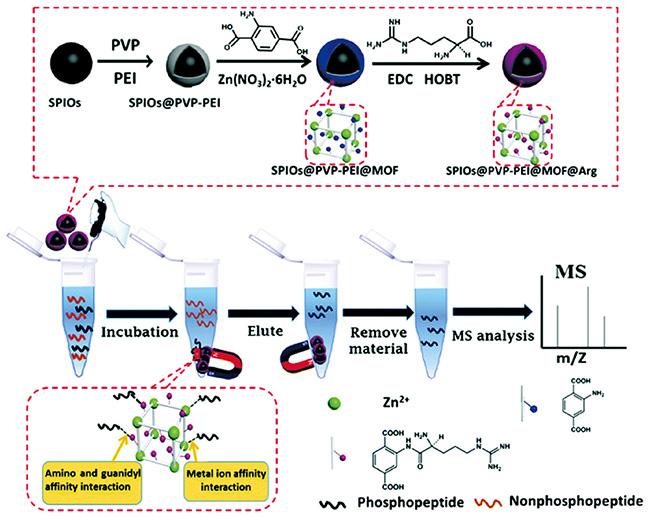
[42]进一步用L-半胱氨酸(L-Cys)修饰MIL-101(Cr)@Au得到MIL-101(NH
2)@Au-Cys,具有孵育时间短(5 min)、结合能力大(150 mg/g)、选择性良好(1∶50)、回收率高(超过80%)和检测限低(1 fmol)的优点(
图2)。可从复合物HeLa细胞裂解物中鉴定出1069个N-糖肽和614个N-糖蛋白,检测出多达1123个N-糖基化位点。Wang等
[43]通过在MIL-101(Cr) -NH
2表面接枝有亲水性树枝状大分子聚酰氨基胺(PAMAM)合成双重亲水性材料。在标准糖蛋白富集中,当非糖肽的浓度比目标N-糖肽高100倍时,功能性MOFs材料显示出低检测限(1 fmol/μL)和良好的选择性。但聚酰氨基胺(PAMAM)仅能与部分MOFs发生结合且结合原理不明。功能性MOFs材料可以在制备过程中添加功能性配体合成不同的亲水材料。Liu等
[44]通过ZrCl
4和二元配体对苯二甲酸(TPA)和间苯二甲酸(IPA)的一步反应制备具有大量游离羧基的亲水性UiO-66-COOH。与单配体的UiO-66相比,二元配体的UiO-66-COOH表现出更大的亲水性和更好的糖肽富集能力。在富集之前,从1 pmol/μL免疫球蛋白消化物的原始MS谱中能检测到6种糖肽,而在UiO-66-COOH富集后,检测出24种高强度的糖肽。此外,Xie等
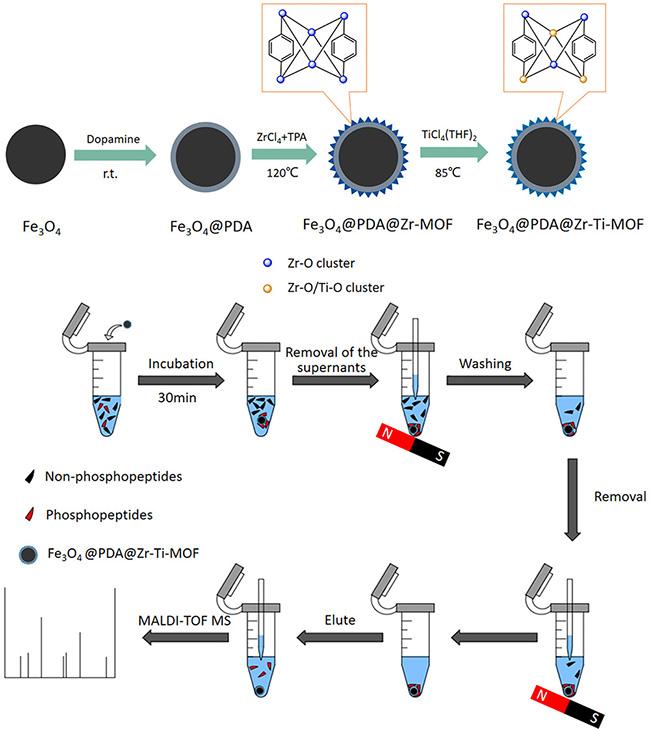
[45]将PDA层引入磁性Fe
3O
4核的表面,然后与亲水性2-磺基对苯二甲酸和锆离子组装通过机械分离合成Fe
3O
4@PDA@Zr-SO
3H。当HRP:BSA的质量比为1∶100时,15个糖肽在光谱中占主导地位,同时没有出现BSA峰。用Fe
3O
4@PDA@Zr-SO
3H对人体血清胰蛋白酶酶解物富集后,通过MS可检测到177个N-糖肽和275个糖基化位点。Fe
3O
4@PDA@Zr-SO
3H材料合成是将反应物置于机械分离而不是反应容器中合成,虽使其易于制备但应用范围较窄。Wang等
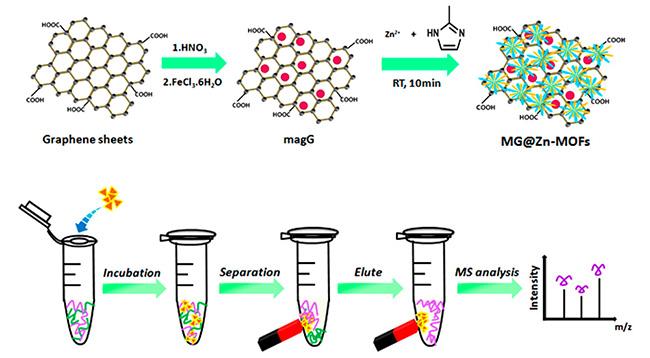
[46]制备一种亲水型多孔复合材料MG@Zn-MOFs(
图3)。由于其强的磁响应性,高比表面积、优异的生物相容性和独特的尺寸排阻效应,MG@Zn-MOFs显示优良的灵敏度、选择性以及良好的可回收性。在实际应用中,经过MG@Zn-MOFs处理后,从1 mL人体血清中检测到517种N-糖肽和151种特征性糖蛋白。通过改变MOFs外壳的类型,可以改变磁性材料的表面特性。控制金属-有机骨架(MOFs)层的石墨烯或石墨烯基复合材料的均匀和完全涂层是一个难题。Xie等
[47]使用Fe
3O
4@PDA@UiO-66-NH
2从人体血清中富集来自121种不同糖蛋白的307个N-糖基化肽和来自16种不同磷酸蛋白的33种磷酸肽。Peng等
[48]通过在UiO-66-NH
2上引入磷酸基团及固定锆制备DZMOF。然后将DZMOF与果糖-1,6-二磷酸(FDP)反应得到DZMOF-FDP
n。即使当免疫球蛋白与牛血清白蛋白的摩尔比达到约1∶5000时,该MOF在模拟糖肽复合物的抗干扰富集中也具有极佳的富集性能,可从人体血浆中鉴定出380个N-糖肽。双亲水金属-有机骨架不仅含有亲水表面位点还含有亲水基质,FDP修饰的DZMOF对非肽和干扰蛋白的抗干扰能力,有助于制备高选择性亲水探针富集糖肽。Sun等
[49]设计并合成了亲水性磁性介孔二氧化硅材料(Fe
3O
4@mSiO
2-IDA)。通过利用其较大比表面积、优异的亲水性和对所有类型的糖肽的无偏性亲合力的优点,Fe
3O
4@mSiO
2-IDA纳米材料成功鉴定了来自辣根过氧化物酶酶解物中的25种糖肽和人体免疫球蛋白中的33种糖肽。但将亚氨基二乙酸(IDA)基团接枝到磁性介孔二氧化硅(mSiO
2)纳米材料的内壁的条件较为苛刻。