Contents
1 引言
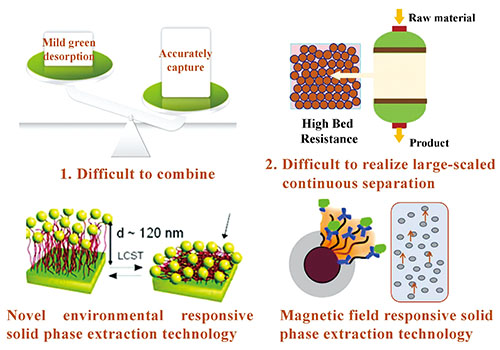
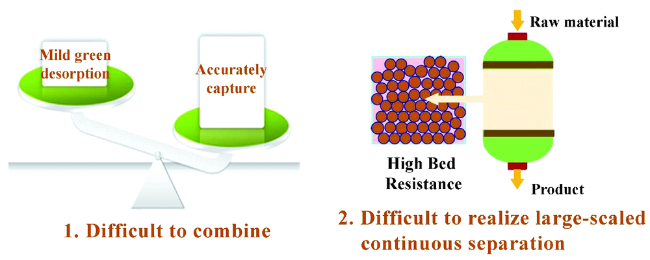
2 新型环境响应固相萃取技术实现蛋白精准可控分离
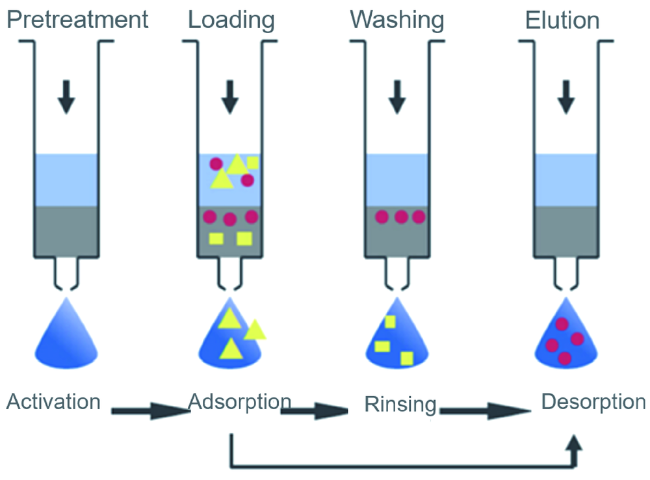
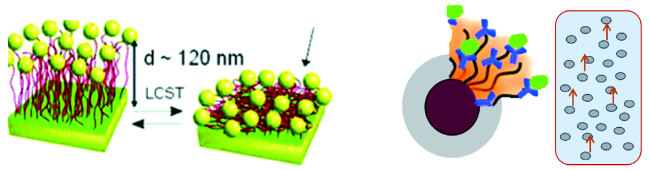
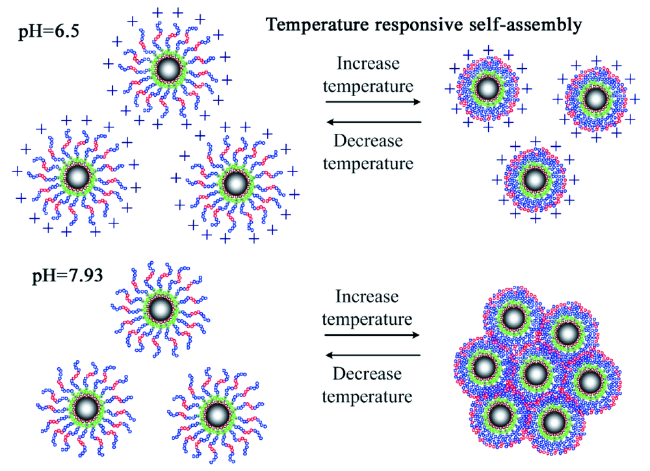
2.1 环境响应性介质在分离中的应用
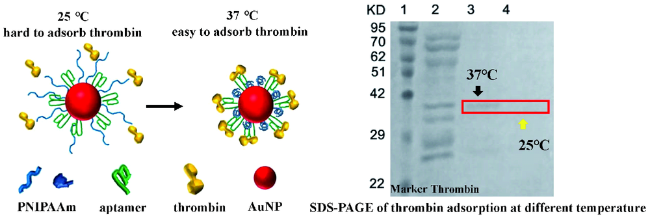
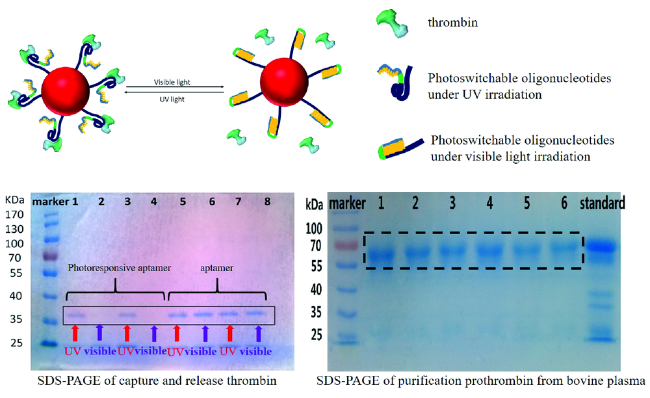
2.2 环境响应核酸适配体介质用于酶高效精准可控分离
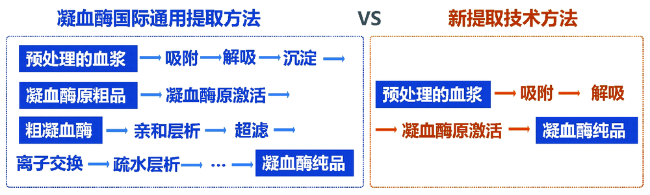
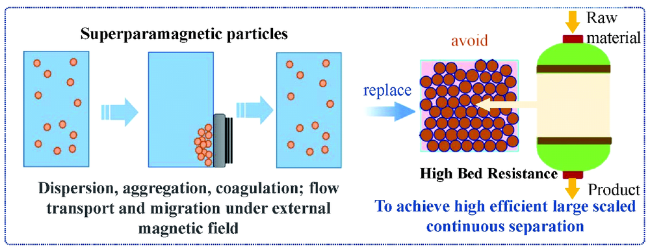
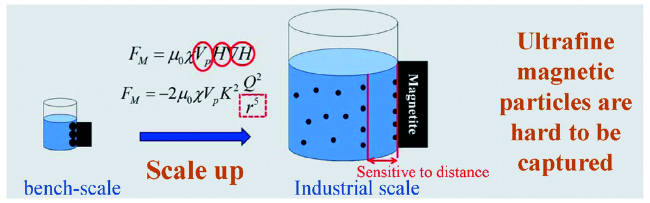
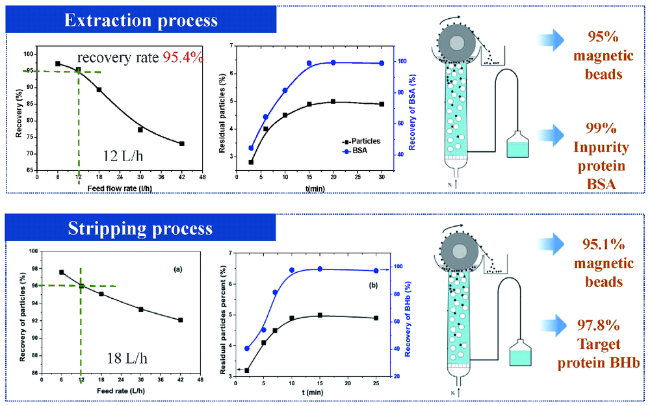
3 磁响应固相萃取技术实现高效分离
3.1 大容量高速率的磁响应固相萃取剂
表1 国内外同行比较Table 1 Comparison of domestic and foreign counterparts |
| Adsorbent | qm (mg/g) | E. T. (min) | pH range | Ref |
|---|---|---|---|---|
| γ-Fe2O3@δ-FeOOH | 25.8 | — | 2.5 | 25 |
| Fe3O4@PAA-DETA | 11.24 | — | 5.0 | 26 |
| NiFe2O4 | 30 | — | 5.0 | 27 |
| Fe3O4-PEI-MMT | 8.8 | — | 5.0 | 28 |
| Fe3O4-Cyanex-301 | 30.8 | 120 | 2.0 | 29 |
| ZnFe2O4-Ce3+ | 57.24 | 4320 | 2.0 | 30 |
| Poly(MMA-DVB-GMA)-EDA | 61.35 | 60 | 2.0~3.0 | 31 |
| Fe3O4@polypyrrole | 169.49 | 180 | 1.0~6.0 | 32 |
| Poly(GMA-EGDMA)-PEI | 137.7 | 120 | 1.0~6.0 | 33 |
| Poly(MA-DVB)-EDA | ~36 | 60 | 3.0 | 34 |
| Magnetic chitosan beads | 69.4 | > 60 | 3.0~5.0 | 19b |
| Magnetic chitosan-EDA | 51.813 | 10 | 2.0 | 35 |
| Magnetic chitosan-CAGS | 58.48 | 110 | 2.0 | 19c |
| Chitosan/ montmorillonite | 35.71 | 100 | 1.0~3.0 | 36 |
| Magnetic chitosan nanoparticles | 55.80 | 150 | 2.0~3.0 | 37 |
| Cyclodextrin-chitosan/GO | 67.66 | — | 1.0~3.0 | 38 |
| MnFe2O4/Chitosan | 15.4 | 360 | 6.0 | 39 |
| MnFe2O4-Chitosan | 51.79 | 480 | 5.0 | 39 |
| Fe3O4-Fungus@alginate-PAA | 6.97 | 720 | 1.0 | 40 |
| Fe3O4@PVA-PEI | 88.4 | 8 | 1.0~3.0 | 41 |
| Fe3O4@PGMA-PEI | 492.6 | 10 | 1.0~7.0 | 42 |
| Fe3O4@Pst-MIMCl | 104.0 | 30 | 1.0~7.0 | 43 |
| Fe3O4@SiO2@CE-EDA | 171.5 | 10 | 1.0~6.0 | 44 |
| Fe3O4@SiO2@CTS-PEI | 236.4 | 60~120 | 1.0~6.0 | 45 |
| Fe3O4@SiO2@CTS-GTMAC | 233.1 | 40~120 | 1.0~7.0 | 43 |