

Supramolecular Self-Assembly Applied for the Design of Drug Delivery Systems
Received date: 2019-08-15
Online published: 2019-10-23
Supported by
National Natural Science Foundation of China(21890732)
National Natural Science Foundation of China(21921003)
Copyright
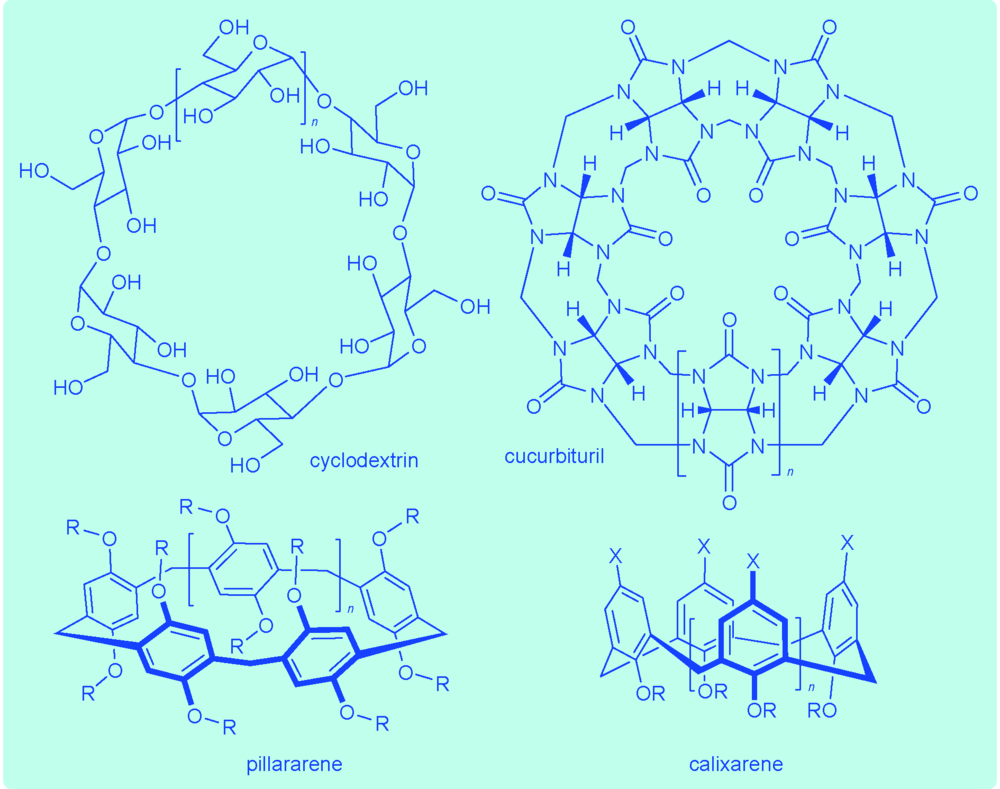
Supramolecular self-assembly provides a new strategy for the development of drug delivery systems from molecular components. With non-covalent interactions as driving forces, supramolecular drug delivery systems(SDDSs) can realize precise component control at the molecular level, increased predictability of the self-assembled structures, tunable control of morphologies and sizes, controlled release of delivered drugs. In this review, we first concisely introduce the background for the design of SDDSs and then describe important advances in SDDS development that involves the applications of cyclodextrin, calixarene, pillararene and cucurbituril based on host-guest interactions. Following these popular design principles, we further present the applications of water-soluble supramolecular organic frameworks as SDDSs. Finally, the challenges that need to be addressed for the practical translation of SDDSs are discussed.
Key words: supramolecule; drug delivery; host-guest interaction; self-assembly; antitumor drugs
Zi-Yue Xu , Yun-Chang Zhang , Jia-Le Lin , Hui Wang , Dan-Wei Zhang , Zhan-Ting Li . Supramolecular Self-Assembly Applied for the Design of Drug Delivery Systems[J]. Progress in Chemistry, 2019 , 31(11) : 1540 -1549 . DOI: 10.7536/PC190817
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
王梅祥 (
|
| [11] |
|
| [12] |
|
| [13] |
张双进(Zhang S J), 杨扬(Yang Y), 孙小强(Sun X Q), 尹芳华(Yin F H), 强琚莉(Jiang J L), 王乐勇(Wang L Y) . 化学进展(Prog. Chem.), 2016,28:244.
|
| [14] |
|
| [15] |
|
| [16] |
吉晓帆(Ji X F), 夏丹玉(Xia D Y), 颜徐州(Yan X Z), 王虎(Wang H), 黄飞鹤(Huang F H) . 高分子学报(Acta Polymerica Sinica), 2017,1:9.
|
| [17] |
马骧(Ma X), 田禾(Tian H), . 高分子学报(Acta Polymerica Sinica), 2017,1:27.
|
| [18] |
|
| [19] |
黄文忠(Huang W Z), 占田广(Zhan T G), 林沨(Lin F), 赵新(Zhao X) . 化学进展(Prog. Chem.), 2016,28:165.
|
| [20] |
徐江飞(Xu J F), 张希(Zhang X) . 高分子学报(Acta Polymerica Sinica), 2017,1:37.
|
| [21] |
|
| [22] |
|
| [23] |
潘梅(Pan M), 韦张文(Wei Z W), 徐耀维(Xu Y W), 苏成勇(Su C Y) . 化学进展(Prog. Chem.), 2017,29:47.
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
张丹维(Zhang D W), 王辉(Wang H), 黎占亭(Li Z T) . 高分子通报(Polymer Bulletin), 2018,6:243.
|
| [41] |
|
| [42] |
徐柳(Xu L), 钱晨(Qian C), 朱辰奇(Zhu C Q), 陈志鹏(Chen Z P), 陈瑞(Chen R) . 化学进展(Prog. Chem.), 2018,30:1341.
|
| [43] |
赖欣宜(Lai X Y), 王志勇(Wang Z Y), 郑永太(Zheng Y T), 陈永明(Chen Y M) . 化学进展(Prog. Chem.), 2019,31:783.
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
王以炫(Wang Y X), 刘育(Liu Y) . 化学学报(Acta Chimica Sinica), 2015,73:984.
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
| [83] |
|
| [84] |
|
| [85] |
薛敏(Xue M), 范芳芳(Fan F F), 杨勇(Yang Y), 陈传峰(Chen C F) . 化学进展(Prog. Chem.), 2019,31:491.
|
| [86] |
|
| [87] |
邵为(Shao W), 刘昕(Liu X), 王婷婷(Wang T T), 胡晓玉(Hu X Y) . 有机化学(Chinese Journal of Organic Chemistry), 2018,38:1107.
|
| [88] |
|
| [89] |
|
| [90] |
|
| [91] |
|
| [92] |
|
| [93] |
|
| [94] |
|
| [95] |
|
| [96] |
|
| [97] |
|
| [98] |
|
| [99] |
|
| [100] |
焦阳(Jiao Y), 张希(Zhang X) . 化学学报(Acta Cinica Sinica), 2018,76:659.
|
| [101] |
|
| [102] |
|
| [103] |
|
| [104] |
|
| [105] |
|
| [106] |
|
| [107] |
|
| [108] |
张智睿(Zhang Z R), 阚京兰(Kan J L), 冯华明(Feng H M), 刘青云(Liu Q Y), 陶朱(Tao Z), 肖昕(Xiao X) . 有机化学(Chinese Journal of Organic Chemistry), 2018,38:1972.
|
| [109] |
黄净净(Huang J J), 许志玲(Xu Z L), 练小卫(Lian X), 张晓东(Zhang X D W), 陶朱(Tao Z), 周清娣(Zhou Q D), 张前军(Zhang Q J), 卫钢(Wei G) . 高等学校化学学报(Chinese Journal of Chinese University), 2018,39:2425.
|
| [110] |
|
| [111] |
|
| [112] |
|
| [113] |
|
| [114] |
|
| [115] |
|
| [116] |
|
| [117] |
|
| [118] |
|
| [119] |
|
| [120] |
|
| [121] |
|
| [122] |
|
| [123] |
|
| [124] |
|
| [125] |
|
| [126] |
|
| [127] |
|
| [128] |
|
| [129] |
|
| [130] |
|
| [131] |
|
| [132] |
|
| [133] |
王辉(Wang H), 张丹维(Zhang D W), 黎占亭(Li Z T) . 高分子学报(Acta Polymerica Sinica), 2017,19.
|
| [134] |
|
| [135] |
|
| [136] |
|
| [137] |
|
| [138] |
|
| [139] |
|
| [140] |
|
| [141] |
|
/
| 〈 |
|
〉 |