

The Total Synthesis of ent-Kaurane Diterpenoids
Received date: 2019-08-08
Online published: 2019-10-23
Copyright
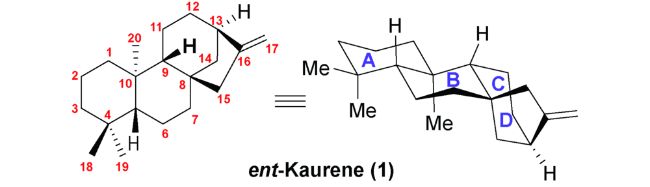
The ent-kaurane diterpenoids, widely distributed in terrestrial plants, represent an important group of tetracyclic diterpenes with diverse scaffolds and varied bioactivities. More and more studies have revealed that these compounds possess potent antitumor, antibacterial and anti-inflammatory activities. The tetracyclic ent-kaurane diterpenoids have attractive structural diversity owing to intramolecular cyclization, oxidative cleavage and rearrangements of their parent compounds. As a result, the total synthesis of ent-kaurane diterpenoids has received great attention from synthetic community during the past decades. This review describes the recent progress in this field, which includes total synthesis of C-20 non-oxygenated ent-kauranes such as(+)-lungshengenin D and pharicins A-C; total synthesis of C-20 oxygenated ent-kauranes such as maoecrystal P, eriocalyxin B, neolaxiflorin L and xerophilusin I; total synthesis of seco-ent-kauranes such as sculpomeatin N, trichorabdal A, maoecrystal Z, enmein, isodocarpin, sculponin R, londirabdiol, longirabdolactone and effusin; and total synthesis of nor or rearranged-ent-kauranes such as jungermannenones B and C, maoecrystal V, jungermatrobrunin A and kauradienone.
Key words: diterpenoids; ent-kaurane; total synthesis
Wu Li , Junjie Wang , Dawei Ma . The Total Synthesis of ent-Kaurane Diterpenoids[J]. Progress in Chemistry, 2019 , 31(11) : 1460 -1471 . DOI: 10.7536/PC190809
| [1] |
|
| [2] |
(a)
(b)
|
| [3] |
|
| [4] |
|
| [5] |
杜明军(Du M J), 雷晓光(Lei X G) . 有机化学(Youji Huaxue), 2015,35:2447.
|
| [6] |
|
| [7] |
(a)
(b)
(c)
(d)
|
| [8] |
|
| [9] |
(a)
(b)
|
| [10] |
|
| [11] |
(a)
(b)
|
| [12] |
(a)
(b)
(c)
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
(a)
(b)
|
| [17] |
|
| [18] |
(a)
(b)
(c)
(d)
(e)
(f)
(13)(a)
(b)
(c)
(d)
(e)
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
(a)
(b)
(c)
|
| [24] |
|
| [25] |
|
| [26] |
(b)
|
| [27] |
(a)
(b)
(c)
(d)
(e)
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
(a)
(b)
(c)
|
| [34] |
|
/
| 〈 |
|
〉 |