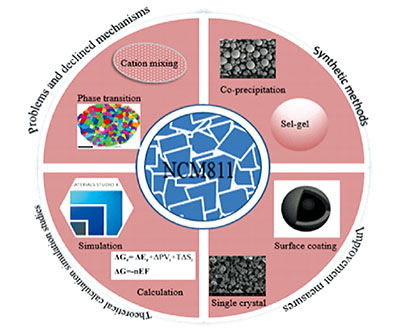
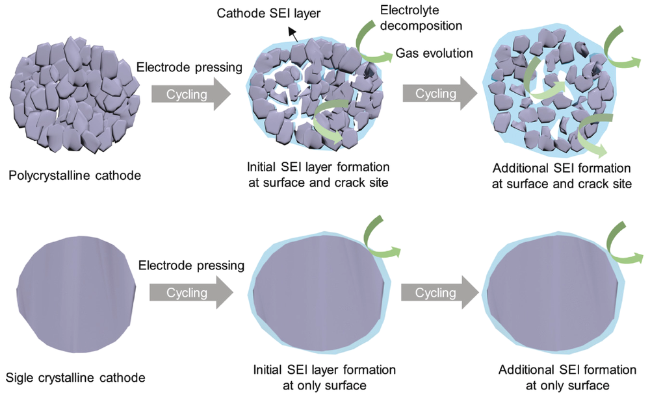
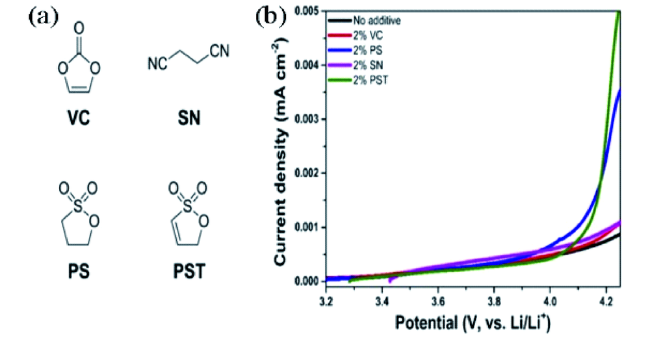
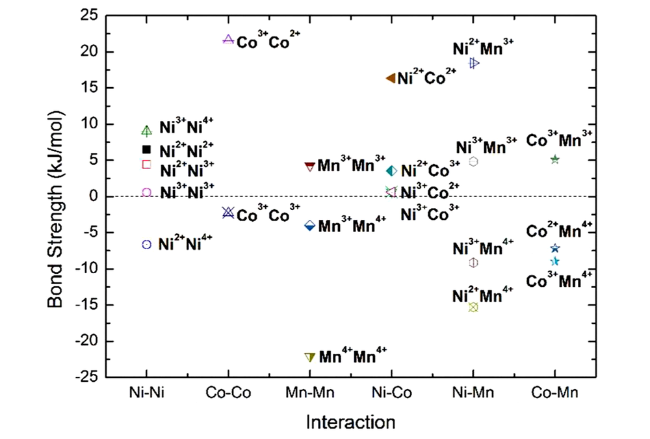
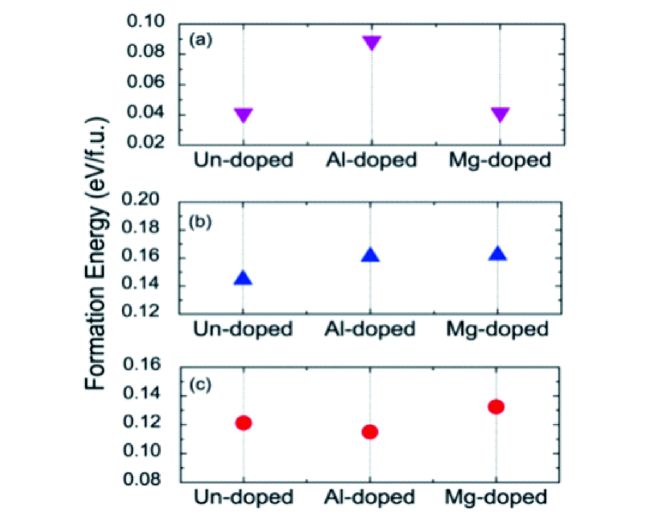
为了发展性能更加优异的NCM811材料,许多材料合成方法被引入至NCM811,如熔盐法、喷雾热解法、溶胶凝胶法和共沉淀法等
[38,39,40,41,42]。使用熔盐法合成三元材料的报道近年来逐渐增多,主要是在过渡金属盐中加入无机盐,无机盐在高温下形成液态熔盐,从而使过渡金属盐在液态熔盐环境下进行烧结成核,形成较为完整的晶粒
[43]。喷雾热解法作为另一种合成三元材料的方法,对其研究报道相对较少,其合成过程主要为在溶剂中将过渡金属盐和锂盐混合均匀,然后通过喷雾方法将溶液喷洒在高温环境下获得较为均一的前驱体,然后经过烧结获得三元材料。Li等
[44]以过渡金属氯化盐为原料通过喷雾干燥法合成了富镍材料氧化物前驱体Ni
0.8Co
0.1Mn
0.1O
1.1,然后将氧化物前驱体与Li
2CO
3进行混合后经过烧结,获得了富镍材料NCM811,该材料表面具有丰富的Ni
3+,电化学结果显示,在1 C下经过100次充放电循环后,放电容量仍高达173 mAh·g
-1,材料表现出优异的电化学性能。喷雾热解法操作较简单,但对合成所需设备要求高,不适合大规模商业生产。溶胶凝胶法合成富镍材料,该方法由于具有原料分散均匀、反应过程容易控制、方便引入掺杂元素等优势而得到广泛研究。Zhang等
[45]通过在前驱体合成过程中加入尿素作为螯合剂,运用溶胶凝胶法合成了阳离子混排程度低、层状结构良好的蚕蛹型球状富镍NCM811材料,该材料在0.1 C下放电容量高达201.2 mAh·g
-1,在5 C高倍率下,放电容量仍达142.9 mAh·g
-1,经过115次充放电循环,材料放电容量为138.2 mAh·g
-1,容量保持率为78.5%,远高于普通方法制备的富镍材料,表现出优异的电化学性能。共沉淀方法在NCM811材料合成中使用较为普遍,该合成方法主要在水溶液中加入过渡金属盐,然后调节pH,使过渡金属共沉淀,形成颗粒分布均一的Ni
0.8Co
0.1Mn
0.1(OH)
2前驱体材料,然后将该材料与LiOH或Li
2CO
3混合经高温烧结得到NCM811材料,此合成方法操作简单,适合大规模生产,且目前商业化生产的NCM523、NCM622和NCA材料均采用共沉淀法生产。Zheng等
[46]以过渡金属氯化盐为原料,以NaOH为沉淀剂,NH
3·H
2O为络合剂,运用共沉淀法合成了NCM811前驱体,然后通过与LiOH混合、高温烧结等处理合成了NCM811材料,该材料在5 C高倍率下仍有超过150 mAh·g
-1的放电比容量,且在2 C下充放电循环100次,其容量保持率高达88.5%,材料表现出优异的循环性能。