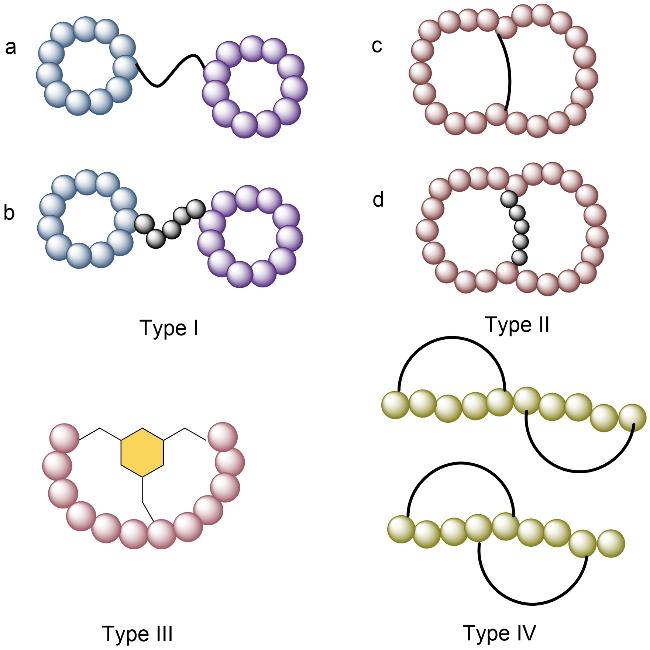
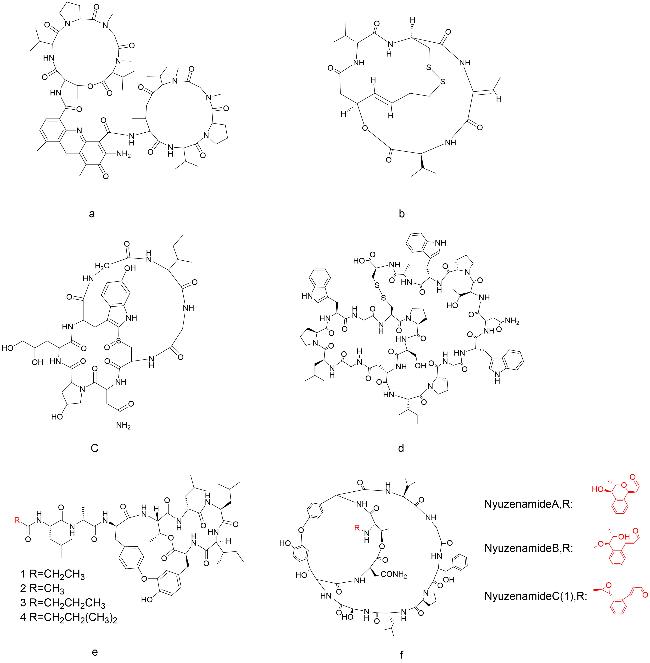
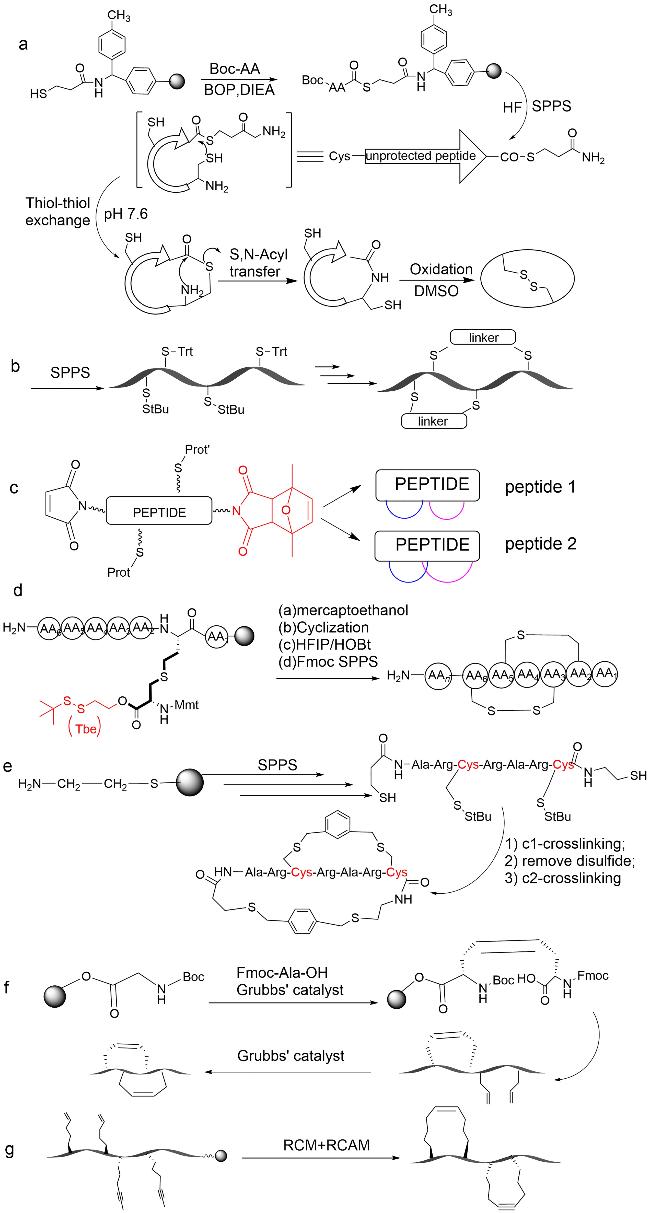
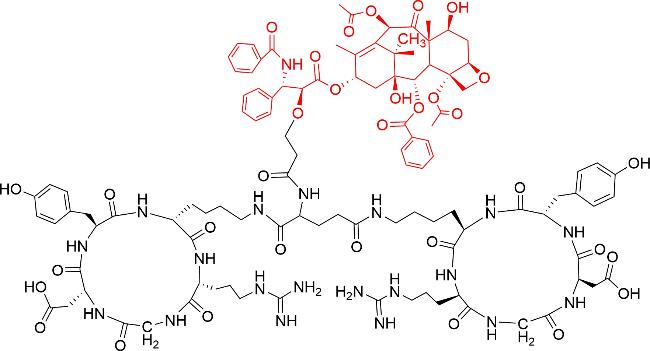
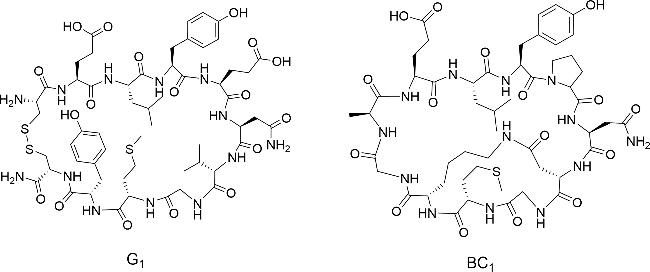
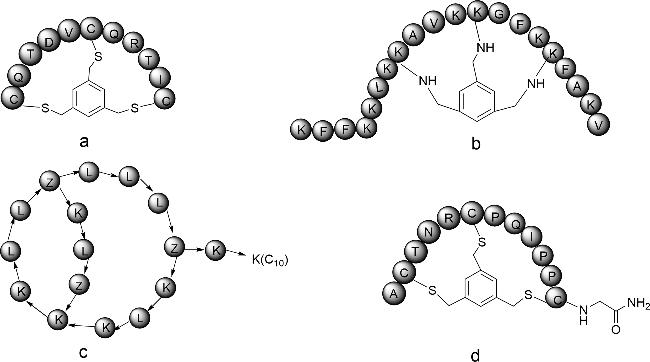
放线菌素D是一种抗肿瘤多肽抗生素(
图式1a),是治疗癌症的老药,于20世纪60年代被批准用于肿瘤治疗
[13]。2016年,Liu等
[14]将放线菌素D与RG1718(靶向间皮素的免疫毒素)联合应用,发现两者产生协同作用,增强了在人体内的抗肿瘤活性。另一个已经上市的天然双环肽是罗米地辛,从日本土壤样品中分离出来的紫色杆菌中获得,是一种组蛋白去乙酰化酶抑制剂,于2009年被批准用于治疗皮肤T细胞淋巴瘤。其结构中含有1种天然氨基酸、3种非天然氨基酸,以及1种非氨基酸构建块(
图式1b)
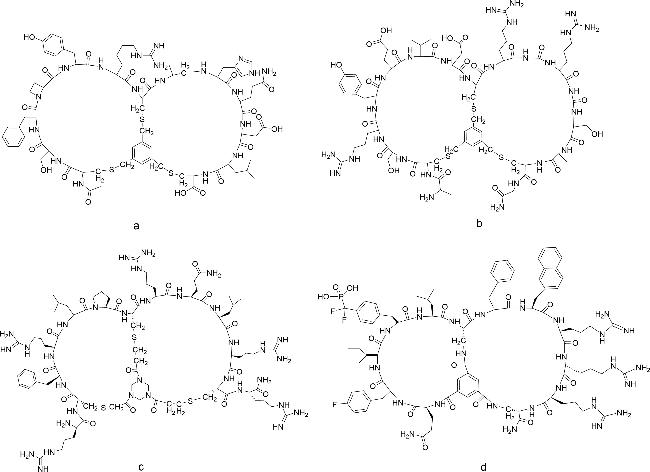
[15]。α-Amanitin是从死帽菌中分离出的剧毒双环八肽(
图式1c),能够高选择性抑制RNA聚合酶II,对真核细胞产生毒性,最终导致细胞凋亡
[16]。2018年,Matinkhoo等
[17]对α-Amanitin完成了全合成,克服了6-羟基-色氨酸亚砜桥,(2
S,3
R,4
R)4,5-二羟基异亮氨酸的对映选择性合成和非对映选择性亚砜化的关键挑战。α-Amanitin现作为抗体-药物偶联物(ADC)在癌症治疗中的研究越来越广泛。例如,将抗EpCAM单抗与α-Amanitin偶联嵌合,得到抗体-药物偶联物chiHEA125-Ama
[18],可有效根除实验性胰腺癌,且具有较低的全身毒性风险,因此可能成为胰腺癌和过表达EpCAM的新型抗癌药物。2004年,Potterat等
[19]从链霉菌培养液中分离到一个新的双环19肽BI-32169(
图式1d),对人胰高血糖素受体具有强抑制活性。Kim等
[20]从萨夫芽孢杆菌KCTC 12796BP培养液中分离得到了6种化合物,其中4种为双环肽(
图式1e),2种为单环肽。化合物的生物活性测试结果表明,只有双环肽具有抗过敏的活性,而单环肽不具有活性,此发现为抗过敏药物的研发提供了一个新的方向。Karim等
[21]从日本海深海悬浮物中分离的链霉菌中发现了2个双环肽,Nyuzenamides A和B(
图式1f Nyuzenamide A、B),2种化合物均存在抗真菌活性和细胞毒性。随后,An等
[22]在相同来源中发现了另一种双环肽——Nyuzenamide C(1)(
图式1f)。通过进一步的生物活性测试,研究人员发现Nyuzenamide C(1)在人脐静脉内皮细胞中显示抗血管生成活性。





05-0649-21_pic.jpg)