1 引言
表1 部分淡水环境中微塑料分布情况Table 1 Distribution of microplastics in several freshwater environments |
| Sampling area | Mean abundance/per m3 | Principal components | Particle size /mm | Shape | Ref |
|---|---|---|---|---|---|
| Yangtze River | 4483 | PE(27%) PP(26%) | 0~0.5 | Fibrous (54.63%) Fragmented (32.43%) | 7 |
| Songhua River | (5.72±4.02)×103 | PE, PET, PS | 0~1 | Fibrous (34.69%) Fragmented (26.29%) | 8 |
| East Lake,Hubei | 3329.19 ± 2059.26 | PE, PP | 0.1~1 | Fibrous (84.0%) Fragmented (12.6%) | 9 |
| Wei River | (3.67~10.7)×103 | PE, PVC, PS | 0~0.5 | Fibrous (50.1%) | 10 |
| Taihu Lake | (7.33±1.70)×103 | PET(53.4%) | 0.1~0.5 | Fibrous (92.9%) | 11 |






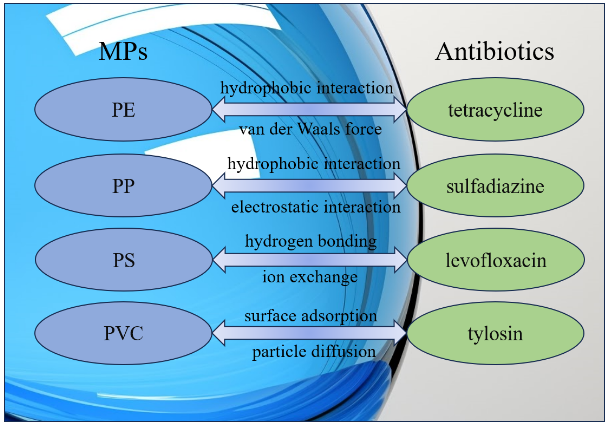
 唑(SMX)3种抗生素及PS微塑料研究微塑料和抗生素污染对贻贝的影响,结果表明相比于单独污染,复合污染对贻贝体现出了协同免疫毒性,并导致了贻贝血细胞活力的下降和免疫相关基因的下调。
唑(SMX)3种抗生素及PS微塑料研究微塑料和抗生素污染对贻贝的影响,结果表明相比于单独污染,复合污染对贻贝体现出了协同免疫毒性,并导致了贻贝血细胞活力的下降和免疫相关基因的下调。 唑、普萘洛尔和舍曲林)的吸附效果。实验中溶液的pH约为6.85,而3种抗生素的pKa分别是1.90、9.42和9.85,因此磺胺甲
唑、普萘洛尔和舍曲林)的吸附效果。实验中溶液的pH约为6.85,而3种抗生素的pKa分别是1.90、9.42和9.85,因此磺胺甲 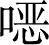 唑带负电,普萘洛尔和舍曲林带正电。而PE的pHPZC为4.3,则PE也带负电。实验结果表明PE的确对两种带正电的抗生素具有更高的吸附量,证明了静电作用对抗生素吸附作用的影响。
唑带负电,普萘洛尔和舍曲林带正电。而PE的pHPZC为4.3,则PE也带负电。实验结果表明PE的确对两种带正电的抗生素具有更高的吸附量,证明了静电作用对抗生素吸附作用的影响。