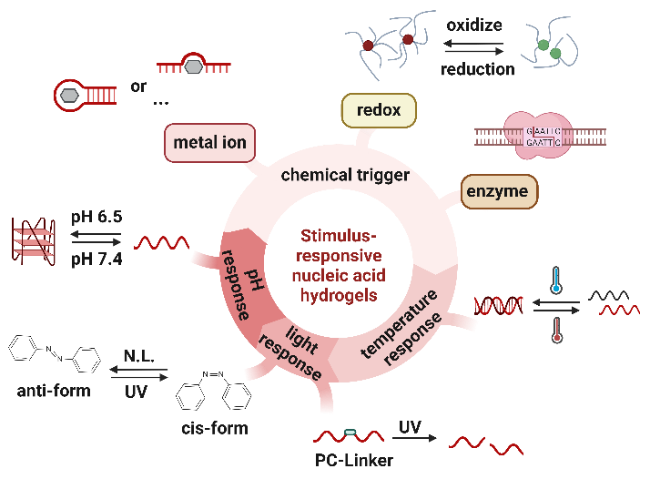
1 引言
2 核酸水凝胶的制备
2.1 纯核酸水凝胶
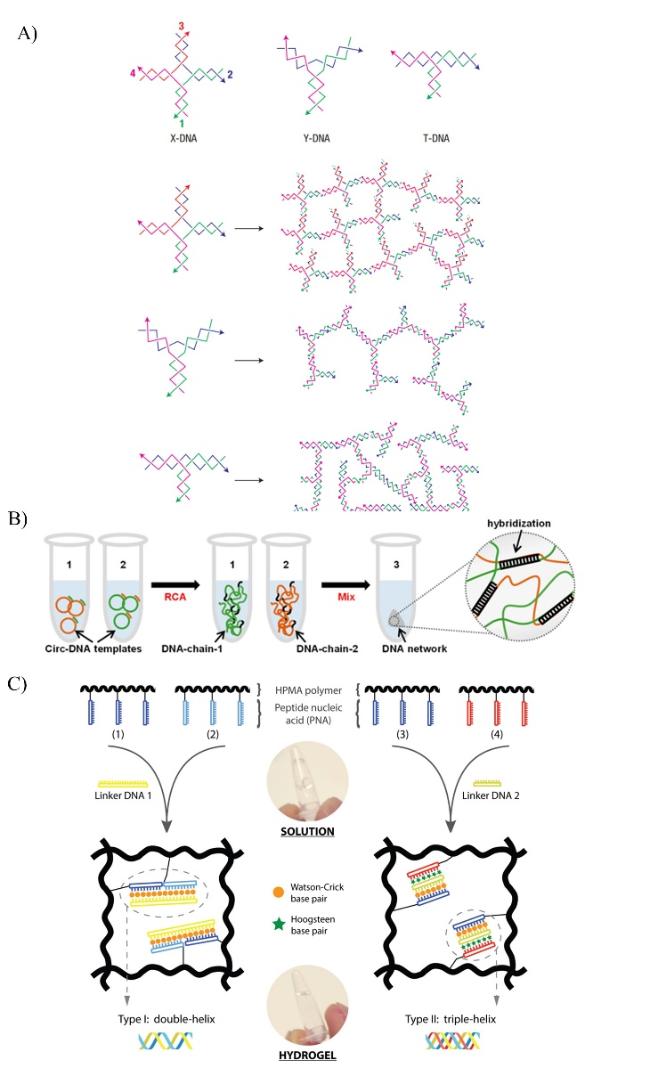
图1 刺激响应型核酸水凝胶的制备。A)X-DNA、Y-DNA和T-DNA构成的核酸水凝胶[7]。 B)通过RCA合成DNA长单链以获得3D DNA网络的过程[11]。C)通过PNA/DNA络合形成的杂化水凝胶[4]。Fig. 1 Preparation of stimulus-responsive nucleic acid hydrogels. A) Nucleic acid hydrogel composed of X-DNA, Y-DNA, and T-DNA[7]. Copyright 2006, Springer Nature B) The process of synthesizing long single strands of DNA by RCA to obtain a 3D DNA network[11]. Copyright 2020, American Chemical Society C) Heterogeneous hydrogels formed by PNA/DNA complexation[4]. Copyright 2015, Elsevier |
2.2 聚合物-核酸杂化水凝胶
3 刺激响应型核酸水凝胶
3.1 pH响应
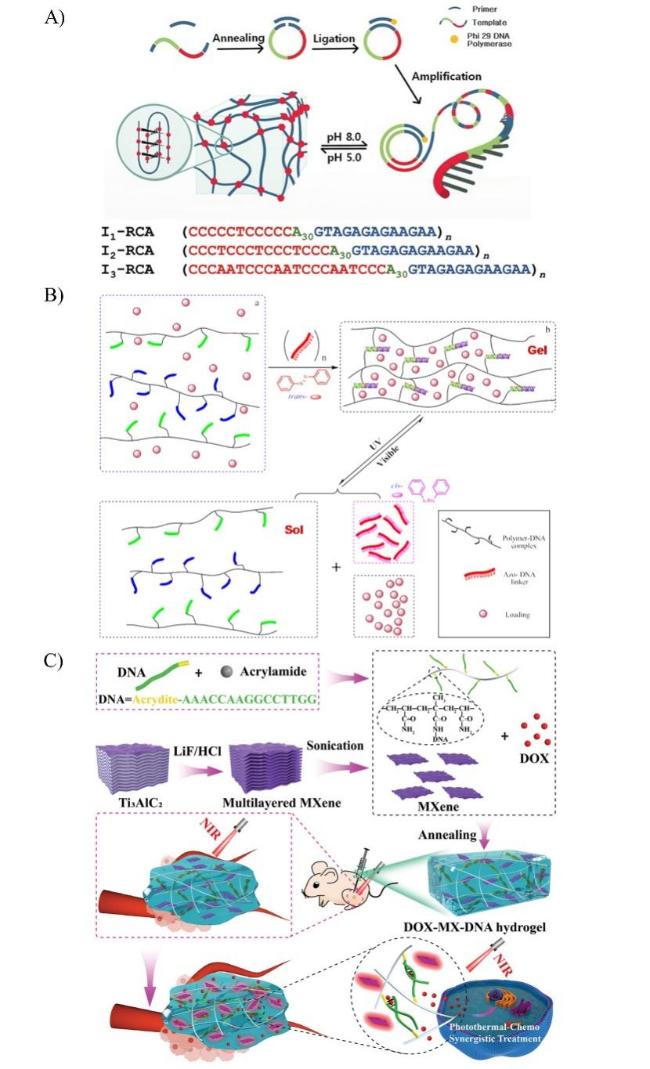
图3 pH、光和温度响应型核酸水凝胶的应用。A)用于制备pH响应型DNA水凝胶的RCA方法的示意图[18]。B)光控DNA交联水凝胶的机理与设计[21]。C)光热响应的MXene-DNA水凝胶的构建示意图及其应用[27]。Fig. 3 Applications of pH, light, and temperature-responsive nucleic acid hydrogels. A) Schematic diagram of the RCA method used to prepare pH-responsive DNA hydrogels[18]. Copyright 2017, John Wiley and Sons B) Mechanism and design of photocontrolled DNA cross-linked hydrogels[21]. Copyright 2011, American Chemical Society C) Schematic diagram of the construction of photothermally responsive MXene-DNA hydrogels and their application[27]. Copyright 2022, John Wiley and Sons |
3.2 光响应
3.3 温度响应
3.4 化学触发
3.4.1 金属离子响应
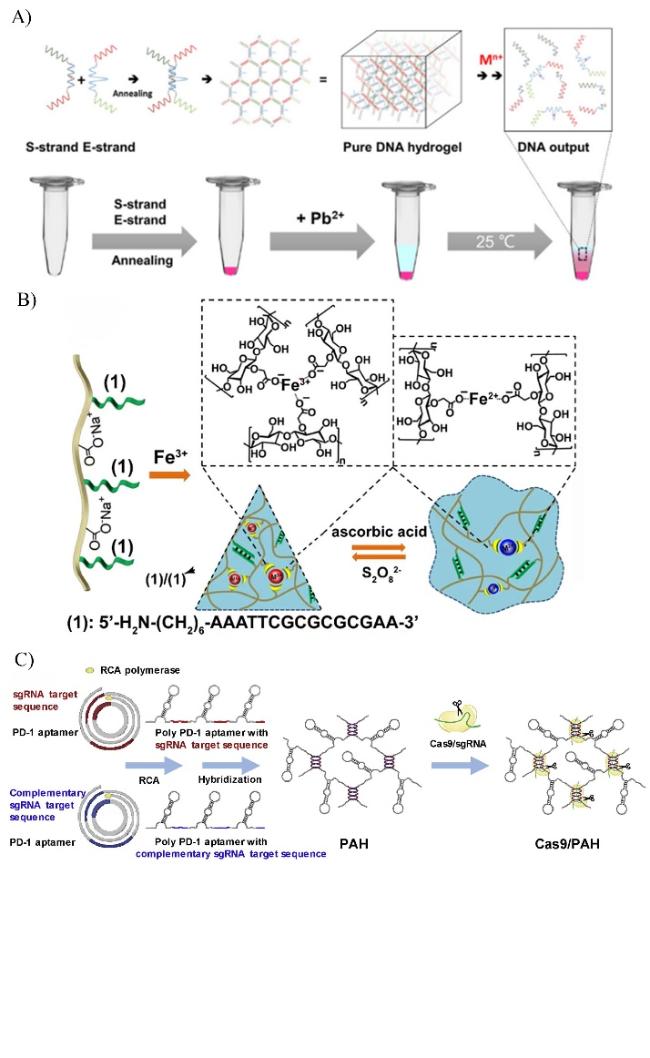
图4 金属离子响应、氧化还原响应和酶响应型核酸水凝胶的应用。A)金属离子响应型纯DNA水凝胶的制备及金属离子检测原理[29]。B)铁3+的组装/铁2+-羧甲基纤维素(CMC)水凝胶和氧化还原触发的水凝胶的受控交联[31]。C)构建Cas9/sgRNA编辑的免疫检查点阻断DNA多核酸适配体水凝胶[35]。Fig. 4 Applications of metal-ion-responsive, redox-responsive, and enzyme-responsive nucleic acid hydrogels. A) Preparation of metal ion-responsive pure DNA hydrogels and the principle of metal ion detection[29]. Copyright 2021, Elsevier B) Assembly of Fe3+/controlled cross-linking of Fe2+-carboxymethylcellulose (CMC) hydrogels and redox-triggered hydrogels[31]. Copyright 2021, Elsevier C) Construction of Cas9/sgRNA-edited immune checkpoint-blocking DNA polynucleic acid aptamer hydrogels[35]. Copyright 2019, Elsevier |
3.4.2 氧化还原响应
3.4.3 酶响应
4 刺激响应型核酸水凝胶用于细胞捕获和释放
4.1 细胞成像
4.2 细胞治疗
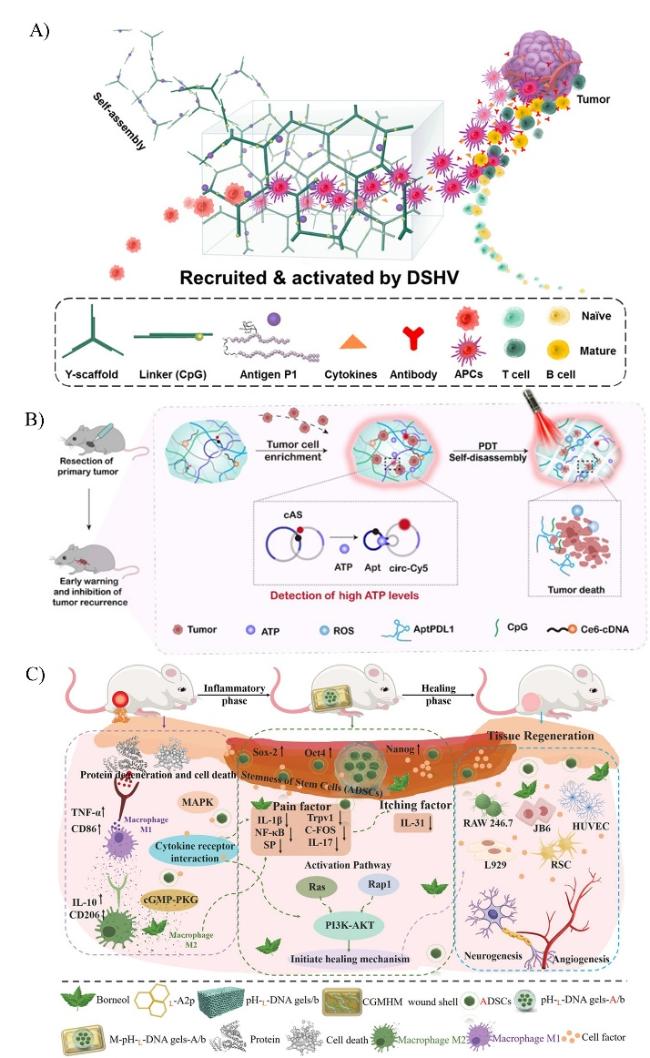
图6 刺激响应核酸水凝胶在细胞治疗方面的应用。A)DSHV 系统诱导的宿主 APC 在体内募集和激活以产生强大的免疫反应和抗肿瘤作用的示意图[41]。B)光反应型核酸水凝胶用于肿瘤治疗的示意图[45]。C)多功能DNA敷料促进烧伤创面愈合的机制[48]。Fig. 6 Application of stimulus-responsive nucleic acid hydrogels in cell therapy. A) Schematic diagram of DSHV system-induced host APCs recruiting and activating in vivo to produce robust immune responses and antitumor effects[41]. Copyright 2018, American Chemical Society B) Schematic diagram of embedded photoreactive nucleic acid hydrogel for tumor treatment[45]. Copyright 2023, Springer Nature C) Mechanism of multifunctional DNA dressings to promote burn wound healing[48]. Copyright 2022, JohnWiley and Sons |
4.3 协同药物递送
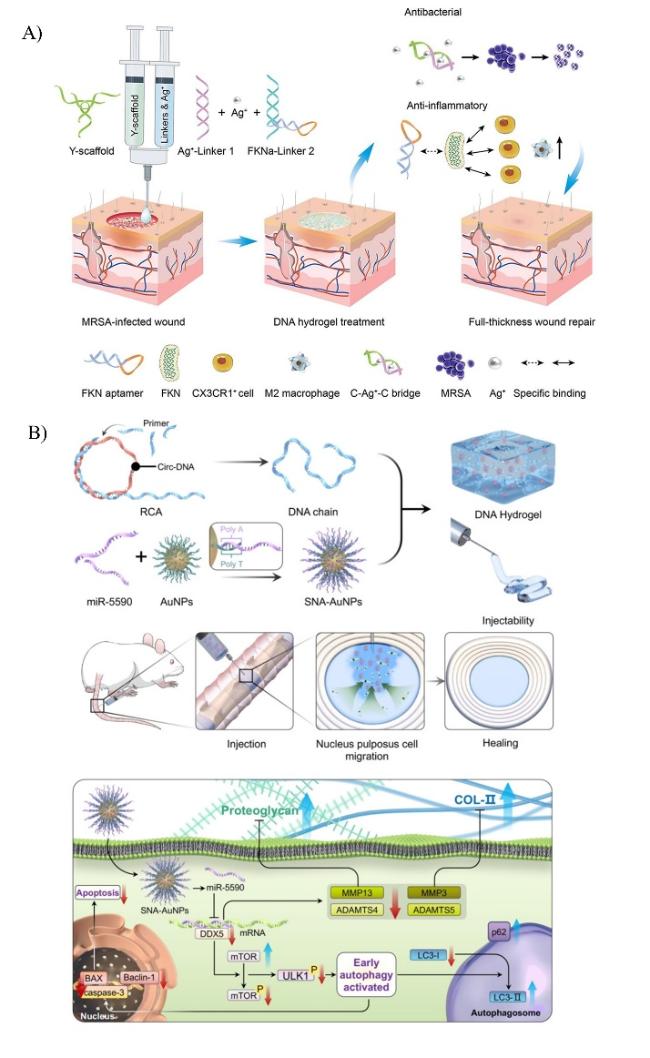
图7 核酸水凝胶在协同药物递送方面的应用。A)DNA-FKNa/Ag水凝胶修复MRSA感染伤口示意图[59]。B)miR-5590-SNA@DNAgel的制备和应用[66]。Fig. 7 Application of nucleic acid hydrogels in synergistic drug delivery. A) Schematic diagram of DNA-FKNa/Ag hydrogel repair of MRSA infected wound[59]. Copyright 2023, Elsevier B) Preparation and application of miR-5590- SNA@DNAgel[66]. Copyright 2023, Springer Nature |
5 结论与展望
表1 刺激响应型核酸水凝胶在生物医学方面的应用Table 1 Application of stimulus responsive nucleic acid hydrogel in biomedicine |
| Areas of application | Type of stimulus | Principle of action | Ref |
|---|---|---|---|
| Cell imaging | Chemical trigger | ATP activates fluorescent signalling | 36 |
| pH response | Fluorescent marker release | 37 | |
| Cell therapy | Chemical trigger | CpG activates APC and the immune response | 40 |
| ATP triggers the breakdown and release of CTCs | 41 | ||
| Increased local ATP concentration and signalling early warning | 44 | ||
| light response | Trigger Cell Photodynamic Therapy | 44 | |
| pH, temperature response | Reacts specifically with the wound wound area | 48 | |
| Drug delivery | light response | Delivery of cell-penetrating anticancer peptide drugs | 54 |
| pH response | Loaded drug reaches the site of acidic pathology | 61 | |
| chemical trigger | Specific sites encoding restriction endonucleases | 62 | |
| Decomposed by biological enzymes in the body to release therapeutic drugs | 64 |