1 引言
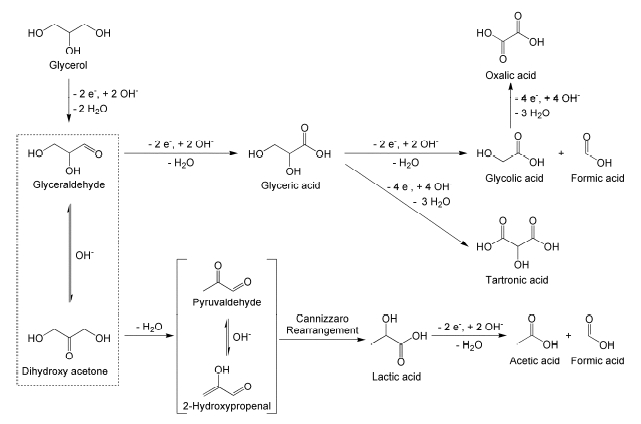
2 甘油转化制乳酸的反应机理
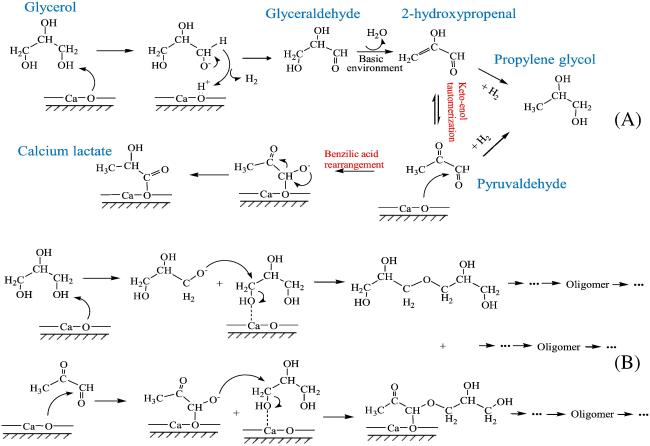
2.1 甘油水热转化制乳酸
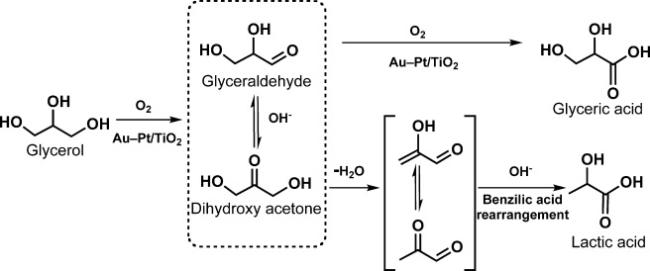
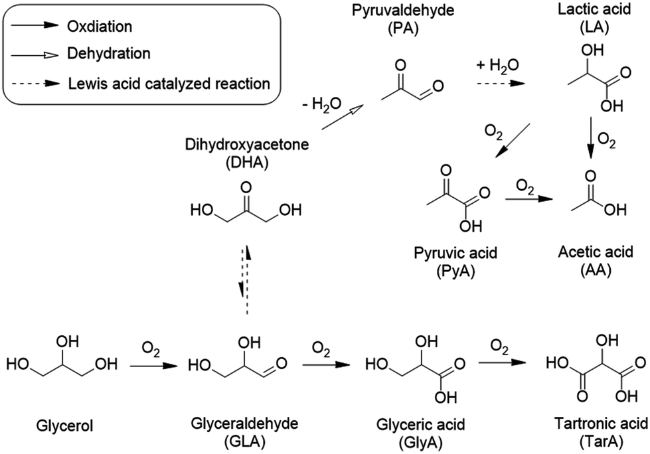
2.2 甘油选择性氧化制乳酸
2.3 甘油电催化氧化制乳酸
3 贵金属催化剂
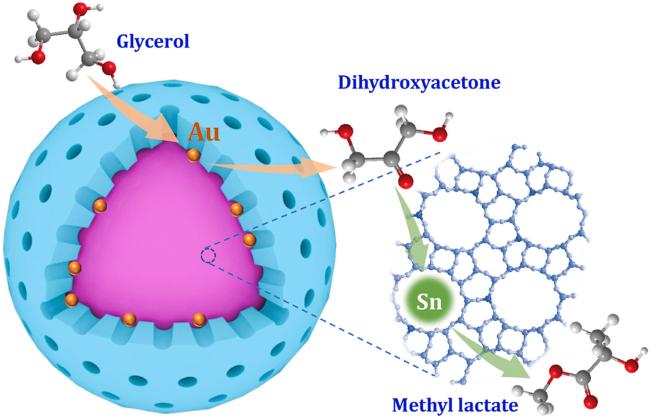
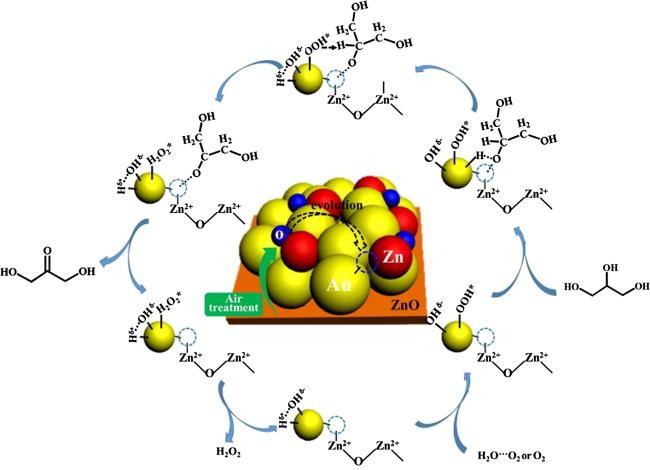
3.1 Au基催化剂
表1 近年来Au基催化剂催化甘油氧化制乳酸的典型报道结果Table 1 Typical results for glycerol to lactic acid over Au-containing catalysts reported in the last years |
| Catalyst | Base a | T / ℃ | PO2 / MPa | Reaction time / h | Conversion / % | Selectivity b / % | Year | Ref |
|---|---|---|---|---|---|---|---|---|
| Au-Pt/TiO2 (1∶1) c | 4∶1 | 90 | 0.1 | - | ≈30.0 | LA 85.6 | 2010 | 15 |
| Au-Pt/TiO2 (3∶1) c | 4∶1 | 90 | 0.1 | - | ≈30.0 | LA 84.3 | ||
| Au-Pt/TiO2 (1∶3) c | 4∶1 | 90 | 0.1 | - | ≈30.0 | LA 85.3 | ||
| 1% Au/CeO2 d | 4∶1 | 90 | 0.1 | - | 99.1 | LA 73.1 | 2013 | 23 |
| 1% Au/CeO2 e | 4∶1 | 90 | 0.1 | - | 98.0 | LA 83.0 | ||
| 3% Au/CeO2 d | 4∶1 | 90 | 0.1 | - | 98.0 | LA 73.5 | ||
| 3% Au/CeO2 e | 4∶1 | 90 | 0.1 | - | 98.0 | LA 79.7 | ||
| 5% Au/CeO2 d | 4∶1 | 90 | 0.1 | - | 98.0 | LA 72.2 | ||
| 5% Au/CeO2 e | 4∶1 | 90 | 0.1 | - | 98.0 | LA 79.0 | ||
| Au/TiO2 | base free | 160 | 1 | 2 | 1.2 | - | 2013 | 24 |
| Pd/TiO2 | base free | 160 | 1 | 2 | 46.2 | LA 47.7 | ||
| AuPd/TiO2 | base free | 160 | 1 | 2 | 29.7 | LA 58.5 | ||
| 0.5Au/Sn-MCM-41-XS DP | base free | 140 | 3 | 4.5 | 76.0 | MLA 46.0 | 2018 | 51 |
| 0.5Au/Sn-MCM-41-XS CI | base free | 140 | 3 | 4.5 | 20.0 | MLA 82.0 | ||
| 0.5Au/CuO+Sn-MCM-41-XS | base free | 140 | 3 | 4.5 | 79.0 | MLA 64.0 | ||
| AuPd/CNTs | base free | 140 | 3 | 4.5 | 6.8 | MLA 5.7 | 2019 | 52 |
| AuPd/CNTs-NS+Sn-MCM-41-XS | base free | 140 | 3 | 4.5 | 81.0 | MLA 87.0 | ||
| AuPd/CNTs-NS+Sn-MCM-41-XS | base free | 140 | 3 | 9 | 96.0 | MLA 88.0 |
a NaOH to glycerol mole ratio if not otherwise denoted; b LA: lactic acid, MLA: methyl lactate; c Au to Pt mole ratio; d H2 reduced samples; e Glycerol reduced samples. |
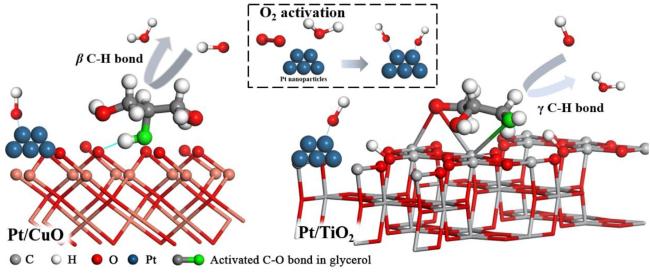
3.2 Pt基催化剂
表2 近年来Pt基催化剂催化甘油氧化制乳酸的典型报道结果Table 2 Typical results for glycerol to lactic acid over Pt-containing catalysts reported in the last years |
| Catalyst | Base a | T / ℃ | PO2 / MPa | Reaction time / h | Conversion / % | Selectivity b / % | Year | Ref |
|---|---|---|---|---|---|---|---|---|
| Pt/Al2O3 | 0.75∶1 | 240 | 3.5 | 22~30 | 95.4 | LA 29.8 | 2018 | 54 |
| Pt/ZnO | 0.75∶1 | 240 | 3.5 | 22~30 | 97.0 | LA 25.5 | ||
| Pt/MgO | 0.75∶1 | 240 | 3.5 | 22~30 | 93.6 | LA 30.8 | ||
| Au/nCeO2 | 4∶1 | 100 | 0.5 | 0.5 | 82.0 | LA 68.0 | 2014 | 31 |
| Pt/nCeO2 | 4∶1 | 100 | 0.5 | 0.5 | 60.0 | LA 52.0 | ||
| Au-Pt/nCeO2 | 4∶1 | 100 | 0.5 | 0.5 | 99.0 | LA 80.0 | ||
| 0.1%Cu-1.0%Pt/AC | 1.5∶1 | 90 | 0.1 | 4 | 43.7 | LA 66.9 | 2017 | 58 |
| 0.2%Cu-1.0%Pt/AC | 1.5∶1 | 90 | 0.1 | 4 | 52.7 | LA 65.7 | ||
| 0.35%Cu-1.0%Pt/AC | 1.5∶1 | 90 | 0.1 | 4 | 68.2 | LA 72.9 | ||
| 0.5%Cu-1.0%Pt/AC | 1.5∶1 | 90 | 0.1 | 4 | 80.0 | LA 69.3 | ||
| 0.75%Cu-1.0%Pt/AC | 1.5∶1 | 90 | 0.1 | 4 | 62.7 | LA 67.5 | ||
| 1.0%Cu-1.0%Pt/AC | 1.5∶1 | 90 | 0.1 | 4 | 60.9 | LA 64.4 | ||
| 2.0%Cu-1.0%Pt/AC | 1.5∶1 | 90 | 0.1 | 4 | 42.8 | LA 49.0 | ||
| Pt-Co/CeOx | 1.0∶1 | 200 | 1(N2) | 4 | 85.0 | LA 88.0 | 2019 | 65 |
| Pt/TiO2 | 4∶1 | 90 | 0.1 | 2 | 33.9 | LA 51.5 | 2014 | 66 |
| Pd/TiO2 | 4∶1 | 90 | 0.1 | 2 | 26.3 | LA 51.7 | ||
| Pd1Ni1Ox/TiO2 | 4∶1 | 90 | 0.1 | 2 | 44.0 | LA 51.6 | ||
| Pt1Ni1Ox/TiO2 | 4∶1 | 90 | 0.1 | 2 | 58.0 | LA 73.7 | ||
| Pt1Ni1Ox/TiO2 | 4∶1 | 90 | 0.1 | 4 | 99.1 | LA 62.6 | ||
| Pt/Sn-MFI | base-free | 100 | 0.62 | 24 | 89.8 | LA 80.5 | 2014 | 25 |
| Pt/Sn-BEA | base-free | 100 | 0.62 | 24 | 93.4 | LA 28.1 | ||
| Pt/silicalite-1 | base-free | 100 | 0.62 | 24 | 83.8 | LA 0.0 | ||
| Pt/AC + Sn-MFI | base-free | 100 | 0.62 | 24 | 53.6 | LA 80.8 | ||
| Pt/TiO2 | base-free | 100 | 0.62 | 24 | 92.3 | LA 0.0 | ||
| 0.1Pt/L-Nb2O5 | base-free | 140 | 0.5 | 3 | 9.0 | LA 92.0 | 2020 | 27 |
| 0.5Pt/L-Nb2O5 | base-free | 140 | 0.5 | 3 | 53.0 | LA 79.0 | ||
| 1Pt/L-Nb2O5 | base-free | 140 | 0.5 | 3 | 69.0 | LA 61.0 | ||
| 2Pt/L-Nb2O5 | base-free | 140 | 0.5 | 3 | 84.0 | LA 28.0 |
a NaOH to glycerol ratio if not otherwise denoted; b LA: lactic acid. |