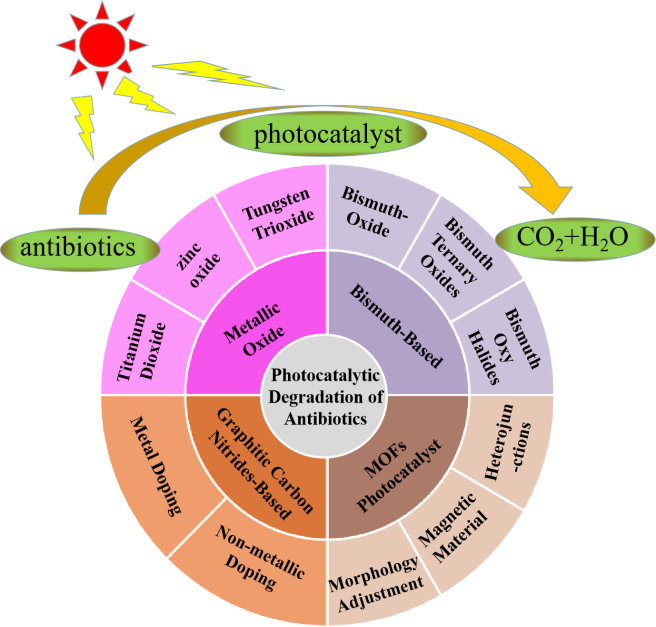
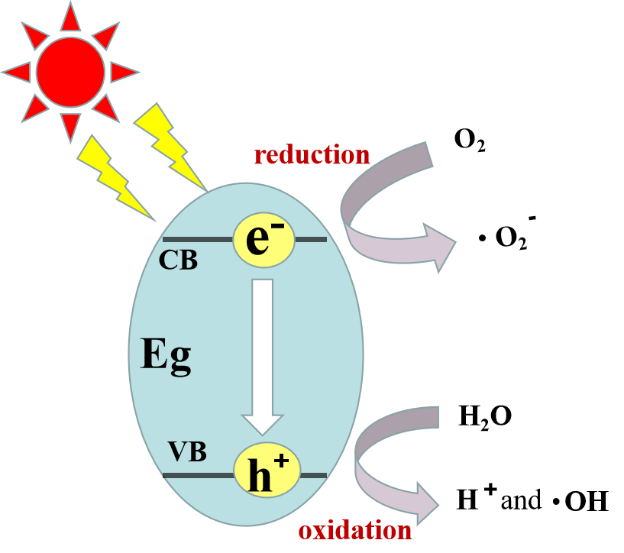
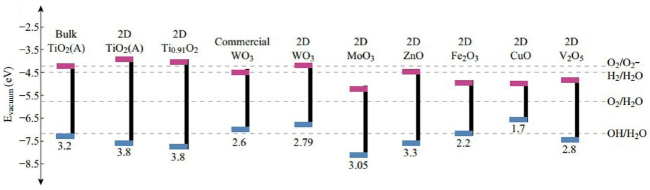
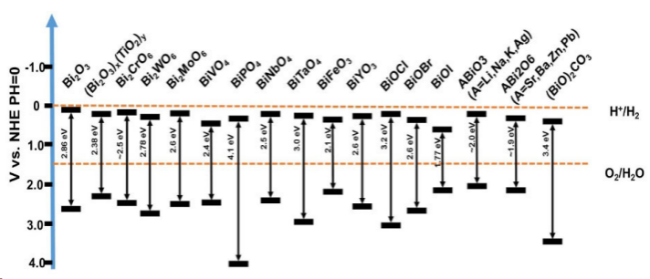
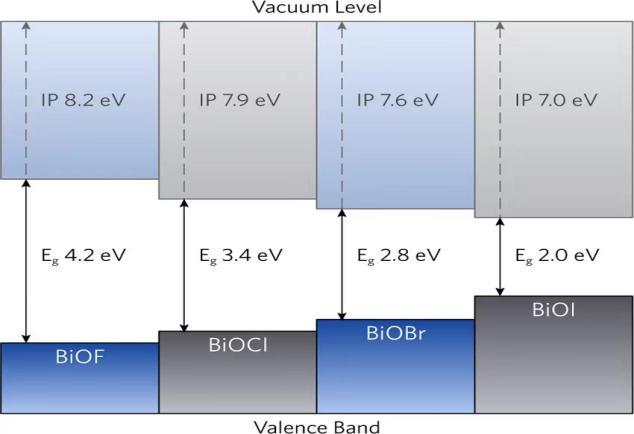
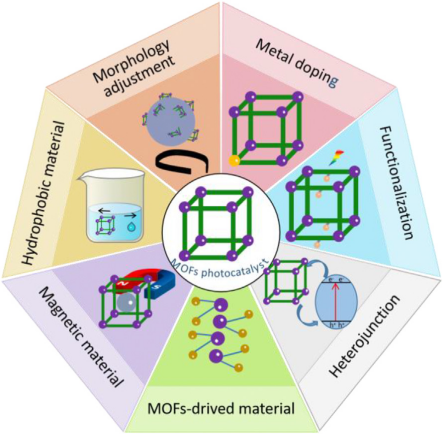
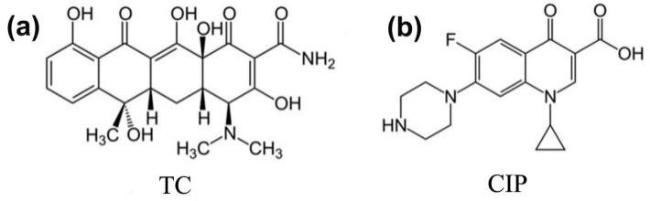
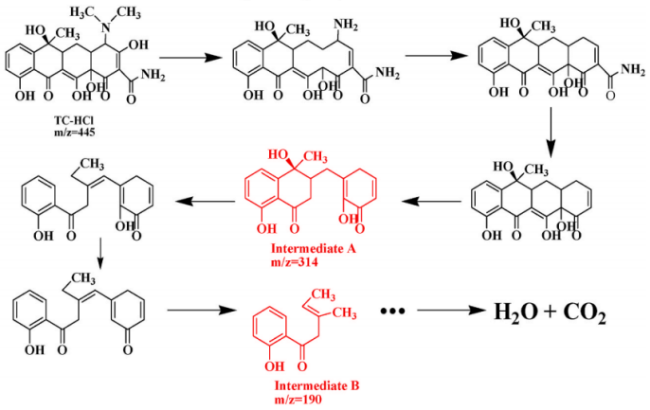
在过去的几年中,已经报道了许多通过使用不同的光催化材料来去除或降解TC的研究
[69]。例如,Chen等
[70]通过原位沉淀法合成了一种新型的异质结构光催化剂AgI/BiVO
4,在可见光照射下对TC的分解表现出优异的光活性,TC分子在60 min内被明显消除(94.91%),在相同的实验条件下,降解效率显著优于单独的BiVO
4(62.68%)和AgI(75.43%)。Wang等
[71]提出了一种新型的TiO
2/g-C
3N
4核壳量子异质结的制备方法,该方法采用了在锐钛矿型二氧化钛纳米片表面聚合量子诱变石墨氮化碳(g-C
3N
4)的可行策略。将其用作TC降解光催化剂,该催化剂表现出的最高TC降解速率为2.2 mg/min,其比TiO
2/g-C
3N
4混合物高36%,比TiO
2高2倍,比本体g-C
3N
4高2.3倍。Wang等
[5]利用氯化铵在热缩合过程中分解的气泡模板效应,成功制备了具有大表面积和介孔结构的3D聚合氮化碳泡沫(CNF)。其对TC-HCl的降解在天然海水中的去除率最高,为78.9%,其次是水库水(75.0%)、自来水(62.3%)、去离子水(49.8%)、反渗透浓缩液(32.7%),然后是制药废水(18.9%)。Chen等
[7]通过尿素和喹唑啉-2,4二胺(DQ)的共聚反应成功合成了芳环封端的g-C
3N
4纳米片。ARCNS-3可显著提高可见光驱动的光催化析氢能力,同时净化废水(1021 μmol·h
−1·g
−1,TC降解率为100%),远高于CNS(325 μmol·h
−1·g
−1,TC降解率为48%)。此外,四环素对ARCNS-3的矿化率达到92.1%,远优于CNS(18%)。Jiang等
[72]设计合成了一种先进而稳定的可见光驱动(Bi)BiOBr/rGO光催化剂用于降解TC,在20 min内达到>98%的去除率。通过50 h的连续光催化操作证实了光催化剂的稳定性。在连续流动配置中,几乎100%的TC去除率可以保持约10 h(
图8)。Liu等
[56]通过在g-C
3N
4的结构中同步引入硫和硒原子,成功地合成了硫和硒共掺杂的石墨氮化碳(SSCN)。由于引入硫和硒,SSCN的不对称结构不仅保持了π-π*电子跃迁,而且也引发了g-C
3N
4中的n-π*电子跃迁。SSCN-50表现出最佳的光催化性能,对抗生素(TC)和有机染料(RhB)的降解率分别为78.0%和99.4%,分别是g-C
3N
4的2.5倍和16.8倍。Li等
[12]成功制备了具有独特纳米异质结构、能带结构和化学键界面的中空花状微球结构S型异质结In
2Se
3/Ag
3PO
4,它降解TC的光催化活性显著提高并可同时产生氢气,这种性能的提高主要归功于中空结构和S型异质结。