Contents
1 引言
2 锂离子电池及其安全问题概述
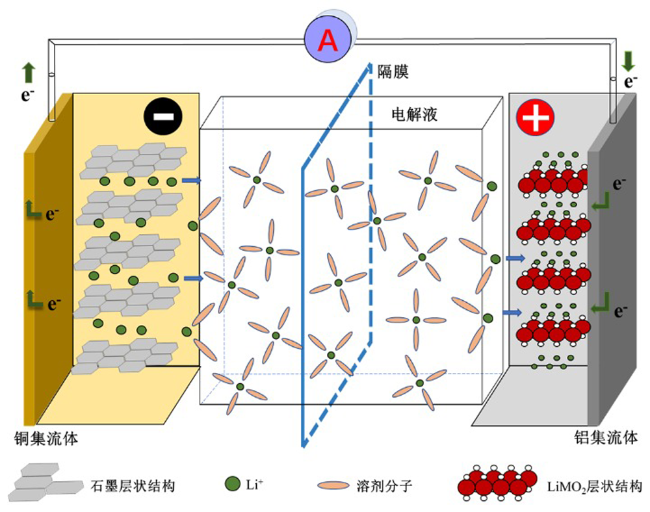
2.1 工作原理
2.2 电池安全事故
表1 近年来的电池安全事故Table 1 Battery safety accidents in recent years |
| 时间 | 事故回放 | 事故原因 |
|---|---|---|
| 2020.04 | 深圳一家充电站内电动汽车起火,多辆电动汽车烧毁 | 过充导致热量积累,触发热失控链式反应 |
| 2020.10.27 | 一辆威马 EX5 在北京市中国科学研究院力学研究所内发生起火事故,后发生剧烈爆燃 | 电芯供应商在生产过程中混入了杂质,导致动力电池产生异常析锂,极端情况下可能导致电芯短路,引发动力电池热失控 |
| 2021.04.06 | 韩国忠清南道洪城光伏+储能系统起火爆炸,爆炸摧毁 0.5 MW储能电池 | 电池过流过压保护不足、运行环境及安装工艺有待改进,智能储能系统 ESS 经验不足 |
| 2021.04.16 | 北京市丰台区福威斯油气技术有限公司光储充一体化项目发生火灾爆炸事故,造成 1 人遇难,两名消防员牺牲。 | 磷酸铁锂电池单体发生内短路故障,引发电池模组热失控扩散起火 |
| 2021.07.18 | 浙江省杭州市父女骑电动车在玉皇山路行驶的过程中,电动车突然起火爆燃,车上父女被严重烧伤 | 初步判断“7·18”电动车起火原因与其锂电池故障有关 |
| 2021.07.30 | 位于澳大利亚维多利亚州的“维多利亚大电池”(VBB)项目所装载的特斯拉 Megapack 储能系统在施工建设期间发生起火事故 | 冷却液泄露导致锂电池热管理失控,在风力作用下引发相邻的另外一个储能系统燃烧 |
| 2021.09.04 | 加利福尼亚州 Vistra Energy 旗下莫斯兰丁锂离子储能站一期项目,7000 个电池组融化,占全部的 7% | 热管理系统在极低的烟雾水平下错误启动,系统中部分柔性软管和管道上的少数接头发生故障引发系统喷水降温,造成电池损坏出现过热现象 |
| 2022.02.08 | 上海普陀区宜川四村住宅发生一起火灾造成 3 人死亡 | 住户将电动自行车锂离子蓄电池放在卧室内,电池故障引发火灾,引发火灾的锂电池输出电压超过 60 伏,属于典型的超标电池 |
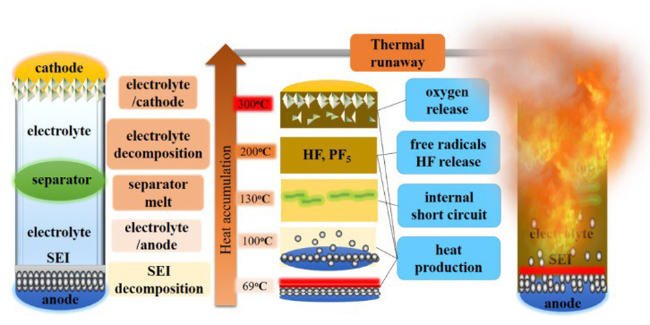
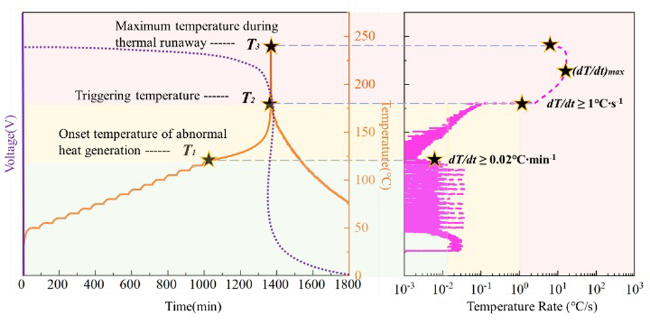
2.3 热失控触发因素
3 单体电池释热机理
3.1 正常工况下电池的产热
3.2 热滥用下电池的失效机理
3.2.1 电池材料的热稳定性研究
3.2.2 电池单体的安全性研究
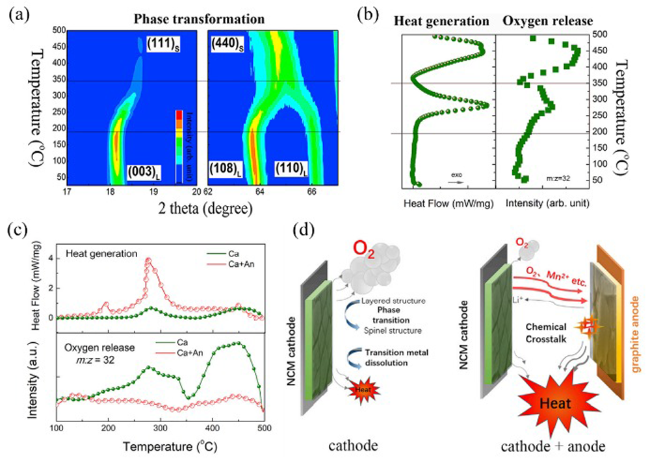
图7 正负极交叉化学反应触发热失控[46]。(a) 带电正极材料的时间分辨 XRD 谱图;(b) 带电正极材料在不同温度下的原位产热和释氧;(c) 在 100~500℃ 内,正负极的混合物几乎不释放氧气,但有明显的产热增强;(d) 正负极交叉化学反应过程Fig.7 Thermal runaway triggered by chemical crosstalk between the cathode and anode[47]: (a) time-resolved XRD patterns of charged cathode material; (b) in situ heat generation and oxygen release at different temperatures of charged cathode materials; (c) at 100~500℃, the mixture of cathode and anode releases virtually no oxygen but has sharp heat generation enhancement; (d) cathode and anode cross chemical reaction process |
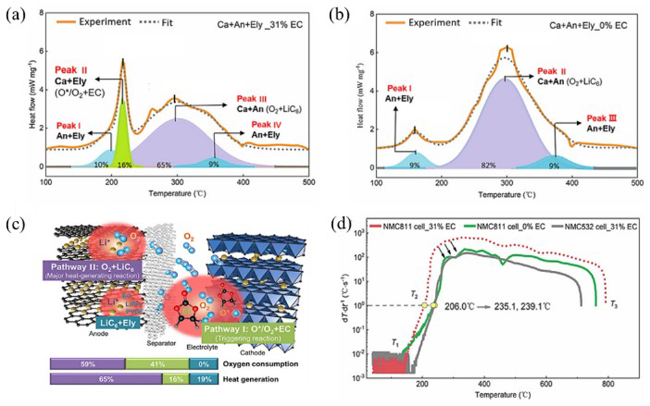
图8 两种内源性氧途径参与热失控强放热反应[49]。(a) 样品 Ca+An+Ely_31%EC 的 DSC 曲线分峰拟合;(b) 样品 Ca+An+Ely_0%EC 的 DSC 曲线分峰拟合;(c) 正极释氧的机理和途径;(d) 无 EC 电解液的 NMC811/Gr 电池(0%EC)与对照组(31%EC)的热失控温升速率比较Fig.8 Two endogenous pathways of oxygen involved in thermal runaway strong exothermic reactions[50]: (a) peak fitting of DSC curve of Ca+An+Ely_31%EC sample; (b) peak fitting of DSC curve of Ca+An+Ely_0%EC sample; (c) mechanism and pathway of oxygen release from cathode; (d) thermal runaway temperature rise rate of NMC811/Gr battery with EC-free-electrolyte (0%EC) compared with the control set (31%EC) |
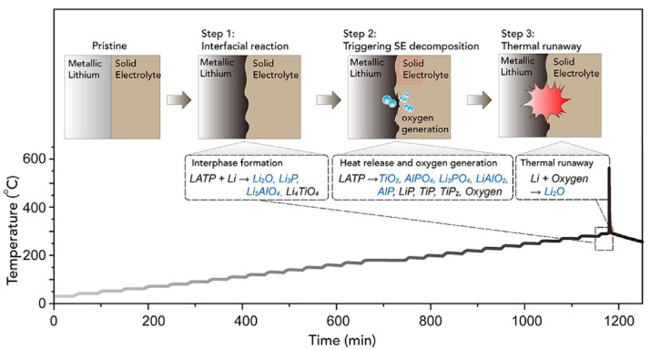
图9 LiH诱导的负极侧放热反应以及H2向正极侧迁移触发热失控[56]。(a) 100%SOC 负极/电解液混合体系的 ARC 实验及产气组成;(b) 双盐电解液及LiH/双盐电解液在 N2 气氛下的DSC曲线;(c) 满电态 NCM523/Gr 电池热失控路径图 Fig.9 Thermal runaway is triggered by LiH-induced exothermic reaction at anode side and H2 migration to cathode side[57]. (a) ARC temperature rise curve and gas generation composition of 100%SOC anode/electrolyte; (b) DSC curves of dual electrolyte and LiH/dual electrolyte under N2 atmosphere; (c) thermal runaway route map for fully charged NCM523/Gr battery |
3.3 机械滥用下电池的失效机理
3.4 电滥用下电池的失效机理
4 单体电池释热模型
4.1 电化学-热耦合模型
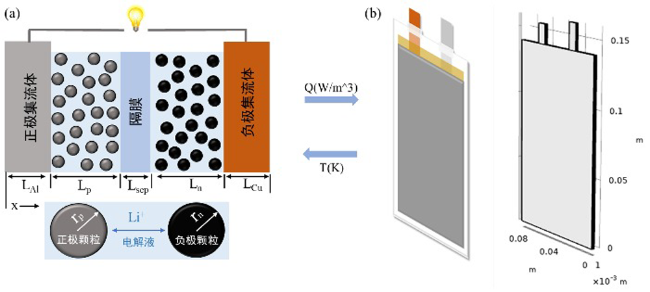
4.1.1 P2D(pseudo-two-dimensions)模型
4.1.2 热模型
4.1.3 耦合机制
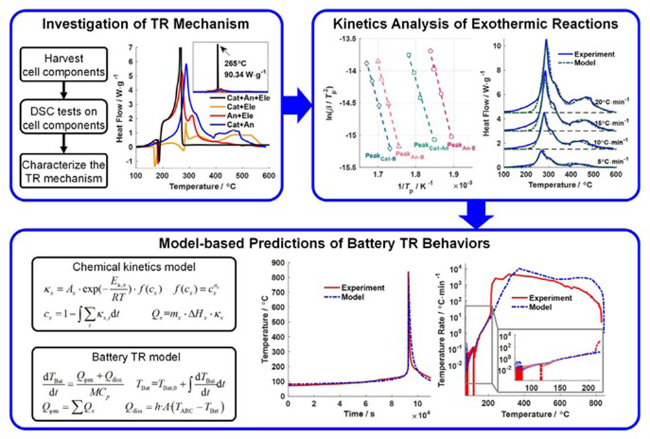
4.2 热失控机理模型
5 安全改性技术
5.1 改进正极材料
5.2 改进负极材料
5.3 改进隔膜
5.4 改进电解液
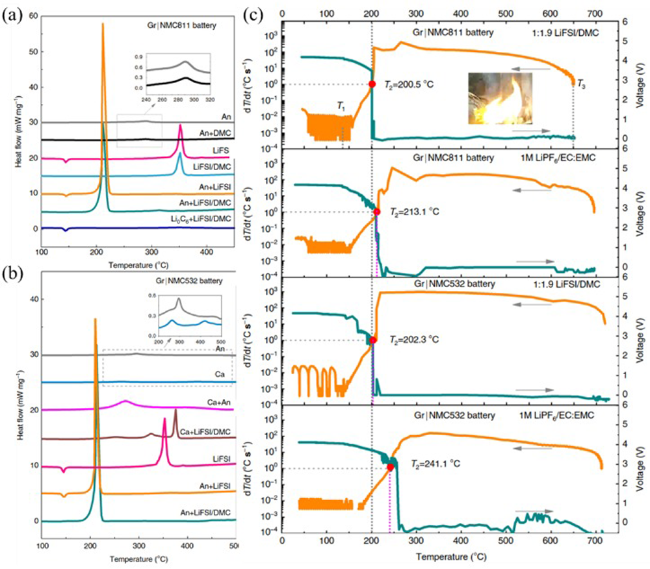
图14 (a) 采用高浓电解液 LiFSI/DMC 的 NCM811/Gr 电池组分组合的 DSC 曲线;(b) 采用高浓电解液 LiFSI/DMC 的 NCM523/Gr 电池组分组合的 DSC 曲线;(c) 高浓电解液LiFSI/DMC 与 1 M LiPF6/EC:EMC 电解液对 NCM/Gr 电池热失控特性的比较[134]Fig.14 (a) DSC curves of components and their mixtures of NCM811/Gr battery using concentrated LiFSI/DMC electrolyte; (b) DSC curves of components and their mixtures of NCM523/Gr battery using concentrated LiFSI/DMC electrolyte; (c) comparison of thermal runaway features of NCM/Gr batteries with concentrated LiFSI/DMC and conventional 1 M LiPF6/EC:EMC electrolyte[136] |