

Challenges in Chemical Synthesis of Glycans and the Possible Problems Relevant to Condensed Matter Chemistry
Received date: 2022-02-24
Revised date: 2022-03-25
Online published: 2022-06-20
Supported by
the National Natural Science Foundation of China(22177125)
Science and Technology Commission of Shanghai Municipality(22ZR1475600)
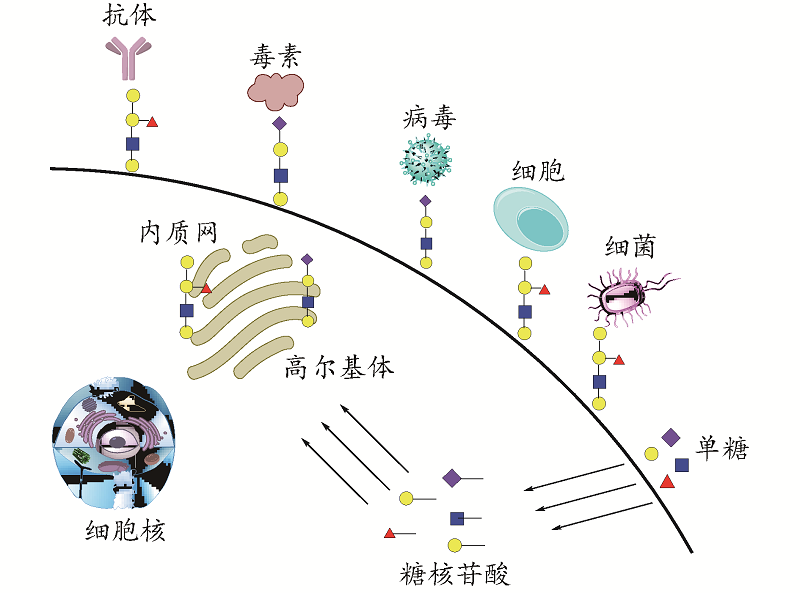
Glycans are the most abundant organic polymers in nature, and vital biomaterials for structural support and energy storage in living organisms. Meanwhile, glycans play an important role in cell recognition, differentiation, development, carcinogenesis and immunity. Compared with nucleic acid and protein, the specific role of glycans in many biological processes is still unknown, which is related to the difficulty of accessing well-defined glycans and the lack of precise tools for manipulating glycans in vivo. Synthetic methods in carbohydrate chemistry have been developed rapidly in recent decades, providing a powerful weapon for the study of synthetic glycans, especially oligosaccharides. Nevertheless, compared with the synthesis of nucleic acids and proteins, the synthesis of structurally well-defined glycans remains an unsolved chemical challenge with many unexpected problems. There are various factors that may affect the efficiency and stereoselectivity of glycosylation profile. Furthermore, glycans could be assembled into ordered aggregates through intermolecular non-covalent forces, then affecting the synthesis. For instance, in the process of removal protecting groups, the great change of solubility of glycan has a decisive effect on the reaction. The effect of aggregation formation on reactivity has not been thoroughly studied. Therefore, it is still necessary to complete the synthesis of well-defined glycan through trial-and-error experiments. In addition, glycans and glycoconjugates play an important role in living organisms by forming supramolecular structures. In conclusion, it is of great significance to study the condensed matter chemistry in glycans and their synthesis.
1 Structure, function and synthesis of glycans in living systems
2 Challenges and advances in the chemical synthesis of glycans
3 Some uncertainties in the chemical synthesis of glycans
3.1 The solvent effect
3.2 The concentration effect
3.3 The temperature effect
3.4 Problems in heterogeneous reactions
3.5 Solubility problem
4 Possible condensed matter chemistry problems
5 Prospect
Key words: glycans; chemical synthesis; aggregation; solubility; condensed matter chemistry
Peng Xu , Biao Yu . Challenges in Chemical Synthesis of Glycans and the Possible Problems Relevant to Condensed Matter Chemistry[J]. Progress in Chemistry, 2022 , 34(7) : 1548 -1553 . DOI: 10.7536/PC220231
| [1] |
(a) Bertozzi C R, Kiessling L L. Science, 2001, 291: 2357.
(b) Introdution to Glycobiology.3rd ed. Taylor M E, Drickamer K. Oxford, 2011.
|
| [2] |
(a) Dwek R A. Chem. Rev., 1996, 96: 683.
(b) Bashkin J K. Chem. Rev., 2000, 100: 4265.
|
| [3] |
Barsanti L, Passarelli V, Evangelista V, Frassanito A M, Gualtieri P. Nat. Prod. Rep., 2011, 28: 457.
|
| [4] |
Byun S, Lee C G, Kang H J, Kim G C, Jun C D, Jan G, Suh C H, Jung J Y, Sprent J, Rudra D, De Castro C, Molinaro A, Surh C D, Im S H. Sci. Immunol., 2018, 3: eaat6975.
|
| [5] |
Biörklund M, van Rees A, Mensink R P, Önning G. Eur. J. Clin. Nutr., 2005, 59: 1272.
|
| [6] |
Guberman M, Seeberger P H. J. Am. Chem. Soc., 2019, 141: 5581.
|
| [7] |
Xiao R, Grinstaff M W. Prog. Polym. Sci., 2017, 74: 78.
|
| [8] |
(a) Mydock L L, Demchenko A V. Org. Biomol. Chem., 2010, 8: 497.
(b) Crich D. Acc. Chem. Res., 2010, 43: 1144.
(c) Frihed T G, Bols M, Pedersen C M. Chem. Rev., 2015, 115: 4963
(d) Yu B. Acc. Chem. Res., 2018, 51: 507.
|
| [9] |
Krasnova L, Wong C-H. J. Am. Chem. Soc., 2019, 141: 3735.
|
| [10] |
Panza M, Pistorio S G, Stine K J, Demchenko A V. Chem. Rev., 2018, 118: 8105.
|
| [11] |
Zhu X, Schmidt R R. Angew. Chem. Int. Ed., 2009, 48: 1900.
|
| [12] |
Ratcliffe A J, Fraser-Reid B. J. Chem. Soc., 1990, 747.
|
| [13] |
Voit B. Angew. Chem. Int. Ed., 2000, 37: 3407.
|
| [14] |
Li L, Xu Y, Milligan I, Fu L, Franckowiak E A, Du W. Angew. Chem. Int. Ed., 2013, 52: 13699.
|
| [15] |
Demchenko A, Stauch T, Boons G J. Synlett, 1997, 818.
|
| [16] |
(a) Chao C S, Li C W, Chen M C, Chang S S, Mong K K T. Chem. Eur. J., 2009, 15: 10972
(b) Yang F, Zhu Y, Yu B. Chem. Commun., 2012, 48: 7097
(c) Kimura T, Eto T, Takahashi D, Toshima K. Org. Lett., 2016, 18: 3190.
|
| [17] |
Zhao Q, Zhang H, Zhang Y, Zhou S, Gao J. Org. Biomol. Chem., 2020, 18, 6549.
|
| [18] |
(a) Kononov L O, Malysheva N N, Kononova E G, Orlova A V. Eur. J. Org. Chem., 2008, 3251;
(b) Kononov L O, Malysheva N N, Orlov A V. Eur. J. Org. Chem., 2009, 611.
|
| [19] |
Orlova A V, Ahiadorme D A, Laptinskaya T V, Kononov L O. Rus. Chem. Bull., 2021, 70: 2214.
|
| [20] |
Durand A. Eur. Polym. J., 2007, 43: 1744.
|
| [21] |
Valverde S, GÓmez A M, LÓpez J C, HerradÓn B. Tetrahedron Lett., 1996, 37: 1105.
|
| [22] |
Sharkey P F, Eby R, Schuerch C. Carbohydr. Res., 1981, 96: 223.
|
| [23] |
Jona H, Takeuchi K, Mukaiyama T. Chem. Lett., 2000, 1278.
|
| [24] |
Satoh T, Imai T, Ishihara H, Maeda T, Kitajyo Y, Narumi A, Kaga H, Kaneko N, Kakuchi T. Macromolecules, 2003, 36: 6364.
|
| [25] |
(a) Hansen S U U, Miller G J, Jayson G C, Gardiner J M, Org. Lett., 2013, 15: 88;
(b) Hansen S U, Miller G J, Cliff M J, Jayson G C, Gardiner J M. Chem. Sci., 2015, 6: 6158;
(c) Naresh K, Schmacher F, Hahm H S, Seeberger P H. Chem. Commun., 2017, 53: 9085;
(d) Wu Y, Xiong D C, Chen S C, Wang Y S, Ye X S. Nat. Commun., 2017, 8: 14851;
(e) Joseph A A, Pardo-Vargas A, Seeberger P H. J. Am. Chem. Soc., 2020, 142: 8561;
(f) Zhu Q, Shen Z, Chiodo F, Nicolardi S, Molinaro A, Silipo A, Yu B. Nat. Commun., 2020, 11: 4142.
|
| [26] |
Yu Y, Tyrikos-Ergas T, Zhu Y, Fittolani G, Bordoni V, Singhal A, Fair R J, Grafmüller A, Seeberger P H, Delbianco M. Angew. Chem. Int. Ed., 2019, 58: 13127.
|
| [27] |
Yu Y, Gim S, Kim D, Arnon Z A, Gazit E, Seeberger P H, Delbianco M. J. Am. Chem. Soc., 2019, 141: 4833.
|
| [28] |
(a) Xu R. Nat. Sci. Rev., 2018, 5: 1;
(b) Xu R, Wang K, Chen G, Yan W. Nat. Sci. Rev., 2019, 6: 191.
|
/
| 〈 |
|
〉 |