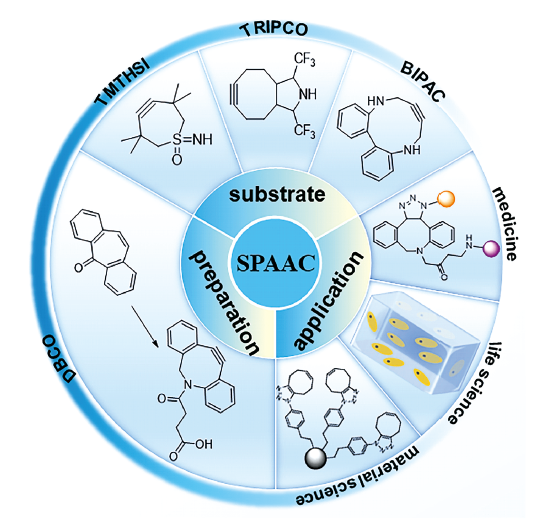
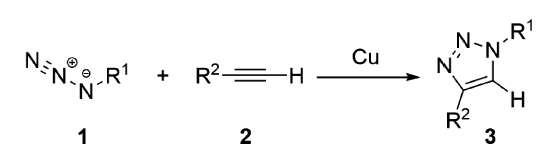
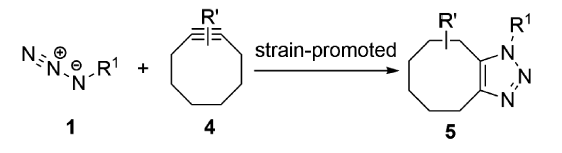
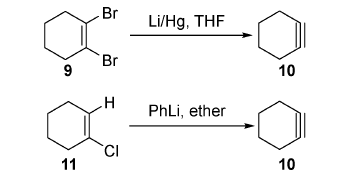
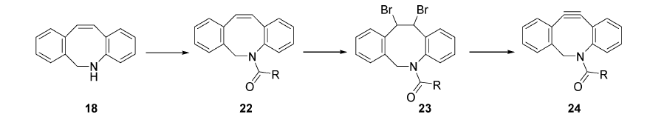
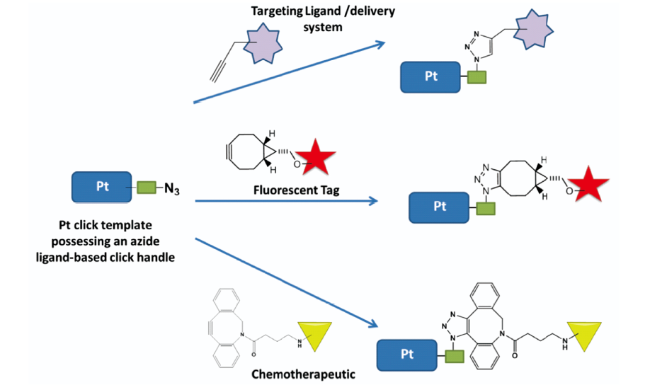
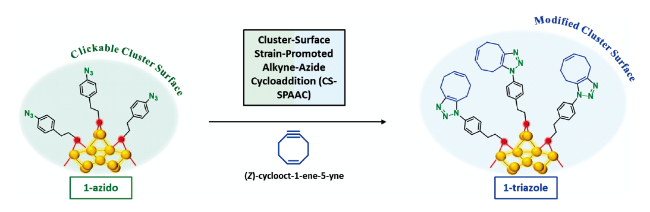
SPAAC在生物分子领域具有良好的生物正交性
[62]。在不需要使用铜催化剂的前提下,仅是叠氮化物和环炔烃的引入并不会带来生物毒性或是对生物分子的效能产生影响,故而能够帮助达成许多从前难以实现的合成或特异性结合。其良好的生物正交反应性,使其在活体细胞或组织中进行反应的同时不干扰生物自身生化过程的反应
[63]。Bertozzi等在2004年便成功地以OCT作为炔烃底物,在细胞内实现了SPAAC反应
[11]。时至今日,SPAAC反应已经在生命科学领域得到了十分广泛的利用,其中常见的应用有进行生物正交标记,包括荧光探针标记
[64⇓~66]、生物特异性蛋白标记
[67⇓⇓~70]和生物放射性标记
[71⇓~73]等;进行生物大分子的修饰,包括对蛋白质分子的修饰
[74⇓⇓~77]和对核苷酸分子的修饰
[78⇓~80]等;以及帮助进行蛋白质偶联,包括加速蛋白质之间的偶联以制备特殊载体
[81]和加速聚乙二醇偶联至肽或蛋白质,即加速聚乙二醇化
[45]等。这些领域也可以进行综合应用,如利用活细胞代谢标记糖偶联物的可视化以展开研究
[82]、与炔烃RNA特异性反应以分析烟酰胺腺嘌呤二磷酸(NAD(+))封端转录本
[83]和脉冲标记新生蛋白质以评估其稳定性
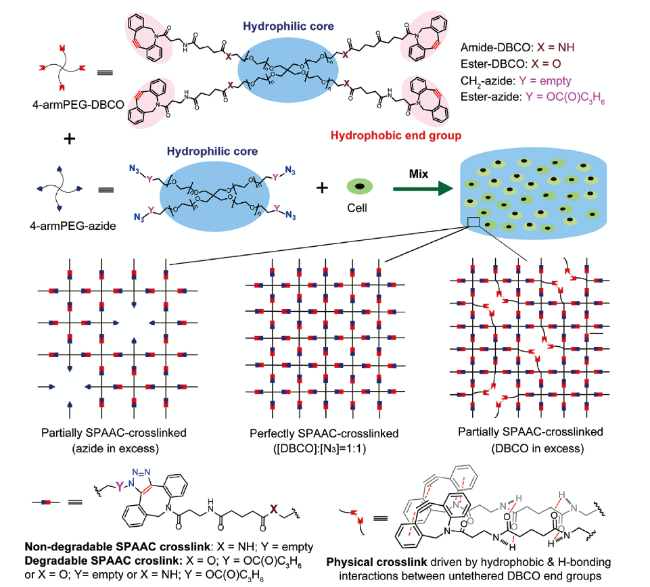
[84]等。作者曾经报道了通过SPAAC反应精确构筑一系列具有可控黏弹性、刚度和降解性能的水凝胶,并进一步考察这些性质在水凝胶作为三维生长支架对幼鼠软骨细胞和关节炎病人的软骨细胞生长以及软骨特征蛋白沉积的影响。(
图5)
[85]。在这项工作中,通过单一变量,全面地考察了黏弹性水凝胶性质对封装软骨细胞生长的影响。这是首次报道DBCO-DBCO可逆物理交联对水凝胶的粘弹性、刚度和降解速率产生重要影响。通过调节水凝胶的降解速率,该水凝胶可以用于三维细胞培养以及细胞可控释放。在此基础上,作者通过SPAAC反应在水凝胶中引入中性、阴性和两性聚合物分子刷实现对刚度和粘弹性的可控调节,并进一步研究了大鼠干细胞转录因子YAP/TAZ对细胞外基质的机械信号的感知作用
[86]。