

Efficient Design Strategies for Nanozymes
Received date: 2020-11-15
Revised date: 2020-12-07
Online published: 2020-12-09
Supported by
the National Natural Science Foundation of China(21874067)
the National Natural Science Foundation of China(21722503)
the National Key R&D Program of China(2019YFA0709200)
the CAS Interdisciplinary Innovation Team(JCTD-2020-08)
the PAPD program, and the Fundamental Research Funds for the Central Universities(14380145)
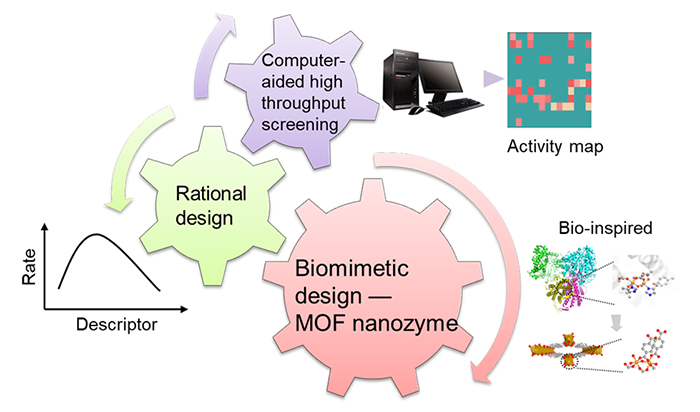
The enzyme-like activity of nanozymes is an emerging effect of nanomaterials. Due to the excellent physicochemical properties and unique enzyme-like activities, nanozymes have become promising functional nanomaterials. Till now nanozymes have been used in biomedical sensing, diagnosis and therapeutics, as well as environment protection. Despite of the great success achieved in the past several decades, how to efficiently design nanozymes is still one of the bottlenecks in the field, which is originated from the complicated composition and ambiguity in the active sites of nanomaterials. To tackle these challenges, this insight first summarizes the current efficient design strategies of nanozymes, such as computation-aided high throughput screening, rational design, and biomimetic design. And then, the development of bio-inspired metal-organic framework(MOF) nanozymes, particularly the structure-activity relationship study, is highlighted. At the end, combined with current research trend, several directions and inspirations for the future study are suggested to advance the nanozymes research.
1 An emerging effect of nanomaterials: enzyme-like activity of nanozymes
2 One of the bottlenecks: how to efficiently design nanozymes
2.1 Computation-aided high throughput screening
2.2 Rational design
2.3 Biomimetic design
3 Bio-inspired design of MOF nanozyme and its structure-activity relationship
4 Conclusions and outlook
Jiangjiexing Wu , Hui Wei . Efficient Design Strategies for Nanozymes[J]. Progress in Chemistry, 2021 , 33(1) : 42 -51 . DOI: 10.7536/PC201117
The authors have declared that no competing interests exist.
特别感谢秦溧对类过氧化物酶纳米酶动力学数据的统计和分析;特别感谢周子君设计与绘制封面图。
We thank Li Qin for his help with the kinetic data of peroxidase-mimicking nanozymes and Zijun Zhou for her design and make the cover art.
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
/
| 〈 |
|
〉 |