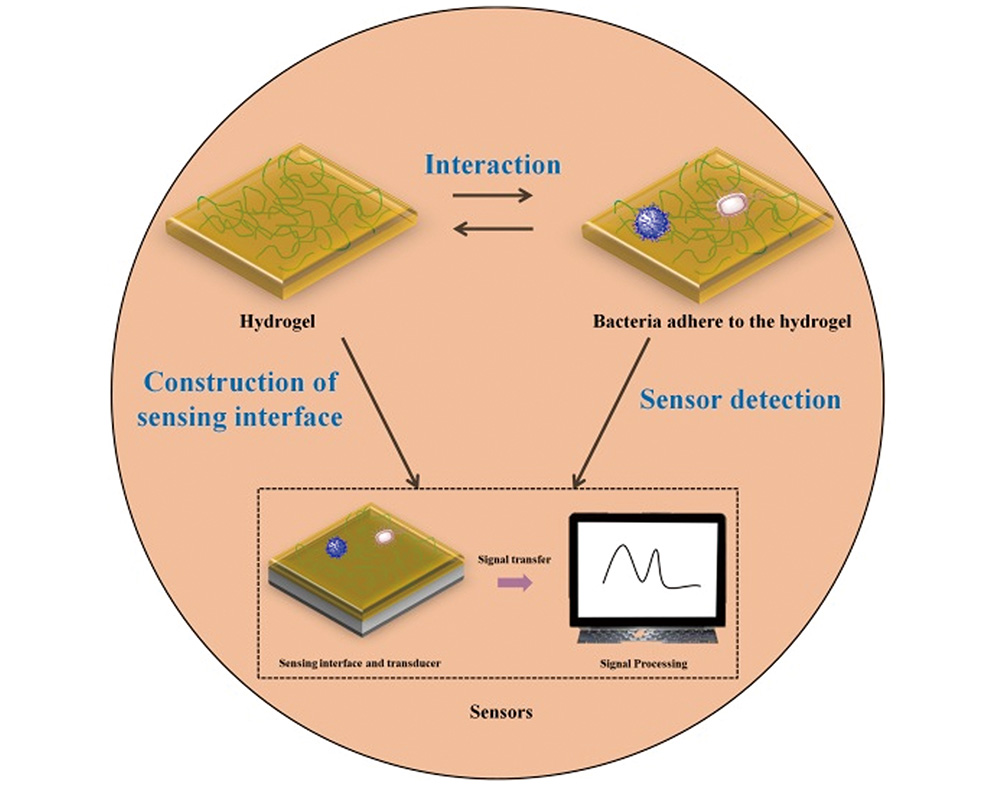
1 引言
2 水凝胶及其与细菌的相互作用研究进展
2.1 功能高分子水凝胶材料
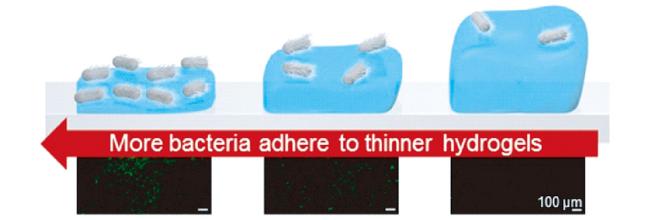
2.2 水凝胶与细菌相互作用
3 基于水凝胶的细菌传感检测
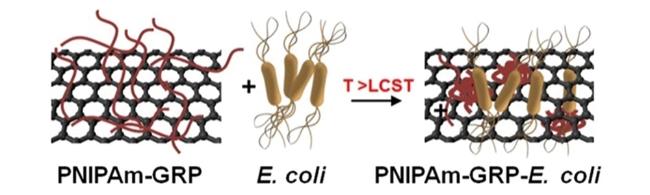
3.1 基于温敏型水凝胶的细菌传感检测
3.2 基于pH敏感型水凝胶的细菌传感检测
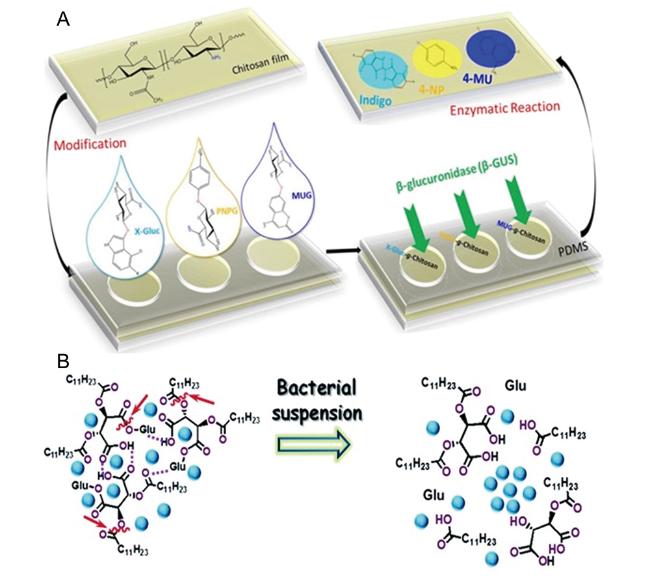
3.3 基于酶敏感型水凝胶的细菌传感检测
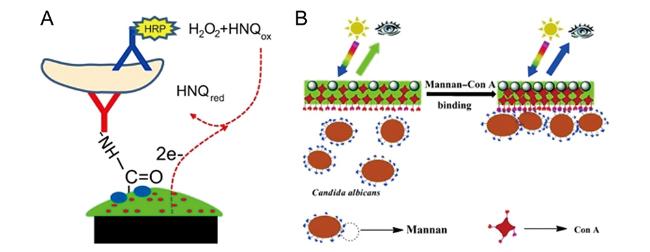
3.4 基于特异性标识物功能化水凝胶的细菌传感检测
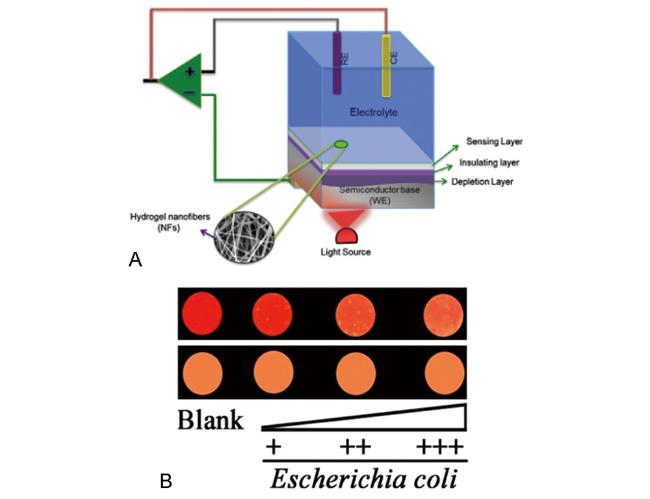
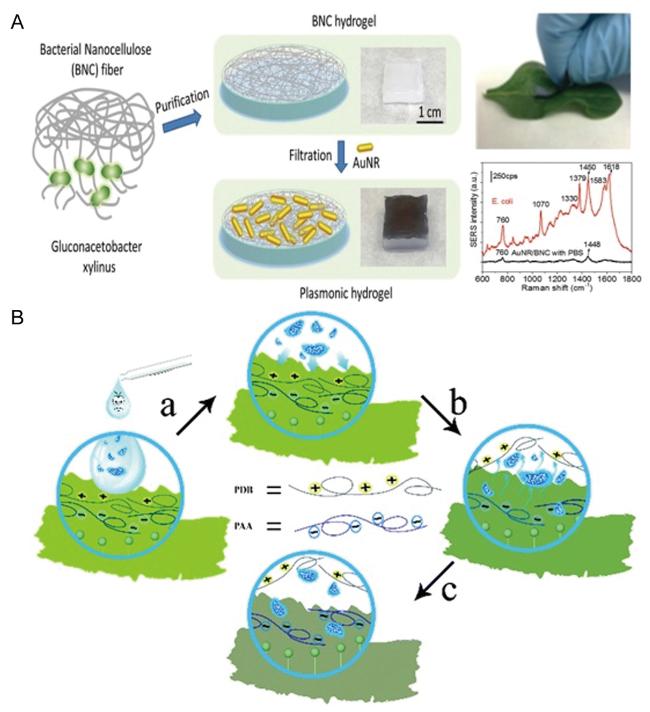
4 基于水凝胶的柔性传感器及其对细菌的检测
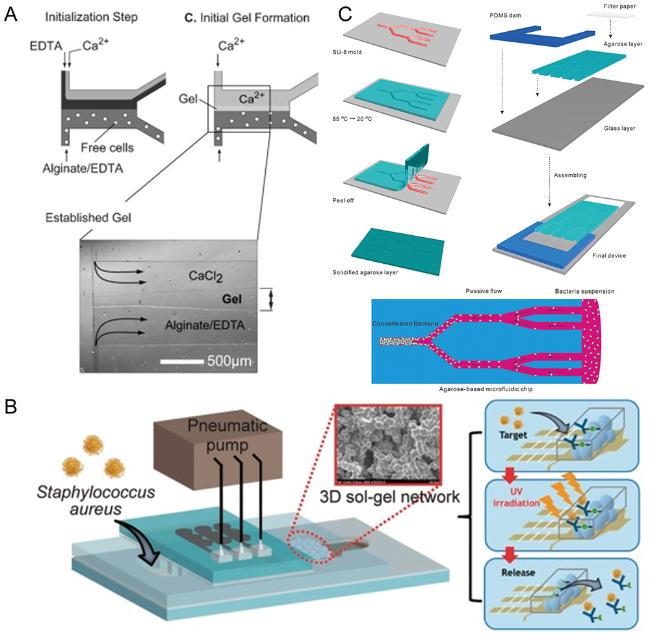
5 集成水凝胶的微流控传感芯片及其对细菌的检测
图7 (A)芯片上海藻酸钙凝胶捕获释放酵母菌的示意图[52];(B)集成硅水凝胶的微流控芯片示意图及金葡菌检测流程图[53];(C)琼脂糖水凝胶芯片的制备及其浓缩细菌的过程示意图[54]Fig.7 (A) Schematic diagram of the capture and release of yeast by calcium alginate gel in the chip[52]; (B) Schematic of microfluidic device integrated with silicon hydrogel and flow chart of S. aureus detection[53]; (C) Schematic illustration of the preparation of agarose hydrogel chip and the concentration process of bacteria in the chip[54] |