1 引言
2 肿瘤诊断
2.1 化学场驱动型马达用于循环肿瘤细胞(CTC)检测
2.2 物理场驱动型马达用于胞内肿瘤相关标志物检测
3 药物靶向递送
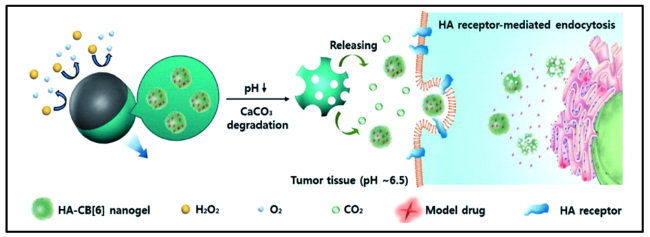
3.1 化学场驱动型马达辅助药物靶向递送
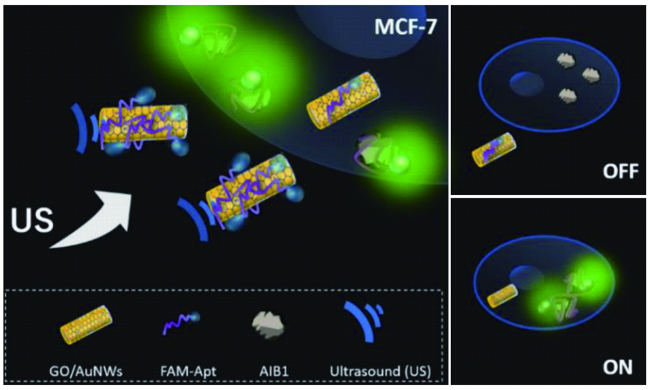
图4 (a) 基于介孔二氧化硅纳米粒子的脲酶催化纳米马达制备过程示意图[73];(b) 脲酶催化纳米马达应用于药物靶向递送的原理示意图;该马达以脲酶催化尿素为动力,超分子阀门在癌细胞的酸性环境下打开并释放马达所负载的药物[73]Fig. 4 (a) Schematic illustration of the fabrication of enzyme-powered mesoporous silica nanomotors[73];(b) Schematic of enzyme-powered nanomotors for drug delivery;the nanomotors are driven by the enzymatic conversion of urea; at acidic pH in cancer cells, supramolecular nanovalve opens and releases their cargo[73] |
3.2 物理场驱动型马达辅助药物靶向递送
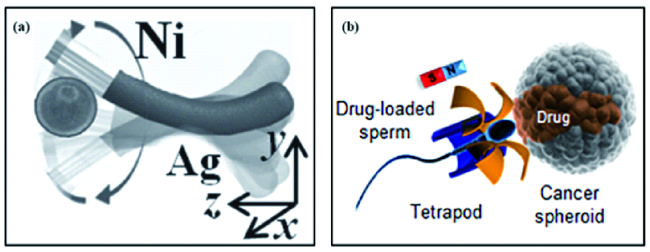
图5 (a) 用于药物靶向递送的磁场驱动纳米马达结构示意图[39];(b) 精子混合马达用于药物靶向递送;负载有抗癌药物的精子混和马达在磁场引导下到达肿瘤细胞表面,其结构中的磁性四角架弯曲的同时原位释放精子[75]Fig. 5 (a) Schematic diagram of the structure of magnetically driven nanomotors for targeted drug delivery[39];(b) The sperm-hybrid micromotor for targeted drug delivery. The drug-loaded sperm can be guided magnetically, and when the tetrapod of the micromotor hits a tumor spheroid, the tetrapod bends and releases the drug-loaded sperm[75] |
图6 (a) 在4 MHz超声场中棒状马达的运动示意图,包括平面内旋转、轴向运动及链组装等[77];(b) 超声驱动的多孔纳米金马达用于药物靶向递送的示意图[38];(c) 超声驱动纳米马达用于递送siRNA的示意图,包括荧光图像[78]Fig. 6 (a) Schematic illustration of the kinds of motion in a 4 MHz acoustic field, including in-plane rotation, axial directional motion, chain assembly, etc.[77];(b) Schematic of nanoporous Au nanomotors for targeted drug delivery under ultrasound field[38];(c) Schematic diagram of the acoustically propelled nanomotors for siRNA delivery, including fluorescence images[78] |
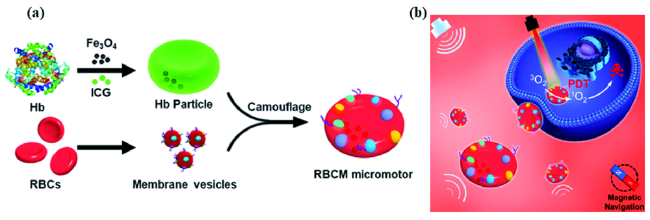
4 马达辅助的肿瘤光治疗
4.1 肿瘤的光热疗法
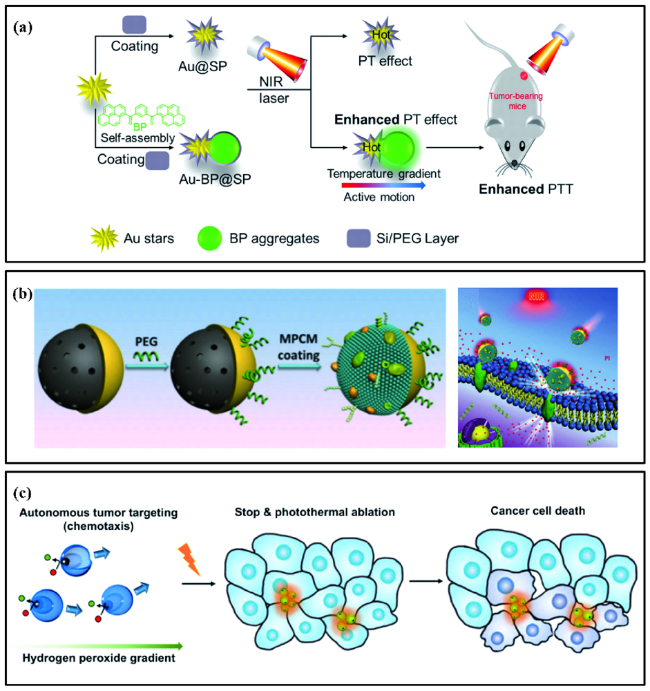
图7 (a) Au-BP@SP Janus纳米马达在近红外照射下实现肿瘤光热治疗的示意图[87];(b) 巨噬细胞膜(MPCM)掩盖的Janus中孔二氧化硅纳米马达的制备及其用于肿瘤光热疗法的过程示意图[88];(c) 口腔细胞纳米马达对肿瘤细胞进行光热消融的示意图[89]Fig. 7 (a) Schematic diagram of a Au-BP@SP Janus nanoparticle for PTT under NIR laser irradiation[87];(b) Schematic diagram of the fabrication of the MPCM-camouflaged Janus mesoporous silica nanomotor(MPCM@JMSNM) and its application in tumor photothermal therapy[88];(c) Schematic illustration for the autonomous photothermal ablation of cancer cells using the nanomotors[89] |