Contents
1 引言
2 手性碳量子点的制备
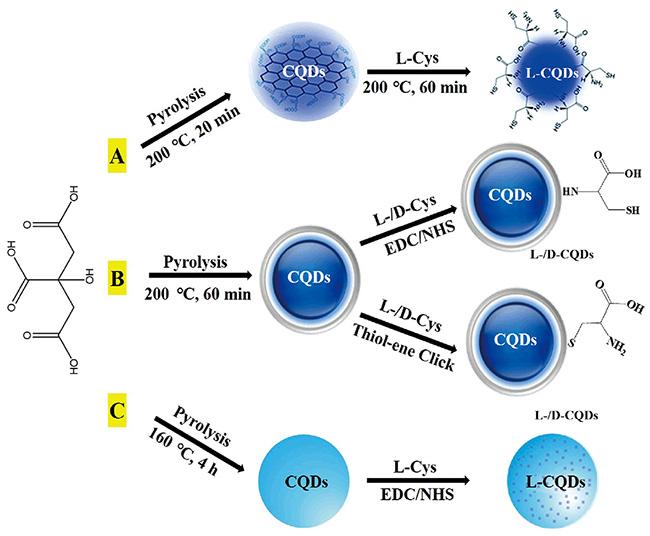
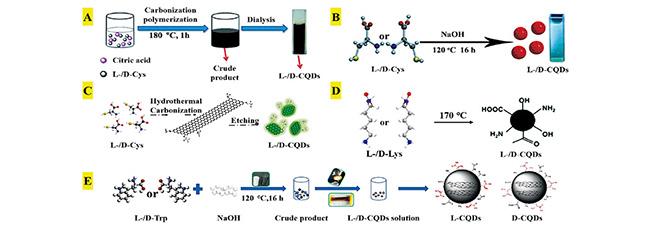
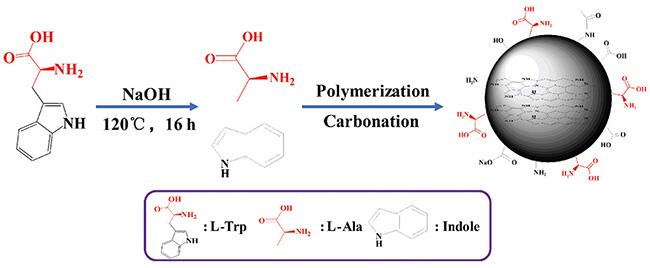
表1 手性CQDs的合成路线总结[10, 34,35, 57~69]Table 1 Summary of synthesis routes for chiral CQDs[10, 34,35, 57~69] |
| Step | Method | Carbon source | Chiral source | Application | ref |
|---|---|---|---|---|---|
| Two-step | Chemical oxidation-dehydration | Graphite | (R)/(S)-2-2-phenyl-1-propanol | — | 57 |
| Chemical oxidation-EDC/NHS | Carbon fiber | L-/D-Cys | — | 58 | |
| Pyrolysis-dehydration | Citric acid | L-Cys | Golgi apparatus targeted imaging | 35 | |
| Pyrolysis-dehydration | Citric acid | L-/D-Cys | Chiral detection | 59 | |
| Pyrolysis-EDC/NHS | Citric acid | L-Cys | Chiral detection | 60 | |
| Microwave-EDC/NHS | Sucrose | L-/D-Pro/Phe//His/Pro methyl ester/Ala/Trp | — | 61 | |
| One-step | Pyrolysis | L-/D-Met、D-Glc、D-GlcA、L-Asp、L-Ala | — | 62 | |
| Microwave | Sucrose | Sparteine | — | 63 | |
| Electrochemical | Graphite rod | L-/D-Cys | Selective tuning of enzyme activity | 64 | |
| Hydrothermal | Citric acid | L-/D-Cys | Chiral catalysis | 65 | |
| Citric acid | L-/D-Cys | Promotion of mung bean plant growth | 66 | ||
| L-/D-Cys | Chiral cataly-sis | 34 | |||
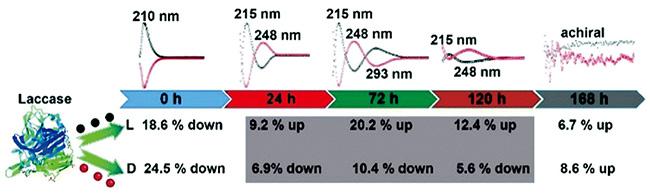
| L-/D-Cys | Selective regulation of cellular energy metabolism | 10 | |||
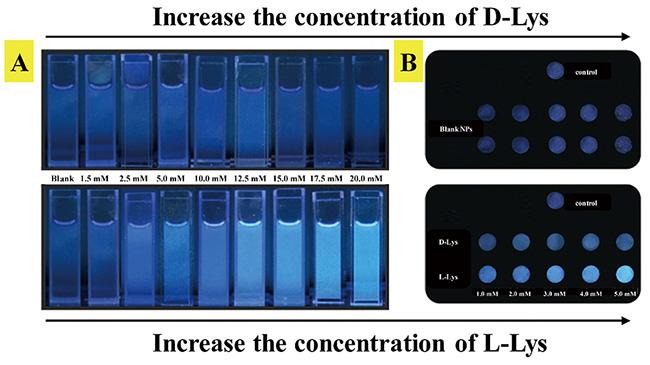
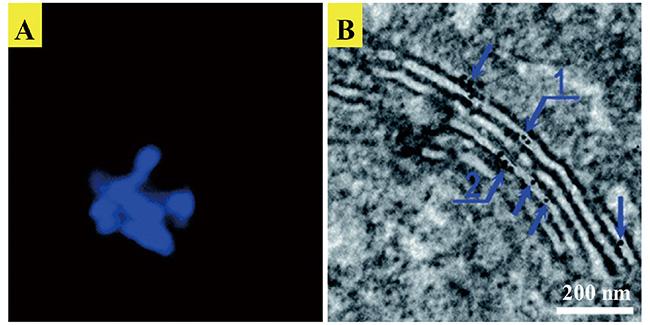
| L-/D-Lys | Selective tuning of protein activity | 67 | |||
| L-/D-Lys | Selective tuning of protein activity | 68 | |||
| L-/D-Trp | — | 69 | |||
2.1 两步法
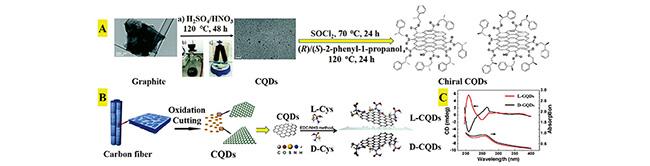
图1 化学氧化法制备手性CQDs。(A) 以石墨和(R)/(S)-2-苯基-1-丙醇为原料合成的手性CQDs[57];(B) 以碳纤维和L-/D-Cys为原料合成的L-/D-CQDs[58];(C) L-/D-CQDs的CD光谱[58]Fig. 1 Synthesis of chiral CQDs by chemical oxidation. (A) chiral CQDs synthesized from graphite and (R)/(S) -2-phenyl-1-propanol[57]; (B) L-/D-CQDs synthesized from carbon fiber and L-/D-Cys[58]; (C) CD spectrum of L-/D-CQDs[58] |
2.2 一步法
3 手性碳量子点的应用
3.1 手性催化
3.2 手性检测
3.3 生物领域
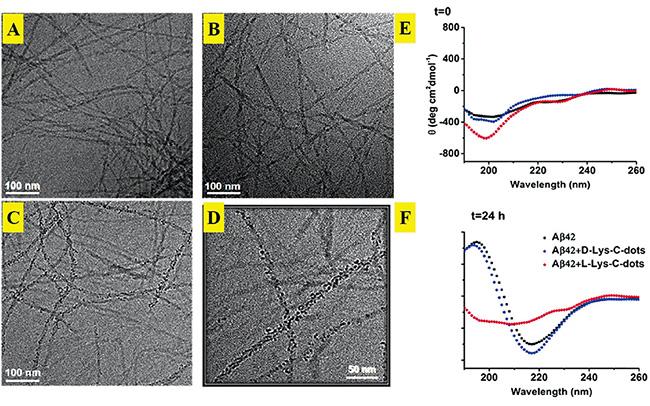
图8 25 mM的Aβ42在缓冲液(A),缓冲液+ 0.2 mg·mL-1 D-CQDs (B),0.2 mg·mL-1 L-CQDs (C和D)存在时孵化24 h后的Cryo-TEM图像;采用CD光谱记录在D-/L-CQDs(浓度为0.2 mg·mL-1)不存在或存在时,25 mM的Aβ42在t=0 (E) 和24 h (F) 的二级结构的图谱[67]Fig. 8 Cryo-TEM images of 25 mM Aβ42 samples after 24 h incubation in buffer (A), in buffer + 0.2 mg·mL-1 D-CQDs (B), in the presence of 0.2 mg·mL-1 L-CQDs (C and D); Secondary structures of 25 mM Aβ42 were recorded at t=0 (E) and 24 h (F) by CD spectroscopy in the absence or presence of D-/L-CQDs (each at a concentration of 0.2 mg·mL-1) respectively[67] |
图9 朊病毒肽 (106-126) 纤维在对映体L-/D-CQDs存在时的形态。(A~C) 朊病毒肽 (106-126) 沉积在涂有DMPC:DMPG脂质双分子层(1∶1摩尔比)的硅片上的AFM图像(在湿的条件下记录的)(A) 在没有CQDs的情况下,(B) 在有L-CQDs的情况下,(C) 在有D-CQDs的情况下[68]Fig. 9 Morphology of PrP (106-126) fibrils in the presence of enantiomeric L-/D-CQDs. (A~C) AFM images (recorded in wet conditions) of PrP (106-126) deposited upon a silicon wafer coated with a DMPC:DMPG lipid bilayer (1∶1 mole ratio) (A) in the absence of CQDs, (B) in the presence of L- CQDs, and (C) in the presence of D- CQDs[68] |
图10 绿豆在浓度分别为0、10、50、100、500和1000 μg·mL-1(从左到右)的L-/D-CQDs水溶液中自然光下照射培养5天后的数码照片[66]Fig. 10 Digital photograph of mung bean grown in L-/D-CQDs aqueous solution with concentrations of 0, 10, 50, 100, 500 and 1000 μg·mL-1, respectively (from left to right) after incubation for 5 days with natural lighting[66] |