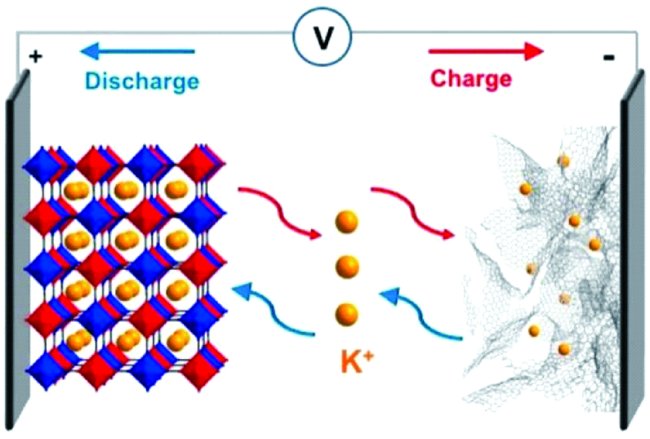
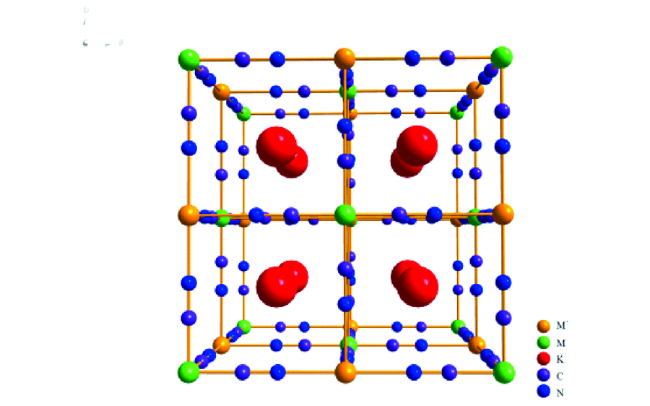
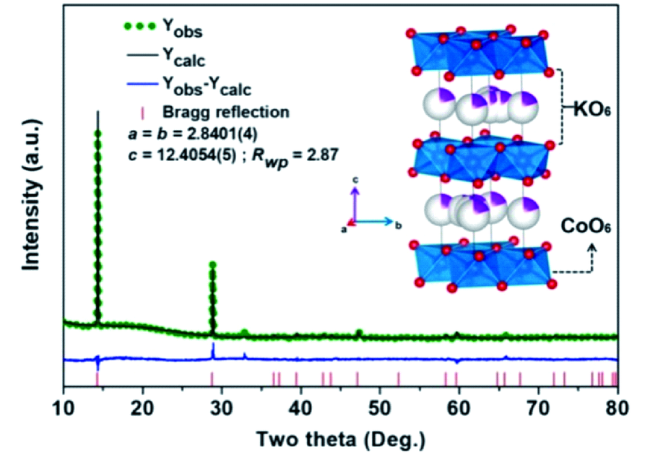
Contents
1 引言
2 钾离子电池正极材料
2.1 普鲁士蓝类正极材料
2.2 层状过渡金属氧化物类正极材料
2.3 聚阴离子类正极材料
2.4 有机化合物类正极材料
3 钾离子电池负极材料
3.1 嵌入类负极材料
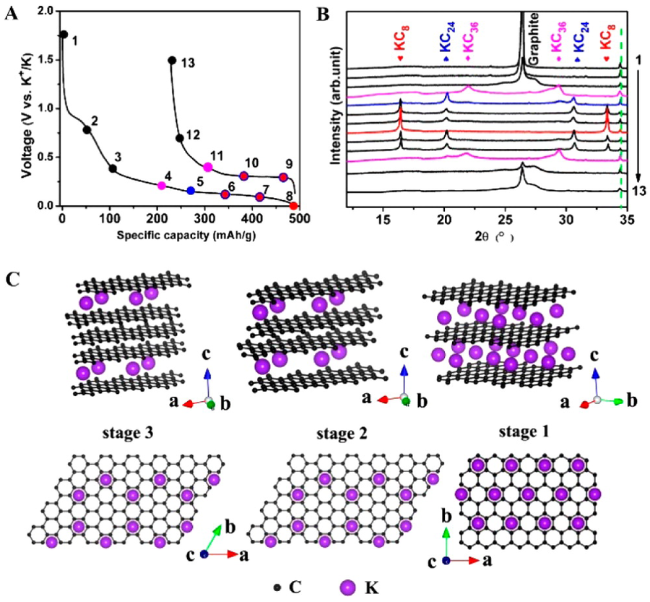
图4 (A)在C/10电流密度下的第一圈恒流充放电曲线;(B)第一圈循环中选定荷电状态的非原位XRD表征;(C)钾离子嵌入石墨后形成的钾层间化合物的结构示意图[33]Fig. 4 (A) First-cycle galvanostatic charge and discharge profiles at C/10;(B) Ex situ XRD for selected states of charge in the first-cycle;(C) Structure diagrams of different K-GICs, side view(top row) and top view(bottom row)[33].Copyright 2015 American Chemical Society |
3.2 合金类负极材料
3.3 转化类负极材料
4 钾离子电池电解液
表1 近年来关于钾离子电极材料电化学性能汇总表Table 1 Summary of electrochemical performance about potassium-ion electrode materials in recent years |
| Molecular formula | Electrochemical property | ref | |||
|---|---|---|---|---|---|
| Voltage range (V vs K/K+) | Current | Initial capacity (mAh·g-1) | Cycle performance | ||
| K0.220Fe[Fe(CN)6]0.805·4.01H2O | 2.0~4.0 V | 50 mA·g-1 | 76.7 | 93.4%(50 cycles) | 2 |
| K1.92Fe[Fe(CN)6]0.94·0.5H2O | 2.0~4.3 V | 0.1 C | 133 | 92.8%(200 cycles) | 4 |
| K1.89Mn[Fe(CN)6]0.92·0.75H2O | 2.5~4.6 V | 0.2 C | 142.6 | — | 5 |
| K1.75Mn[Fe(CN)6]0.93·0.16H2O | 2.0~4.5 V | 30 mA·g-1 | 137 | — | 8 |
| KFeⅡ[FeⅢ(CN)6] | 2.0~4.5 V | 10 mA·g-1 | 118.7 | 93.73%(100 cycles) | 10 |
| K1.7Fe[Fe(CN)6]0.9 | 2.0~4.5 V | 10 mA·g-1 | 140 | 65%(300 cycles) | 11 |
| P2-K0.6CoO2 | 1.7~4.0 V | 10 mA·g-1 | 82 | 87%(300 cycles) | 16 |
| K0.7Fe0.5Mn0.5O2 | 1.5~4.0 V | 20 mA·g-1 | 178 | 76%(250 cycles) | 19 |
| K0.65Fe0.5Mn0.5O2 | 1.5~4.2 V | 20 mA·g-1 | 151 | 78%(350 cycles) | 20 |
| V2O5·0.6H2O Xerogel | 1.5~4.0 V | 50 mA·g-1 | 224.4 | 78.3%(100 cycles) | 21 |
| P3-K0.69CrO2 | 1.5~3.8 V | 0.1 C | 100 | 65%(1000 cycles) | 23 |
| K3V2(PO4)3/C | 2.5~4.03 V | 20 mA·g-1 | 77 | — | 25 |
| KVPO4F | 2.0~5.0 V | 0.05 C | 92 | 97%(30 cycles) | 26 |
| KVPO4F | 3.0~5.0 V | 5 mA·g-1 | 105 | — | 27 |
| K3V2(PO4)2F3 | 2.0~4.6 V | 10 mA·g-1 | 100 | 97%(100 cycles) | 28 |
| PTCDA | 1.5~3.5 V | 10 mA·g-1 | 131 | 66.1%(200 cycles) | 29 |
| Poly(anthraquinonyl sulfide) | 1.5~3.4 V | 20 mA·g-1 | 211 | 75%(50 cycles) | 31 |
| Graphite | 0~1.5 V | 20 mA·g-1 | 246 | 89%(200 cycles) | 35 |
| Nitrogen-Doped Graphene | 0~1.5 V | 50 mA·g-1 | 350 | — | 36 |
| S-RGO | 0.01~3.0 V | 50 mA·g-1 | 3648 | 79%(50 cycles) | 38 |
| Hard Carbon Microspheres | 0~1.5 V | 28 mA·g-1 | 262 | 83%(100 cycles) | 39 |
| Ordered mesoporous carbon | 0.01~2.6 V | 50 mA·g-1 | 307.4 | — | 40 |
| Red P@CN | 0.01~2.0 V | 100 mA·g-1 | 715.2 | — | 48 |
| MoSe2/N-C | 0.01~3.0 V | 100 mA·g-1 | 278.3 | — | 50 |