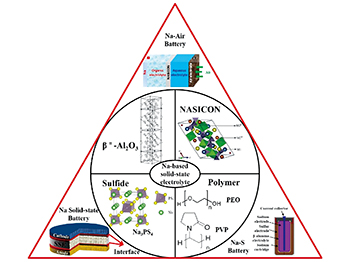
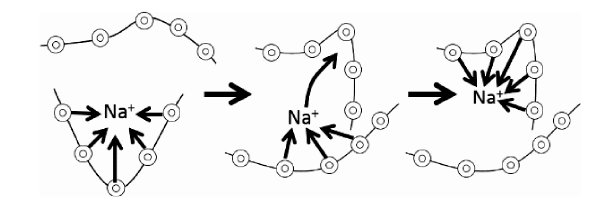
随着固态电池技术的发展,人们发现界面阻抗较大及界面枝晶等问题的本质是由于固-固界面接触较差引起的,因此,优化界面结构提高界面接触性是解决界面问题的关键。改进固体电解质制备工艺获得高性能复合固体电解质能提高离子电导率、界面的稳定性和接触性。Yubuchi等
[80]使用
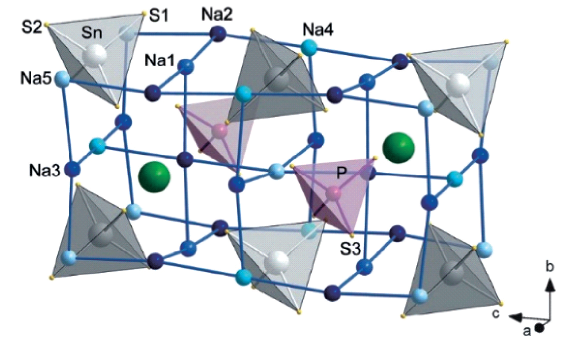
N-甲基甲酰胺(NMF)作溶剂先将原料Na
2S和P
2O
5溶解于溶剂中反应,然后去除溶剂,通过该液相法制备了立方相Na
3PS
4固态电解质,室温离子电导率为2.6×10
-6 S/cm。虽然其电导率较低,但是使用NMF作溶剂制备的Na
3PS
4固态电解质能在电极表面形成较大的接触界面层,应用于全固态电池中具有较好的循环性能。Zhu等
[81]通过热处理工艺制备得到Na
1.5Al
0.5Ge
1.5P
3O
12玻璃-陶瓷电解质,室温离子电导率为9.27×10
-5 S/cm,由于该电解质晶粒均一且对金属钠稳定性较好,因此能改善金属钠与该电解质的界面问题。Gerbaldi等
[50]制备了PEO-Na-CMC复合固态电解质,与电极间具有更好的兼容性和更理想的离子扩散路径,应用于固态电池中的电荷传输阻抗比PEO更小。Zhou等
[82]提出在传统PEO聚合物电解质中添加介孔有机聚合物(HMOP)形成复合聚合物电解质,该复合电解质具有较高的机械性能和热稳定性(250 ℃),还能抑制枝晶形成,有效降低界面阻抗。应用于65 ℃下全固态钠离子电池Na/HMOP-PEO-HMOP/NaTi
2(PO
4)
3中,在0.5 C下循环100次后仍有80 mAh/g的容量。Gao等
[83]以Na
2MnFe(CN)
6作阴极,与NASICON固体电解质形成了稳定性较好的阴极-固体电解质界面,同时对阳极-固体电解质进行界面修饰,有效抑制钠枝晶的产生。因此,电池循环稳定性显著提高。Zhou等
[84]提出了两种解决界面问题的方法:一种是通过对钠阳极和NASICON型陶瓷进行热处理在界面处原位形成一层薄的H-NASICON夹层(H:热处理);另一种方法是在固体电解质两侧进行界面修饰形成 “三明治”结构的复合电解质,这两种方法均能有效降低界面阻抗和抑制枝晶形成,提高电池循环性能。Zhang等
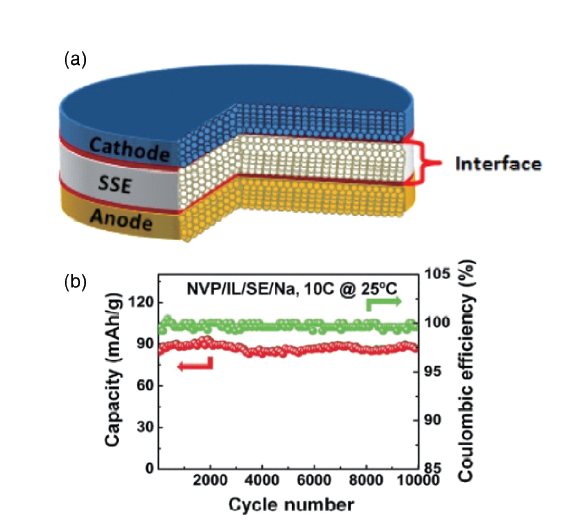
[27]制备了一种新型且具有较高离子电导率的复合固体电解质,并在正极一侧滴加少量离子液体,增强界面接触,提高界面动力学性能。在正极-固体电解质界面处构建了良好的离子迁移通道,提高离子传输率,为电极反应提供缓冲空间,电池表现了超长的循环性能,在室温下循环10 000次后仍无衰减(
图9b),该结果是目前全固态钠离子电池中报道的最优性能。