1 引言
2 肽的概述
3 多肽电化学生物传感的应用
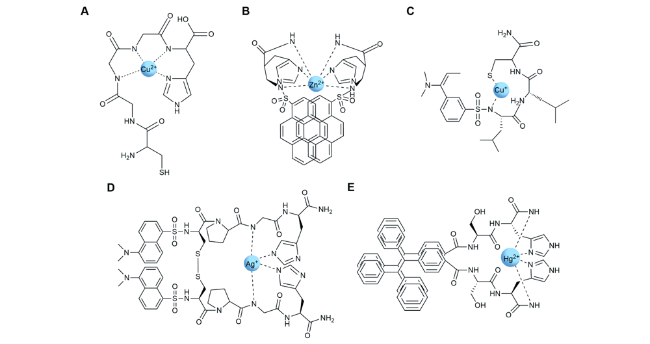
3.1 重金属离子的识别检测
3.2 小分子的识别检测
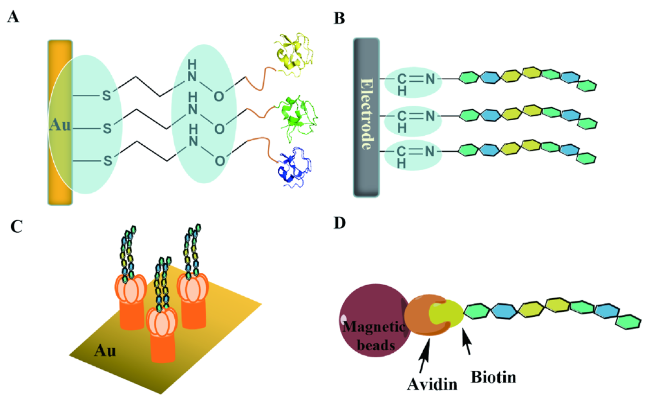
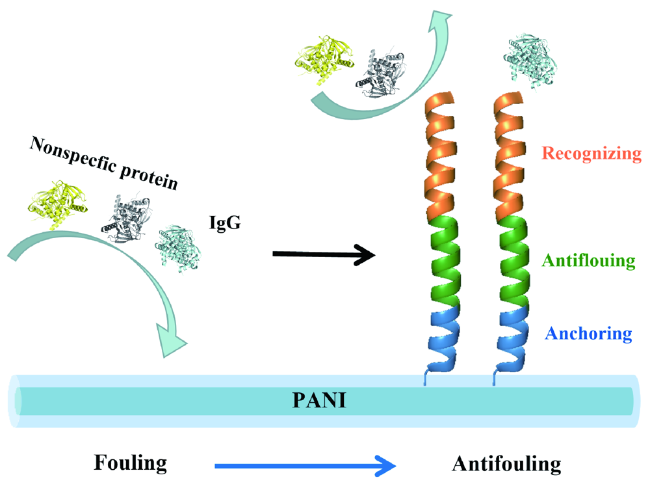
3.3 蛋白质的识别检测
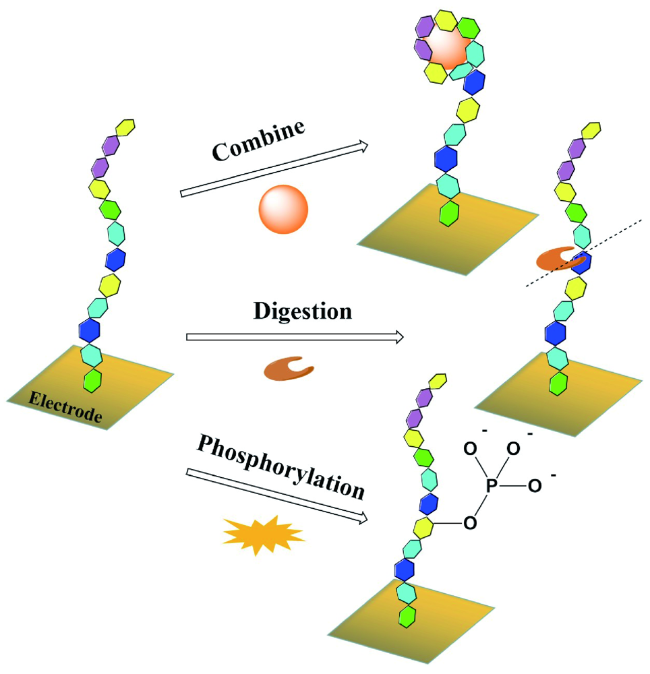
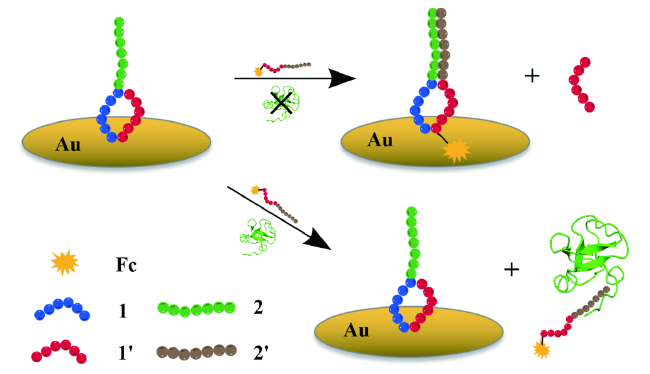
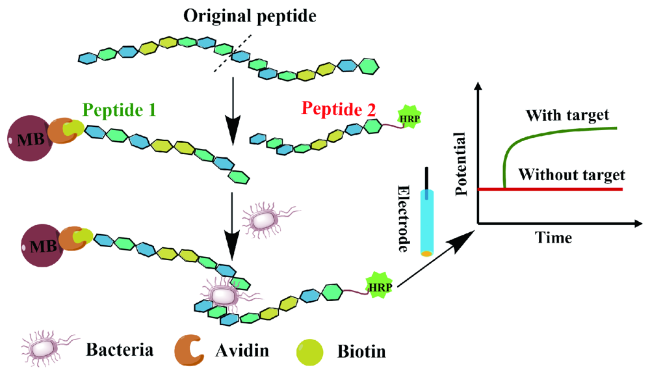
图3 多肽识别蛋白质的三种方式Fig. 3 Three different kinds of interactions between proteins and peptides |
表1 肽基电化学传感对蛋白质的识别检测Table 1 The recognition and detection of protein by peptide-based electrochemical biosensor |
| Protein | Sequence of peptide | Linear range | Detection limit | Method | ref |
|---|---|---|---|---|---|
| Neutrophil gelatinase-associated lipocalin | DRWVARDPASIFGGGGSC | - | 1.74 μg/mL | Electrochemical Impedance Spectroscopy | 29 |
| Eucine-rich α-2-glycoprotein 1 | QDIMDLPDINTLGGGGSC | 0~0.25 μg/mL | 0.025 μg/mL | Electrochemical Impedance Spectroscopy | 30 |
| Cardiac troponin I | CFYSHSFHENWPS | 15.5~1.55×103 pg/mL | 3.4 pg/mL | Electrochemical Impedance Spectroscopy | 31 |
| CFYSHSFHENWPSK | - | 0.3 pg/mL | Electrochemiluminescence | 44 | |
| Metalloproteinase | GYPKSALR | 1~10 μg/L | 0.19 μg/L | Electrochemical Impedance Spectroscopy | 32 |
| PLGVR | - | 33 fg/mL | Electrochemiluminescence | 60 | |
| GPLGVRGKGGC | 0.1~103 pg/mL | 0.078 pg/mL | Differential Pulse Voltammetry | 54 | |
| NS1 protein | EHDRMHAYYLTR | - | 0.025 μg/mL | Electrochemical Impedance Spectroscopy | 33 |
| Human chorionic gonadotropin | PPLRINRHILTR | 0.01~0.2 UI/mL | 0.6 mIU/mL | Electrochemical Impedance Spectroscopy | 34,35 |
| Beta-amyloid oligomer | THSQWNKPSKPKTNMK | 0.01~200 nmol/L | 6 pmol/L | Linear Sweep Voltammetry | 36 |
| Human immunoglobulin G | HWRGWVA | - | 0.26 ng/mL | Differential Pulse Voltammetry | 40 |
| Antibodies of HPV | SPINNTKPHEAR | 0.01~0.02 μg/L | - | Amperometry | 37 |
| Anti-Toxoplasma gondii immunoglobulins | APTGDPSQNSDGNRG | - | - | Differential Pulse Voltammetry | 41 |
| Amyloid-β(1-42) | CPPPPTHSQWNKPSKPKTNMK | 0.003~7 ng/mL | 0.2 pg/mL | Differential Pulse Voltammetry | 42 |
| Specific IgG of juvenile idiopathic arthritis | ACSSWLPRGCGGGS | - | - | Differential Pulse Voltammetry | 43 |
| Tau protein | DVWMINKKRK | - | 0.3 nmol/L | Differential Pulse Voltammetry | 44 |
| R. rickettsii reactive antibodies | ANVVLFNDAVQLTQ | - | - | CyclicVoltammetry | 45 |
| Cry1Ab protein | TSMKLDRWIPPL | 0.01~100 ng/mL | 7.0 pg/mL | Square Wave Voltammetry | 46 |
| Prostate specific antigen | CEHSSKLQLAK | 1~1.0×108 fg/mL | 0.01 fg/mL | Chronoamperometry | 47,50,51 |
| Human epidermal growth factor receptor | CKLRLEWNR | 0.5~1.0 ng/mL | 0.08 pg/mL | Photoelectrochemistry | 48 |
| Caspase-3 | GDGDEVDGC | - | 5 fmol/L | Square Wave Voltammetry | 53 |
| EEAAADEVDFKKAAAC | 1~10 ng/mL | 24.62 pg/mL | Linear Sweep Voltammetry | 52 | |
| Trypsin | FRR | 2.5~2.0×105 pg/mL | 0.81 pg/mL | Square Wave Voltammetry | 55,56,57,61 |
| Cathepsin B | PLRFGA | - | 0.32 nmol/L | AC Voltammetry | 58 |
| Tyrosinase/Thrombin | KSAFPRGRY | 2.6~32/4.5~100 μg/mL | 1.5/1.9 μg/mL | Photoelectrochemistry | 59 |
| Histone acetyltransferases | RGKGGKGLGKGGAKAC | 0.01~150 nmol/L | 0.0036 nmol/L | Square Wave Voltammetry | 66 |
| Protein kinase | LRRASLGGGGC | - | 1.05 mU/mL | Square Wave Voltammetry | 63 |
| CLRRASLG | 0.01~50 U/mL | 0.0019 U/mL | Stripping Voltammetry | 64 | |
| CRRLRRASLG | 0.05~50 U/mL | 0.02 U/mL | Photoelectrochemistry | 65 |