

基于生物素的荧光有机小分子及其应用
收稿日期: 2019-08-19
修回日期: 2019-12-03
网络出版日期: 2020-02-20
基金资助
陕西省科技厅重点项目(2018PT-31)
陕西省科技厅青年基金项目(2019JQ-504)
陕西省自然科学基金项目(2019JM-229)
安康学院博士科研启动基金(2018AYQDZR06)
农业部富硒产品开发国家地方联合工程实验室开放课题资助项目(Se-2018B02)
版权
Fluorescent Organic Small Molecule Based on Biotin and Their Applications
Received date: 2019-08-19
Revised date: 2019-12-03
Online published: 2020-02-20
Supported by
Key Projects of Shaanxi Provincial Science & Technology Department(2018PT-31)
Youth Foundation of Shaanxi Provincial Science & Technology Department(2019JQ-504)
Natural Science Foundation of Shaanxi Province(2019JM-229)
Doctor’s Initial Funding of Ankang University(2018AYQDZR06)
Key Laboratory of Se-Enriched Products Development and Quality control, Ministry of Agriculture(Se-2018B02)
Copyright
张继东 , 刘阿晨 , 陈娇 , 袁光辉 , 金华峰 . 基于生物素的荧光有机小分子及其应用[J]. 化学进展, 2020 , 32(5) : 594 -603 . DOI: 10.7536/PC190819
Biotin is a water-soluble vitamin and serves as a coenzyme for carboxylases in human body. It is widely favored by chemists and biologists in recent years. In addition, it exhibits low toxicity in various physiological and pathological processes, and can be designed as a selectivity targeting drug carriers, which can efficiently deliver therapeutic drugs to cells. Nowadays, small molecules containing biotin have developed into a class of biofunctional molecules of high utility value. These compounds have the advantages of simple synthesis, easy functionalization, and high specificity. In this paper, the progress of biotin and its derivatives in biosensors, drug release and other fields are systematically reviewed, and the prospects for their development are presented.
1 Introduction
2 Fluorescent probe based on biotin structure
3 Targeted diagnostic and therapeutic molecular system based on biotin structure
4 Other biomolecules containing based on biotin structure
5 Conclusion
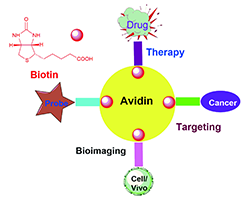
Key words: biotin; fluorescent probe; biological imaging; drug delivery
| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
/
| 〈 |
|
〉 |