

文章编号: 190929
文献标识码: A
ZIF-8纳米颗粒的粒径调控及生物医学应用
收稿日期:2019-09-23
修回日期:2019-11-26
网络出版日期:2020-02-20
基金资助
国家自然科学基金项目(21871180)
上海市“科技创新行动计划”基础研究领域项目(18JC1413500)
上海高校特聘教授(东方学者)计划(SHDP201802)
上海市教委“曙光计划”(12SG12)
版权
Size Control and Biomedical Applications of ZIF-8 Nanoparticles
Received:23 Sept. 2019
Revised:26 Nov. 2019
Online:20 Feb. 2020
Fund
National Natural Science Foundation of China(21871180)
Shanghai Science and Technology Innovation Action Plan Basic Research Area Project(18JC1413500)
Shanghai University Distinguished Professor(Oriental Scholar) Program(SHDP201802)
Shanghai Municipal Education Commission “Dawning Plan”(12SG12)
Copyright
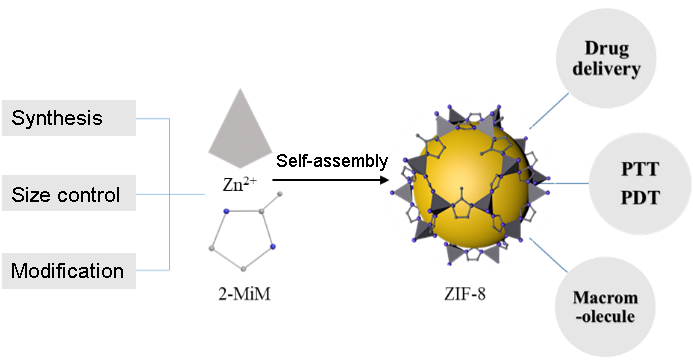
沸石咪唑酯骨架材料(Zeolitic Imidazolate Framework-8, ZIF-8)是由锌离子与2-甲基咪唑配位自组装成的多孔结晶材料,其比表面积大、孔隙率高、合成便捷、尺寸可控,在功能物质的包封与输运中具有突出的优势。与此同时,这类材料更具备优异的生物相容性,且其结构在生理条件下具有良好的稳定性,而在酸性条件下解体,对于与恶性肿瘤等多种疾病相关的弱酸性环境具有响应性,是控制药物运输与释放的理想载体,因而在生物医学上有很大的应用潜力。事实上,ZIF-8不但能高效负载阿霉素、5-氟尿嘧啶等小分子化疗药物,而且可以充当抗体、核酸等生物大分子的保护层。ZIF-8的粒径等性能对于相应的生物医学应用非常关键,而如何实现ZIF-8功能性的精准调控将是实现其生物医学应用的重要挑战,基于此,本文就ZIF-8的制备机理、性能调控及其生物医学应用进行综述和展望。
胡强强 , 郭和泽 , 窦红静 . ZIF-8纳米颗粒的粒径调控及生物医学应用[J]. 化学进展, 2020 , 32(5) : 656 -664 . DOI: 10.7536/PC190929
Qiangqiang Hu , Heze Guo , Hongjing Dou . Size Control and Biomedical Applications of ZIF-8 Nanoparticles[J]. Progress in Chemistry, 2020 , 32(5) : 656 -664 . DOI: 10.7536/PC190929
Zeolitic imidazolate framework-8(ZIF-8) is a class of porous crystalline materials formed by the self-assembly of zinc ions and 2-methylimidazole. It shows potential advantages in encapsulation and transportation of functional materials owing to its high porosity, large specific surface,convenient synthesis and controllable size. More importantly, ZIF-8 is an ideal carrier for drug delivery and release due to its excellent biocompatibility, stability under physiological conditions and responsiveness to the weak acidic environment associated with malignant tumors and other diseases. In fact, the small molecular drugs(doxorubicin, 5-fluorouracil) and biological macromolecules(antibody, nuclein) have all been loaded into ZIF-8 for chemotherapy, photothermal therapy, photodynamic therapy and biosensing. The particle size of ZIF-8 is very important for biomedical applications, and accurate functional regulation of ZIF-8 is agreat challenge for its biomedical application. Herein, we review the synthesis methods, size-control and biomedicalapplications of ZIF-8.
1 Introduction
2 Synthesis of ZIF-8 nanoparticles
2.1 Solvothermal process
2.2 Microwave-assist
2.3 Microfluidic
3 Size control of ZIF-8
3.1 Formation mechanism
3.2 Size control
4 Biomedical applications
4.1 Application in tumor treatment
4.2 Application in bioimagings
4.3 Protective coating for biomacromolecule
5 Conclusion and outlook
Key words: ZIF-8 ; synthetic mechanism ; size control ; acidic environmental responsivity ; biomedical application
图3 扩散理论下ZIF-8的结晶模型[19]Fig. 3 Theoretical basis of the reaction-diffusion framework(RDF). (A) Diffusion profiles of HmIm(outer) and Zn2+/Co2+(inner) are depicted at a given time. Evolution of the reaction zone is also shown and exhibits a decrease of its amplitude and broadening of its width. Xf denotes thelocation of the peak which also corresponds to the location of the precipitation front.(B) Nucleation of pure ZIF-8 leading to nanosperoids takesplace within the reaction zone[19]. Copyright 2018, American Chemical Society |
图6 CuS@ZIF-8在光照下解体的机理探究[37]Fig. 6 Possible mechanism for the dissociation of CuS@ZIF-8 NPs underthe laser irradiation (a). Cell viability of MCF-7 cells after 24 h incubation inthe presence of different concentrations of DOX or DOX loaded CuS@ZIF-8NPs(b). Cell viability of MCF-7 cells treated with PBS solution as a control,CuS@ZIF-8(25 mg·mL-1), DOX(1 mg·mL-1) or DOX loaded CuS@ZIF-8 NPs(1 mg·mL-1 of DOX, 4% DOX/NPs, w/w) for 12 h and then exposed to the NIR laser for 1, 2, 4, and 6 min(c). Photothermal images of mice, saline(control, group Ⅰ), DOX(group Ⅱ) and DOX loaded CuS@ZIF-8(group Ⅲ) under NIR laser irradiation for 3 min(d)[37]. Copyright 2016, The Royal Society of Chemistry |
图8 ZIF-8仿生矿化复合材料形成示意图[60]Fig. 8 Characterization of biomimetically mineralized biocomposite. (a) SEM image showing the crystals obtained using BSA as a growth agentfor biomimetic mineralization(scale bar, 1 μm).(b) Photograph and(c) confocal laser scanning microscopy image of the biomomimetically mineralized ZIF-8 composite obtained using BSA labelled with FITC. This biocomposite(ZIF-8/FITC-BSA) was prepared at 37 ℃, washed and exposed to ultraviolet light of wavelength 365 and 495 nm, respectively(scale bar, 10 μm).(d) PXRD of the MOF-BSA biocomposite.(e) FTIR spectra of BSA(red), ZIF-8/BSA(orange), standard ZIF-8 post incubated with BSA after washing(blue), and standard ZIF-8(black).(f) SAXS data of the ZIF-8/BSA biocompositeand a schematic showing the relative size of BSA to the mesopore.(g) Schematic proposing the biomimetically mineralized growthof ZIF-8. Each BSA molecule attracts 31 2-methylimidazole(HmIm) ligands and 22 Zn2+ ions, facilitating the nucleation of ZIF-8 crystals[60]. Copyright 2015, Springer Nature |
| [1] |
Echaide-G C, Clément C, Cacho-Bailo C, Téllez C, Coronas J. J. Mater. Chem. A, 2018,6:5485. http://xlink.rsc.org/?DOI=C8TA01232F
DOI: 10.1039/C8TA01232F |
| [2] |
Safaei M, Foroughi M M, Ebrahimpoor N, ShohrehJ,Omidi A, Khatami M. Trends in Analytical Chemistry, 2019,118:401. https://linkinghub.elsevier.com/retrieve/pii/S0165993619301840
|
| [3] |
Hoopa M, Waldea C F, Riccòc R, Mushtaqa F, Terzopouloua A, Chena X Z, deMellob A J, Doonand C J, Falcaroc P, Nelsona B J, Puigmartí-Luisb J, PanéaaInstitute S. Applied Materials Today, 2018,11:13. https://linkinghub.elsevier.com/retrieve/pii/S2352940717303839
|
| [4] |
Tanaka S, KidaK,Okita M, Ito Y, Miyake Y. Chem. Lett, 2012,41:1337. http://www.journal.csj.jp/doi/10.1246/cl.2012.1337
DOI: 10.1246/cl.2012.1337 |
| [5] |
Diring S, Furukawa S, Takashima Y, Tsuruoka T, Kitagawa S. Chem. Mater., 2010,22:4531. https://pubs.acs.org/doi/10.1021/cm101778g
DOI: 10.1021/cm101778g |
| [6] |
Chowdhuri A R, Das B, Kumar A, Tripathy S, Roy S, Kumar-Sahu S. Nanotecchnology, 2017,28:095102.
|
| [7] |
Chen Y, Tang S. J. Solid. State. Chem., 2019,276:68. https://linkinghub.elsevier.com/retrieve/pii/S0022459619302117
|
| [8] |
Rubio-Martinez M, Avci-Camur C, Thornton A W, Imaz I, Maspoch D, Hill M R. Chem. Soc. Rev., 2017,46:3453. http://xlink.rsc.org/?DOI=C7CS00109F
DOI: 10.1039/C7CS00109F |
| [9] |
Echaide-Górriz C, Clément C, Cacho-Bailo F, Téllez C, Coronas J. J. Mater. Chem. A, 2018,6:5485. http://xlink.rsc.org/?DOI=C8TA01232F
DOI: 10.1039/C8TA01232F |
| [10] |
Lee Y R, Jang M S, Cho H Y, Kwon H J, Kim S, Ahn W S. Chemical Engineering Journal, 2015,271:276. https://linkinghub.elsevier.com/retrieve/pii/S1385894715003034
|
| [11] |
Cravillon J, Münzer S, Lohmeier S J, Feldhoff A, Huber K, Wiebcke M. Chem. Mater., 2009,21:1410. https://pubs.acs.org/doi/10.1021/cm900166h
DOI: 10.1021/cm900166h |
| [12] |
Pan Y P, Liu Y Y, Zeng G F, Zhao L, Lai Z P. Chem. Commun., 2011,47:2071. http://xlink.rsc.org/?DOI=c0cc05002d
DOI: 10.1039/c0cc05002d |
| [13] |
Khan N A, Jhung S H. Coord. Chem. Rev., 2015,285:11. https://linkinghub.elsevier.com/retrieve/pii/S0010854514002811
|
| [14] |
Butova V V, Budnik A P, Bulanova E A, Soldatov A V. Mendeleev Commun., 2016,26:43. https://linkinghub.elsevier.com/retrieve/pii/S0959943616000183
|
| [15] |
Awadallah-F A, Hillman F, Al-Muhtaseb S A, Jeong H K. Dalton Trans., 2019,48:4685. http://xlink.rsc.org/?DOI=C9DT00222G
DOI: 10.1039/C9DT00222G |
| [16] |
Wang X G, Cheng Q, Yu Y, Zhang X Z. Angew. Chem. Int. Ed., 2018,57:7836. http://doi.wiley.com/10.1002/anie.v57.26
DOI: 10.1002/anie.v57.26 |
| [17] |
Yamamoto D, Maki T, Watanabe S, Tanaka H, Miyahara M T, Mae K. Chemical Engineering Journal, 2013,227:145. http://dx.doi.org/10.1016/j.cej.2012.08.065
DOI: 10.1016/j.cej.2012.08.065 2000 (transition state between laminar flow and turbulent flow), demonstrating the high mixing performance. Further, we systematically examined the effects of temperatures and [2-MeIM]/[Zn2+] ratios on the resultant ZIF-8 nanoparticles to elucidate the formation mechanism and to optimize the conditions for the synthesis of smaller ZIF-8 nanoparticles. Through a detailed analysis, we concluded that the requisite conditions for the preparation of smaller ZIF-8 nanoparticles are. lower temperatures and higher [2-MeIM]/[Zn2+] ratios, which affect the nucleation process and the particle growth process, respectively. Finally, we examined the adsorption properties of the resultant smaller ZIF-8 nanoparticles. We found that the amount of adsorbed N-2 gas for the ZIF-8 nanoparticles synthesized by our method is higher than the amount for a conventional ZIF-8 sample, and the adsorption rate is faster because of the nanocrystallization. (C) 2012 Elsevier B.V.]]> |
| [18] |
Van-Vleet M J, Weng T T, Li X Y, Schmidt J R. Chem. Rev. 2018,118:3681. https://pubs.acs.org/doi/10.1021/acs.chemrev.7b00582
|
| [19] |
Saliba D, Ammar M, Rammal M, Al-Ghoul M, Hmadeh M. J. Am. Chem. Soc., 2018,140:1812. https://pubs.acs.org/doi/10.1021/jacs.7b11589
DOI: 10.1021/jacs.7b11589 |
| [20] |
Sosso G C, Chen J, Cox S J, Fitzner M, Pedevilla P, Zen A, Michaelides A. Chem. Rev., 2016,116:7078. https://pubs.acs.org/doi/10.1021/acs.chemrev.5b00744
|
| [21] |
Karthika S, Radhakrishnan T K, Kalaichelvi P A. Cryst. Growth Des., 2016,16:6663. https://pubs.acs.org/doi/10.1021/acs.cgd.6b00794
|
| [22] |
Flügel E A, Ranft A, Haase F, Lotsch B V. J. Mater. Chem., 2012,22:10119. http://xlink.rsc.org/?DOI=c2jm15675j
DOI: 10.1039/c2jm15675j |
| [23] |
Rimer, J D, Tsapatsis, M J. MRS Bull., 2016,41:393. https://www.cambridge.org/core/product/identifier/S0883769416000890/type/journal_article
DOI: 10.1557/mrs.2016.89 |
| [24] |
Beha J J, Lima J K, Ngb E P, Onia B S. Mater. Chem. Phys., 2018,216:393. https://linkinghub.elsevier.com/retrieve/pii/S0254058418305212
|
| [25] |
Zhang Y Y, Jia Y, Li M, Hou L A. Sci. Rep., 2018,8:8597. https://doi.org/10.1038/s41598-018-26926-z
|
| [26] |
Pan Y C, Heryadi D D, Zhou F, Zhao L, Lestari G, Sub H, Lai Z P. CrystEngComm., 2011,13:6937. http://dx.doi.org/10.1039/c1ce05780d
DOI: 10.1039/c1ce05780d Herein we report a facile synthesis method using surfactant cetyltrimethylammonium bromide (CTAB) as a capping agent for controlling the crystal size and morphology of zeolitic imidazolate framework-8 (ZIF-8) crystals in aqueous systems. The particle sizes can be precisely adjusted from ca. 100 nm to 4 mu m, and the morphology can be changed from truncated cubic to rhombic dodecahedron. |
| [27] |
Nordin N A H M, Ismail A F, Mustafa A, Goh P S, Rana D, Matsuura T. RSC Adv., 2014,4:33292. http://xlink.rsc.org/?DOI=C4RA03593C
DOI: 10.1039/C4RA03593C |
| [28] |
Cravillon J, Nayuk R, Springer S, Feldhoff A, Huber K, Wiebcke M. Chem. Mater., 2011,23:2130. https://pubs.acs.org/doi/10.1021/cm103571y
DOI: 10.1021/cm103571y |
| [29] |
Zheng H Q, Zhang Y N, Liu L F, Wan W, Guo P, Nystroöm A M, Zou X D. J. Am. Chem. Soc., 2016,138:962. https://pubs.acs.org/doi/10.1021/jacs.5b11720
DOI: 10.1021/jacs.5b11720 |
| [30] |
Sun C Y, Qin C, Wang X L, Yang G S, Shao K Z, Lan Y Q, Su Z M, Huang P, Wang C G, Wang EB. Dalton Trans., 2012,41:6906. http://xlink.rsc.org/?DOI=c2dt30357d
DOI: 10.1039/c2dt30357d |
| [31] |
Zhang H Y, Li Q, Liu R L, Zhang X K, Li Z H, Luan Y X. Adv. Funct. Mater., 2018,28:1802830. http://doi.wiley.com/10.1002/adfm.v28.35
DOI: 10.1002/adfm.v28.35 |
| [32] |
Wang H H, Li T, Li J W, Tong W J, Gao C Y. Colloids and Surfaces A, 2019,568:224. https://linkinghub.elsevier.com/retrieve/pii/S0927775719301128
|
| [33] |
Zou Q, Huang J N, Zhang X J. Small, 2018,14:1803101. http://doi.wiley.com/10.1002/smll.v14.45
DOI: 10.1002/smll.v14.45 |
| [34] |
Zhao P H, Jin Z K, Chen Q, Yang T, Chen D Y, Meng Y, Lu X F, Gu Z, He Q J. Nat. Commun., 2018,9:1. http://www.nature.com/articles/s41467-017-02088-w
|
| [35] |
Wang W Q, Wang L, Li Y, Liu S, Xie Z G, Jing X B. Adv. Mater., 2016,28:9320. http://doi.wiley.com/10.1002/adma.201602997
|
| [36] |
Silva J S F, Silva J Y R, Sá G F, Araújo S S, Gomes-Filho M A, Ronconi C M, Santos CM, Júnior S. A. ACS Omega, 2018,3:12147.
|
| [37] |
Wang Z F, Tang X J, Wang X X, Yang D D, Yang C, Lou Y B, Chen J X, He N Y. Chem. Commun., 2016,52:12210. http://xlink.rsc.org/?DOI=C6CC06616J
DOI: 10.1039/C6CC06616J |
| [38] |
Li Y T, Jin J, Wang D W, Lv J W, Hou K, Liu Y L, Chen C Y, Tang Z Y. Nano Res., 2018,11(6):3294. https://doi.org/10.1007/s12274-017-1874-y
|
| [39] |
Yang J P, Shen D K, Zhou L, Li W, Li X M, Yao C, Wang R, El-Toni A M, Zhang F, Zhao D Y. Chem. Mater., 2013,25:3030. https://pubs.acs.org/doi/10.1021/cm401115b
DOI: 10.1021/cm401115b |
| [40] |
Zheng X H, Wang L, Pei Q, He S S, Liu S, Xie Z G. Chem. Mater., 2017,29:2374. https://pubs.acs.org/doi/10.1021/acs.chemmater.7b00228
|
| [41] |
He C B, Liu D M, Lin W B. Chem. Rev., 2015,115:11079. https://pubs.acs.org/doi/10.1021/acs.chemrev.5b00125
|
| [42] |
Zhen S J, Yi X B, Zhao Z J, Lou X D, Xia F, Tang B Z. Biomaterials, 2019,218:119330. https://linkinghub.elsevier.com/retrieve/pii/S0142961219304296
|
| [43] |
Lismont M, Dreesen L, Wuttke S J. Adv. Funct. Mater., 2017,27(14):1606314. http://doi.wiley.com/10.1002/adfm.v27.14
DOI: 10.1002/adfm.v27.14 |
| [44] |
Liu J, Yang Y, Zhu W, Yi X, Dong Z, Xu X, Chen M J. Biomaterials, 2016,97:1. https://linkinghub.elsevier.com/retrieve/pii/S0142961216301454
|
| [45] |
Kanofsky J R. Photochem. Photobiol., 2011,87:14. http://dx.doi.org/10.1111/j.1751-1097.2010.00855.x
DOI: 10.1111/j.1751-1097.2010.00855.x This article is a highlight of the paper by Jarvi et al. in this issue of Photochemistry and Photobiology as well as a brief overview of the state of the field of singlet-oxygen (O-1(2)) detection in vivo. The in vivo detection of O-1(2) using its characteristic 1270 nm phosphorescence is technically challenging. Nevertheless, substantial progress has been made in this area. Major advances have included the commercial development of photomultiplier tubes sensitive to 1270 nm light, techniques for spatially resolving the location of O-1(2) at a subcellular level and more complex mathematical models for interpreting the kinetics of O-1(2) emission from living cells. It is now recognized that oxygen consumption, photosensitizer bleaching, oxidation of biological molecules and diffusion of O-1(2) can significantly change the kinetics of O-1(2) emission from living cells. |
| [46] |
Xu D D, You Y Q, Zeng F Y, Wang Y, Liang C Y, Feng H H, Ma X. ACS Appl. Mater. Interfaces, 2018,10:15517. https://pubs.acs.org/doi/10.1021/acsami.8b03831
|
| [47] |
Ma Y C, Zhu Y H, Tang X F, Hang L F, Jiang W, Li M, Khan M I, You Y Z, Wang Y C. Biomater. Sci., 2019,7:2740. http://xlink.rsc.org/?DOI=C9BM00333A
DOI: 10.1039/C9BM00333A |
| [48] |
Zhang Y, Liu N, Su S, Jiang R, Li H. J NanosciNanotechno., 2020,20:2072.
|
| [49] |
Zhao G Z, Wu H H, Feng R L, Wang D D, Xu P P, Wang H B, Guo Z, Chen Q W. ACS Omega, 2018,3:9790. https://pubs.acs.org/doi/10.1021/acsomega.8b00923
|
| [50] |
Guo C, Xu S Y, Arshad A, Wang L Y. Chem. Commun., 2018,54:9853. http://xlink.rsc.org/?DOI=C8CC06129G
DOI: 10.1039/C8CC06129G |
| [51] |
Della Rocca J, Lin W B, . Eur. J Inorg. Chem. 2010,24:3725.
|
| [52] |
He M N, Zhou J J, Chen J, Zheng F C, Wang D D, Shi R H, Guo Z, Wang H B, Chen Q W. J. Mater. Chem. B, 2015,3:9033. http://xlink.rsc.org/?DOI=C5TB01830G
DOI: 10.1039/C5TB01830G |
| [53] |
Kong B, Zhu A W, Ding C Q, Zhao X M, Li B, Yang T. Adv. Mater., 2012,24:5844. http://doi.wiley.com/10.1002/adma.201202599
|
| [54] |
He L, Wang T T, An J P, Li X M, Zhang L Y, Li L, Li G Z, Wu X T, Su Z M, Wang C G. CrystEngComm, 2014,16:3259. http://dx.doi.org/10.1039/c3ce42506a
DOI: 10.1039/c3ce42506a A facile two-step method was developed to fabricate green fluorescent carbon nanodots@zeolitic imidazolate framework-8 nanoparticles (C-dots@ZIF-8 NPs) with tunable size and fluorescence intensity, which acted as platforms for simultaneous pH-responsive drug delivery and fluorescence imaging of cancer cells. |
| [55] |
Bian R X, Wang T T, Zhang L Y, Li L, Wang C G. Biomater. Sci., 2015,3:1270. http://xlink.rsc.org/?DOI=C5BM00186B
DOI: 10.1039/C5BM00186B |
| [56] |
Martin D A, Muth D A, Brown T, Johnson A J, Karabatsos N, Roehrig J T. J. Clin. Microbiol., 2000,38:1823. https://JCM.asm.org/content/38/5/1823
|
| [57] |
Best B. P. Rejuvenation Res., 2015,18:422.
|
| [58] |
Martin N, Ma D, Herbet A, Boquet D, Winnik F M, Tribet C. Biomacromolecules, 2014,15:2952. http://dx.doi.org/10.1021/bm5005756
DOI: 10.1021/bm5005756 |
| [59] |
Mitragotri S, Burke P A, Langer R J. Nat.Rev. Drug Discov., 2014,13:655.
|
| [60] |
Liang K, Ricco R, Doherty C M, Styles M J, Bell S, Kirby N, Mudie S, Haylock D, Hill A J, Doonan C J, Falcaro P. Nat. Commun., 2015,6:7240. https://doi.org/10.1038/ncomms8240
DOI: 10.1038/ncomms8240 |
| [61] |
Feng Y F, Wang H R, Zhang S N, Zhao Y, Gao J, Zheng Y Y, Zhao P, Zhang Z J, Zaworotko M J, Cheng P, Ma S Q, Chen Y.Adv. Mater., 2018,18:05148.
|
/
| 〈 |
|
〉 |