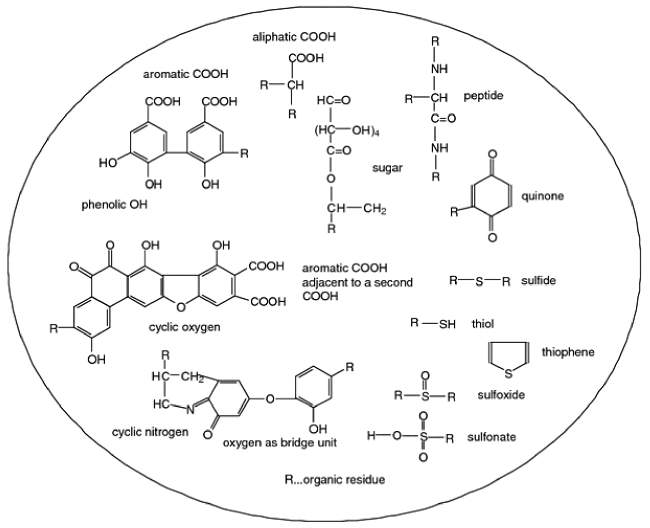
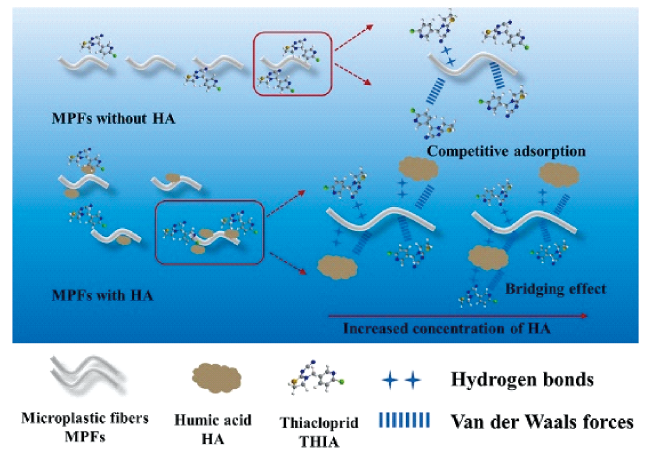
近年来,全球环境中残留抗生素的浓度和迁移转化命运已成为公众关注的热点问题
[96]。抗生素是一类具有特定化学结构和生物活性的化合物,通常可以杀死或抑制细菌的生长和繁殖
[102,103]。抗生素的使用会导致细菌产生抗药性,这是一种自然选择的结果,抗药性细菌可以在抗生素压力下生存并繁殖,从而形成新的病原菌株,对治疗造成更大的挑战。因此,探讨环境水体中HA与抗生素共存体系的相互作用至关重要。然而,环境共存体系较为复杂,反应条件和目标污染物种类的不同,可能导致实验结果存在较大差异。Antilen等
[102]和Urdiales等
[103]证明了HA大分子可有效吸附环境中残留的环丙沙星抗生素。Zhang等
[104]证明了HA与有机芳香结构之间的π-π共轭作用增强了土霉素从溶液中的去除效果。而Li等
[4]在研究中发现,HA与磺胺甲口恶唑(sulfamethoxazole, SMX)竞争降解体系过程中产生的·OH,导致SMX的降解效率下降。Yu等
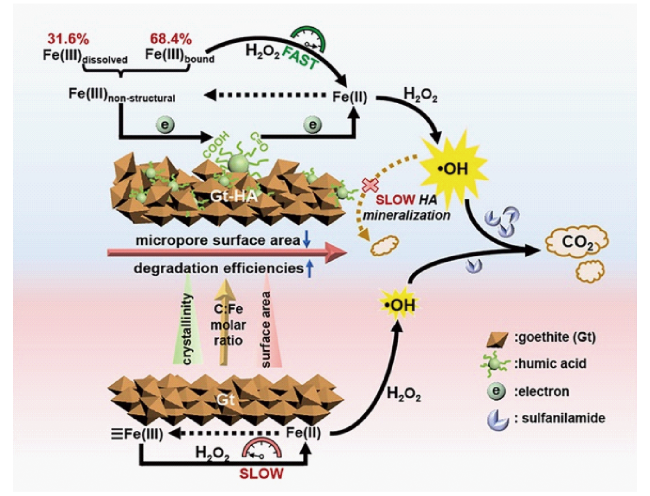
[61]采用生物法制备了不同C:Fe摩尔比的针铁矿与HA共沉淀物,并首次考察了其对H
2O
2的活化作用和催化降解磺胺的能力。如
图6所示,HA可以作为电子转移介质,促进Fe(Ⅲ)/Fe(Ⅱ)之间高效转化。针铁矿与HA共沉淀物具备较高的碳基稳定性和较低的微孔比表面积,降低了HA对·OH的竞争作用从而提高了磺胺的降解效率。另外,Niu等
[105]在诺氟沙星的光降解实验研究中发现,天然溶解性有机物在该反应过程中表现出双重作用,既能抑制
1O
2介导的氧化还原反应,又能增强脱氟途径。Zheng等
[106]关注了HA在“老化”过程中与四环素(tetracycline, TC)之间的相互作用关系。该研究在HA表面涂覆CaCO
3沉淀的方法模拟HA在自然环境中老化的过程。吸附动力学和等温线结果表明,未用CaCO
3改性的HA对TC的吸收速率更快,吸附容量更大,这意味着老化影响了TC从溶液到HA外表面以及从HA外表面再到其内部孔隙的传质过程。机理分析结果表明,HA携带的5种官能团促进了TC的吸附,对TC的结合亲合力依次为—COO > N—H > —C—C > C—O > O—H。其中,—COO是最敏感的吸附位点。而老化HA的—COO含量明显下降,这是老化HA对TC吸附容量下降的主要原因。Yang等
[96]在研究中也证实了HA的羧基官能团优先与TC相结合,对TC的去除有利。