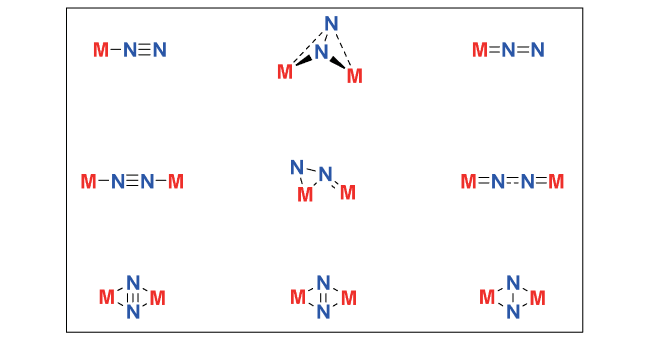
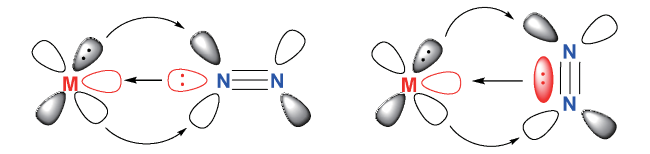
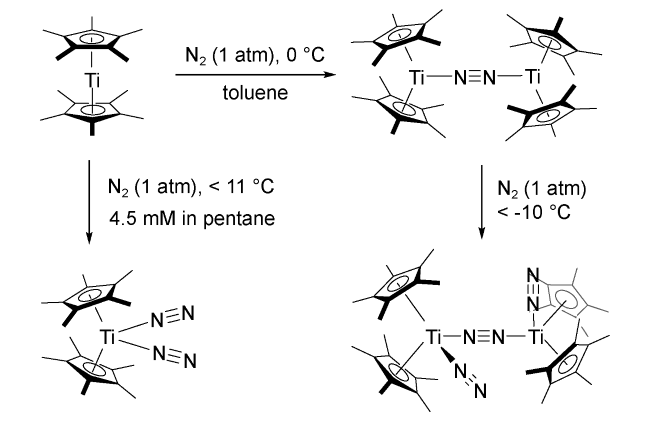
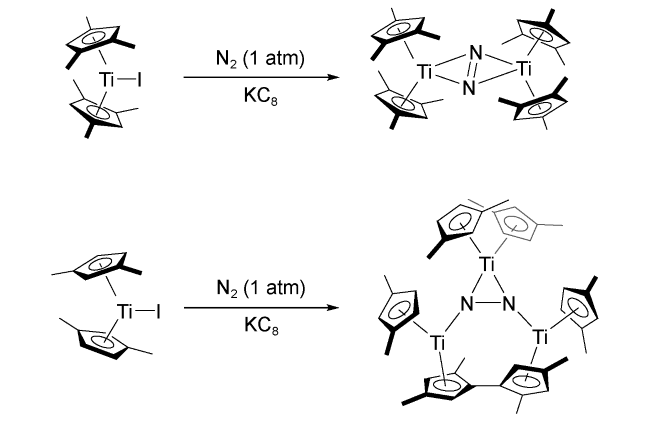
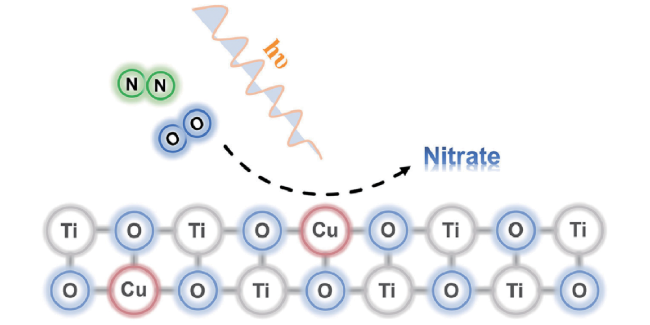
1 引言
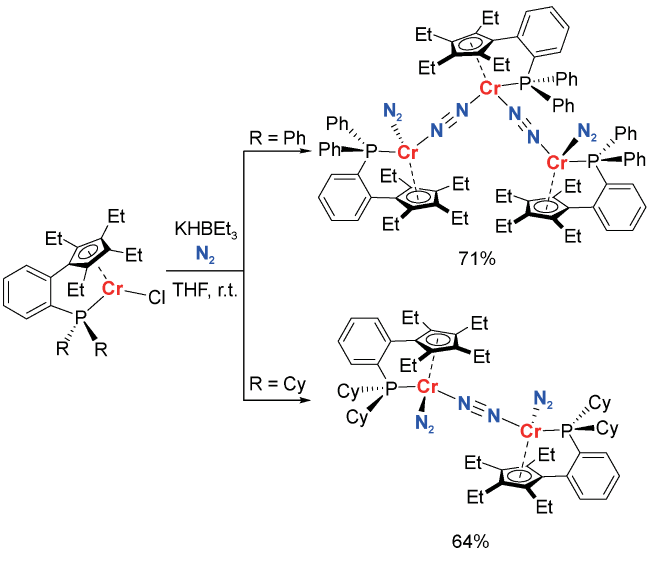
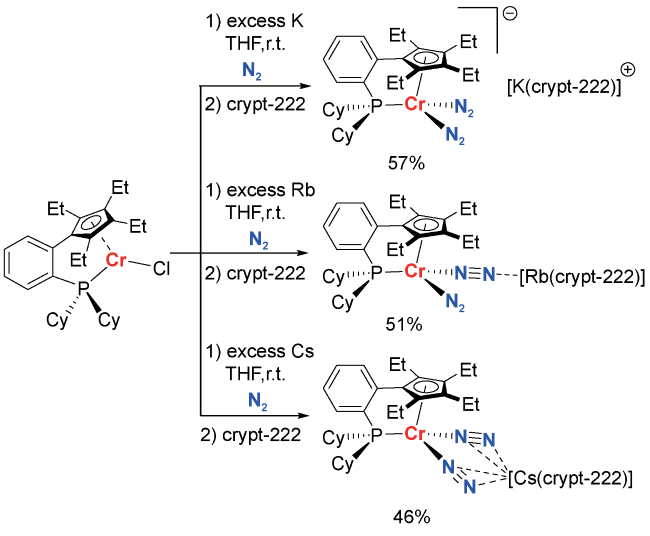
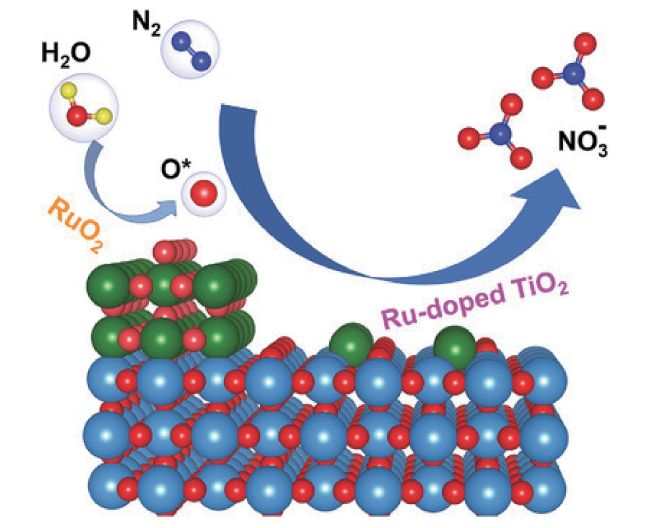
2 均相溶液体系固氮中的凝聚态化学
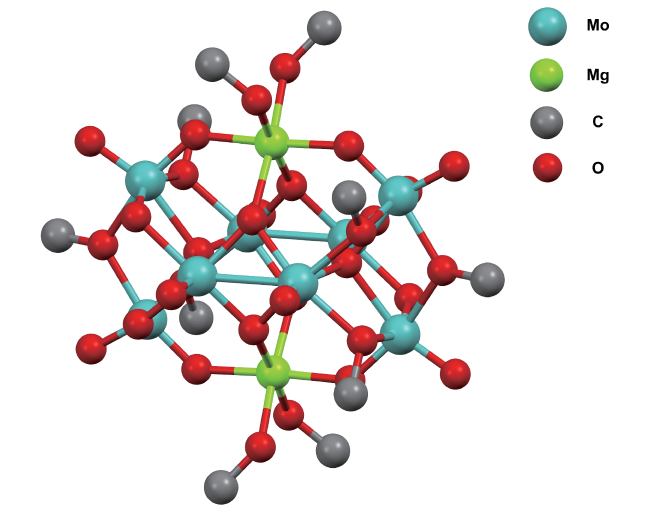
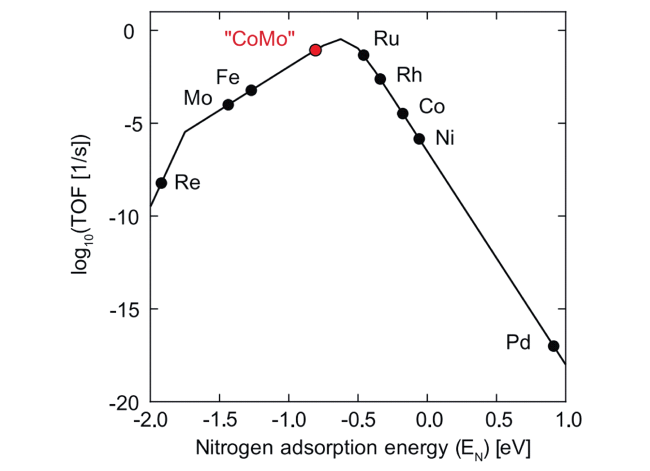
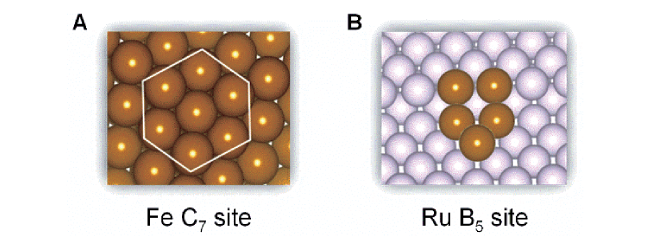
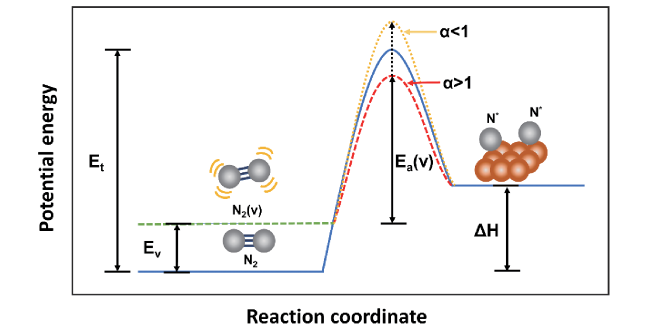
3 多相合成氨中的凝聚态化学
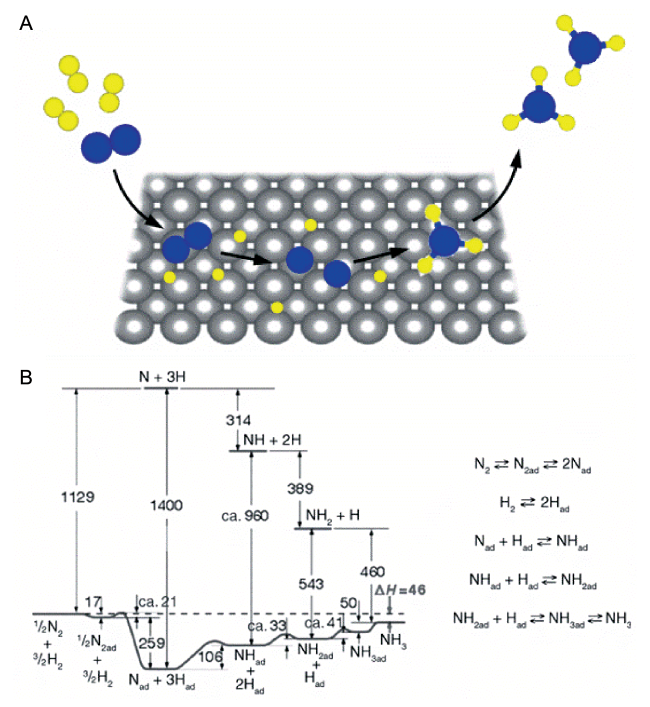
图4 (A)固体催化剂表面合成氨反应的直接解离式机理示意图;(B)金属Fe表面上合成氨反应势能图,能量单位为kJ·mol-1[37]Fig.4 (A) Schematic representation of ammonia synthesis on a solid surface via the dissociative mechanism; (B) potential energy diagram of ammonia synthesis on Fe surface. The energies are given in kJ·mol-1. Reprinted with permission[37]. Copyright John Wiley and Sons |