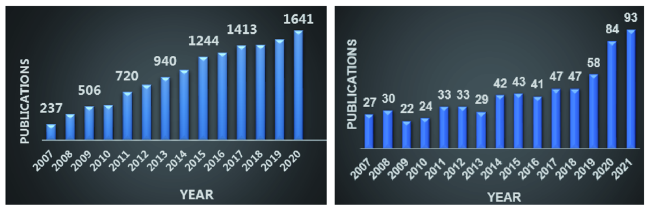
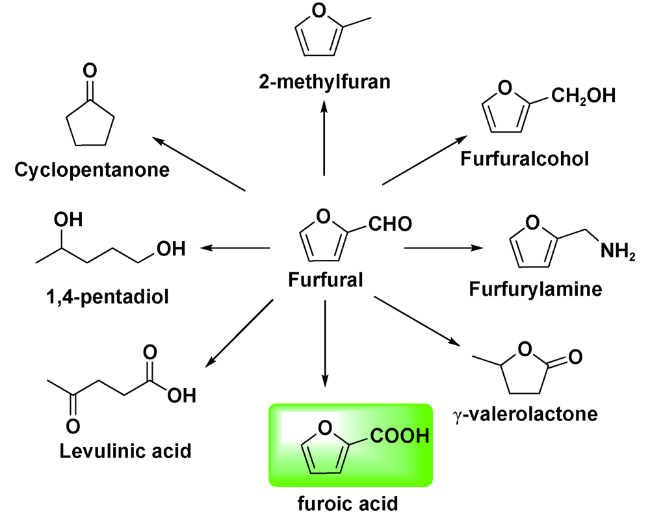
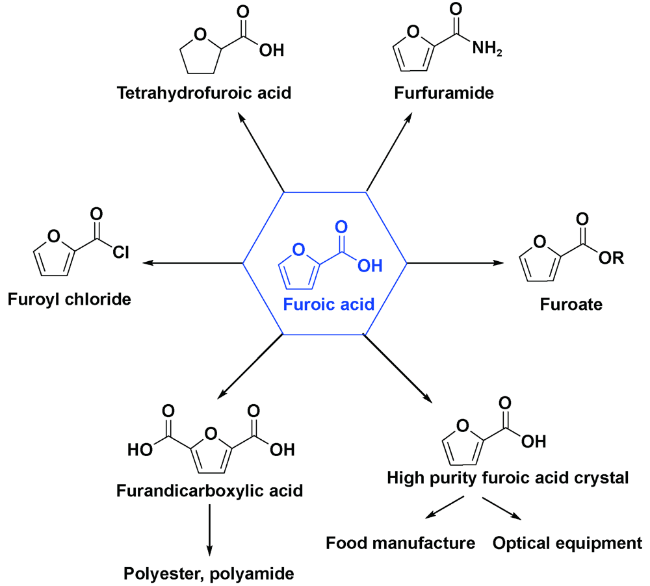
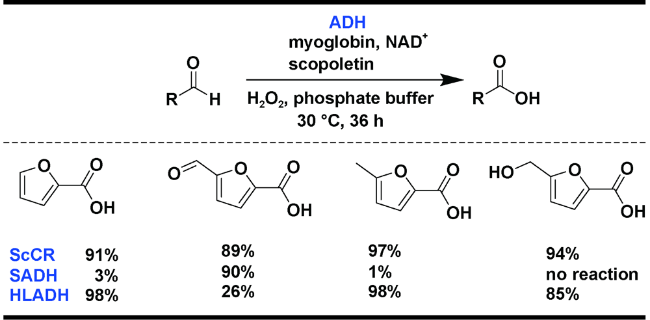
1 引言
2 催化氧化体系
2.1 均相氧化体系
表1 均相催化体系催化转化糠醛到糠酸反应汇总Table 1 Summary of catalytic conversion of furfural to furoic acid by homogeneous catalytic system |
| Entry | Catalyst | Reaction conditions | Furoic Acid Yield/% | ref |
|---|---|---|---|---|
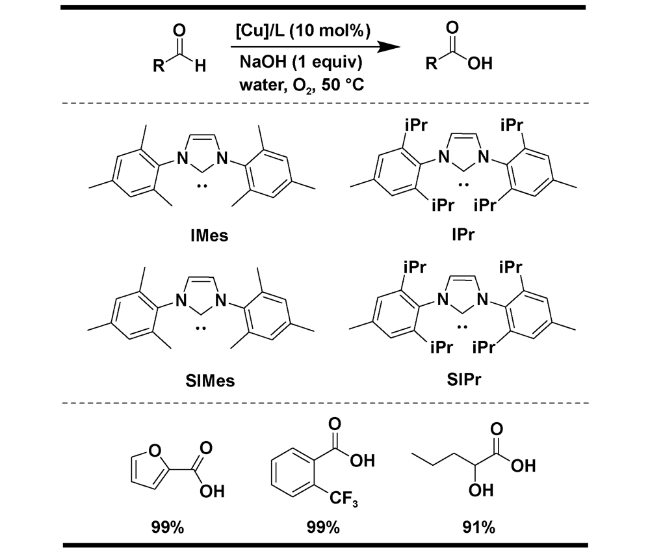
| 1 | [Cu(acac)2]/SIMes | H2O, 50 ℃, 1 atm O2, 1 eq NaOH, 12 h | 99 | 13 |
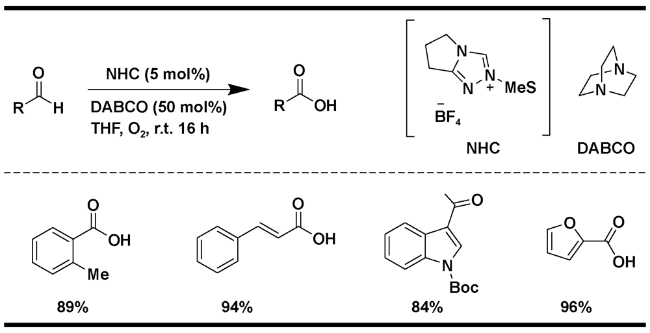
| 2 | triazolium-NHC | DABCO(50 mol%), O2, THF, r.t., 16 h | 96 | 15 |
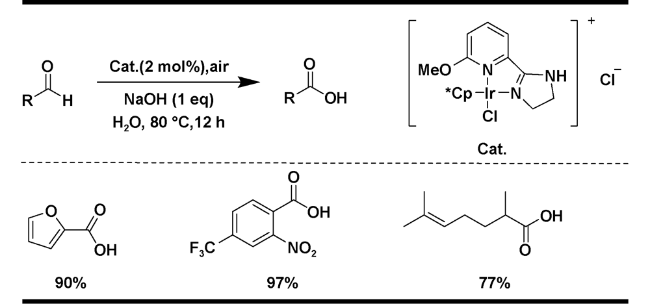
| 3 | 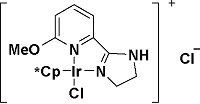 | NaOH (1 eq), H2O, air, 80 ℃, 12 h | 90 | 17 |
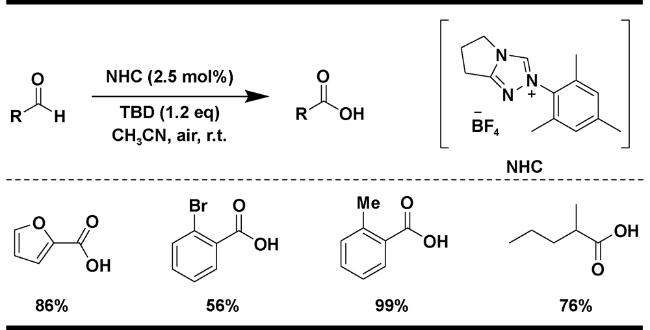
| 4 | 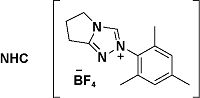 | MeCN, TBD(1.2 eq), air, r.t. | 86 | 17 |
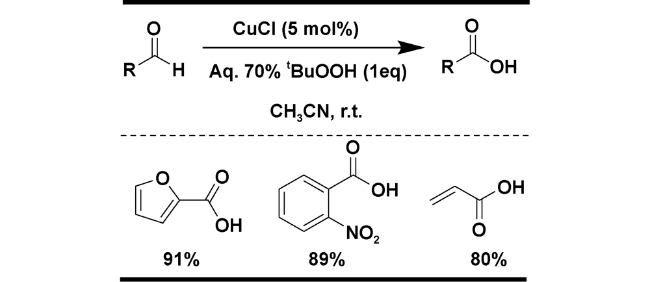
| 5 | CuCl | 2 equiv of 70% t-BuOOH (in water) in MeCN, r.t., 3 h | 91 | 18 |
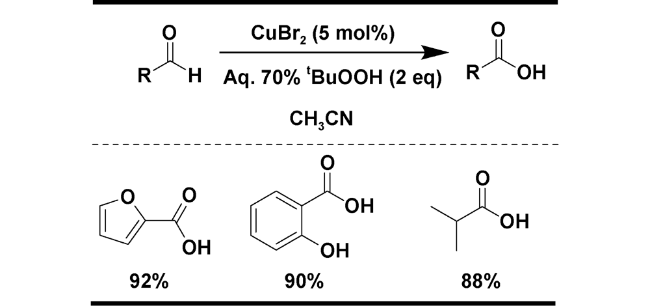
| 6 | CuBr2 | 2 equiv. t-BuOOH (water), MeCN, 1.5 h | 92 | 19 |
| 7 | Bi2O3 | 5 equiv. 70% t-BuOOH (water), EtOAc, 10 h | 91 | 20 |
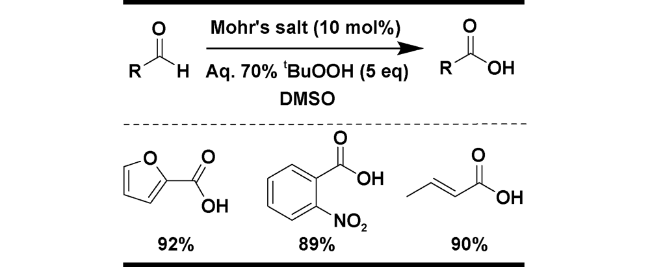
| 8 | Mohr’s salt | DMSO, 5 eq. 70% t-BuOOH, 80 ℃, 3.5 h | 92 | 21 |
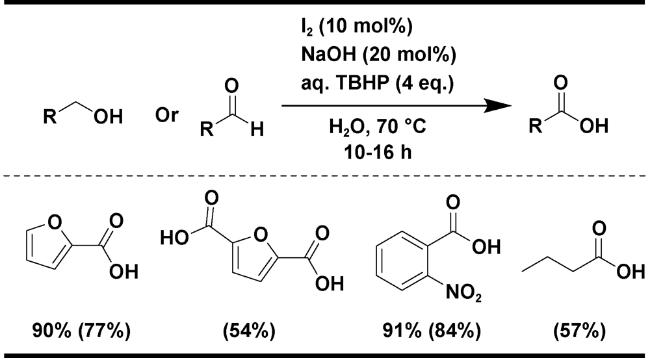
| 9 | I2 | NaOH (20 mol%), 4 equiv. t-BuOOH (water), H2O, 70 ℃, 10~16 h | 77 | 22 |
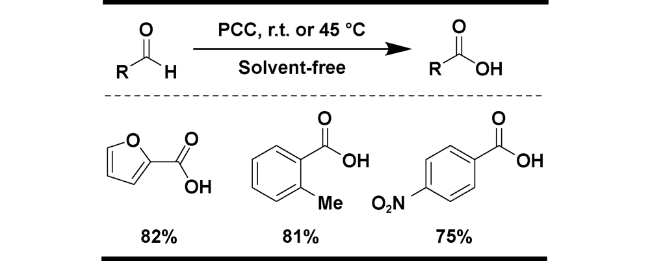
| 10 | PCC | Solvent-free, r.t. | 82 | 23 |
| 11 | Sodium chlorite | MeCN, 10 ℃-r.t., 3 h | 90 | 24 |
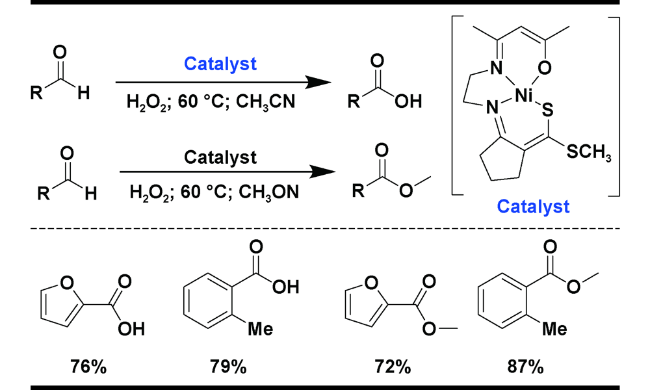
| 12 | 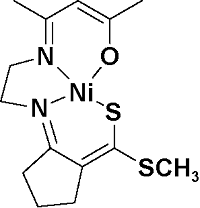 | H2O2; 60 ℃; CH3CN | 76 | 25 |
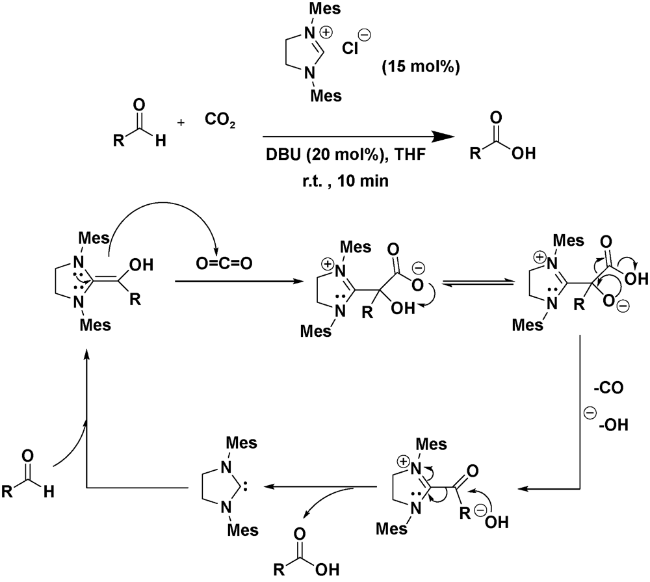
| 13 | 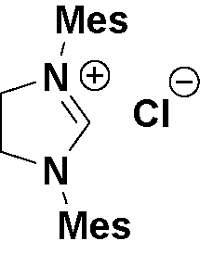 | CO2, DBU (20 mol%), THF, r.t., 10 min | 65 | 26 |
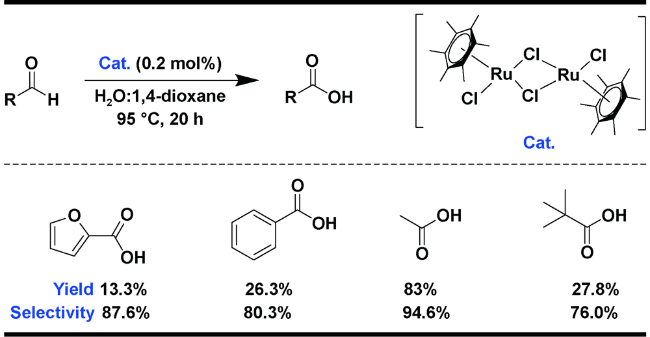
| 14 |  | H2O∶1,4-dioxane=50∶50, 95 ℃, 20 h | 13.3 | 27 |
2.1.1 氧气为氧化剂
2.1.2 空气为氧化剂
2.1.3 t-BuOOH为氧化剂
2.1.4 其他氧化剂
2.2 非均相氧化体系
表2 非均相催化体系催化转化糠醛到糠酸反应汇总Table 2 Summary of catalytic conversion of furfural to furoic acid by heterogeneous catalytic system |
| Entry | Catalyst | Reaction conditions | Furoic Acid Yield/% | ref |
|---|---|---|---|---|
| 1 | Au/ZTC | methanol, 6 bar O2, 120 ℃, 6 h | 90 | 28 |
| 2 | AuNPs/TiO2 | H2O, Na2CO3, 30 ℃, 8 h, UV/Uis | 92/96 | 29 |
| 3 | SiO2@Au@TiO2 | FF : Au ratio=100, 2 h, 24 bar air | 99 | 30 |
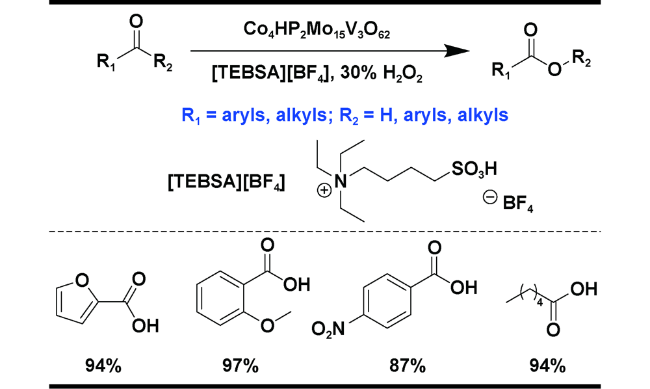
| 4 | Co4HP2Mo15V3O62 | [TEBSA][BF4], H2O2, r.t., 4 h | 94 | 31 |
| 5 | Co-N-C | H2O, 120 ℃, 1 MPa O2,1h | 96.7 | 32 |
| 6 | SiO2-Co(acac)2 SiO2-Co(acac)2 | 50 ℃, solvent-free, air, 5 h 70 ℃, H2O, air, 7.5 h | 85 180 | 33 |
| 7 | (NH4)4[CuMo6O18(OH)6] | H2O, 50 ℃, O2 balloon, 0.1 eq Na2CO3, 8 h | 99 | 34 |
| 8 | Ag2O/CuO | H2O, 70 ℃, 2 MPa O2, 1 h | 99 | 35 |
| 9 | CuO | NaOH, H2O, 65 ℃, air, 25 min | 91 | 36 |
| 10 | FeIIIMo6 | H2O, 50 ℃, 1 atm O2, 0.1 eq Na2CO3, 8 h | 97 | 37 |
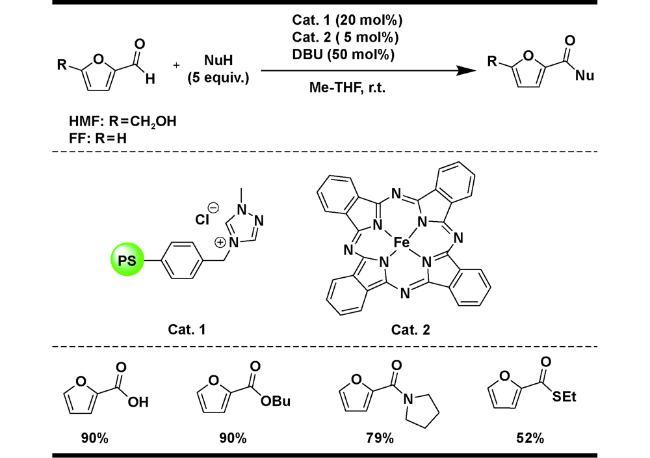
| 11 | 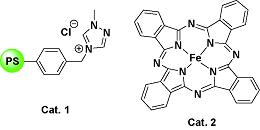 | DBU (50 mol%), anhydrous Me-THF, air, r.t. | 90 | 38 |
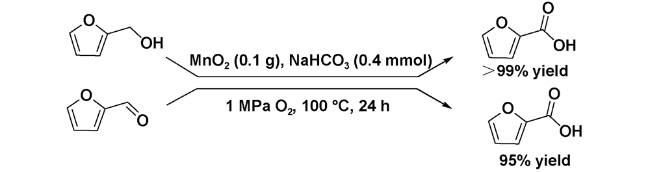
| 12 | MnO2 | H2O, NaHCO3, 1 MPa O2, 100 ℃, 24 h | 95 | 39 |
| 13 | Pd/C | Methanol-H2O, NaBH4, KOH, air, r.t. | 84 | 40 |
| 14 | [Ce(NH4)2(NO3)6] (CAN) | 1 eq. t-BuOOH (water), MeCN, r.t., 15 min | 93 | 41 |
| 15 | β- Cyclodextrin | 50 ℃, H2O2, 1 h | 97(conversion) | 42 |
| 16 | VO(acac)2-TiO2 (TSV) | H2O2, MeCN, r.t., 4 h | 86 | 43 |
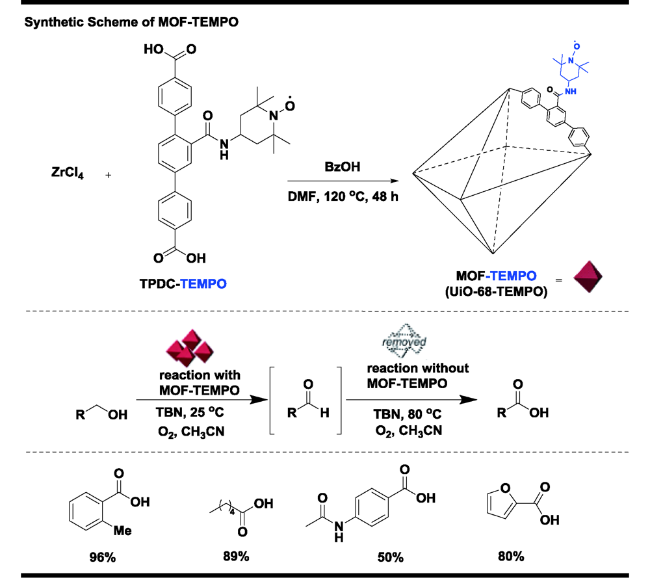
| 17 | MOF-TEMPO | 1) 5 mol% catalyst, 20 mol% TBN, CH3CN, O2, 25 ℃, 2 h;2) the filtration of catalyst and additional stirring under O2 balloon at 80 ℃ for 10 h | 80 | 44 |