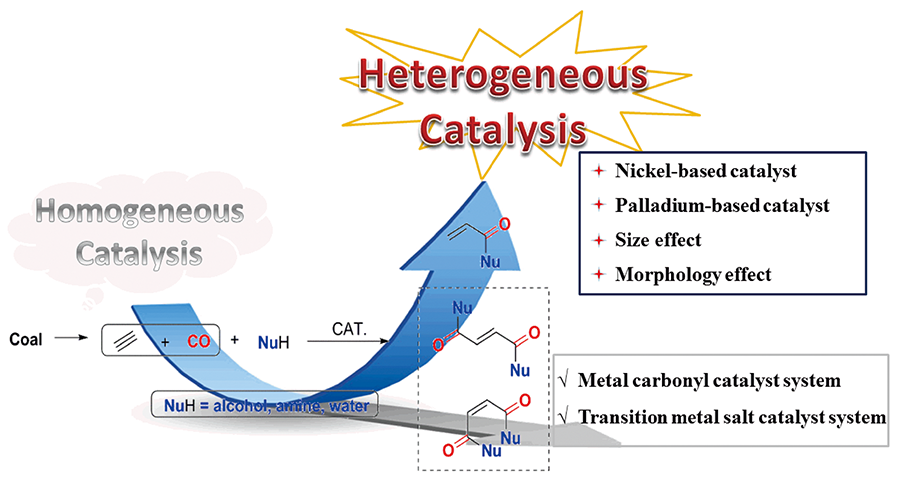
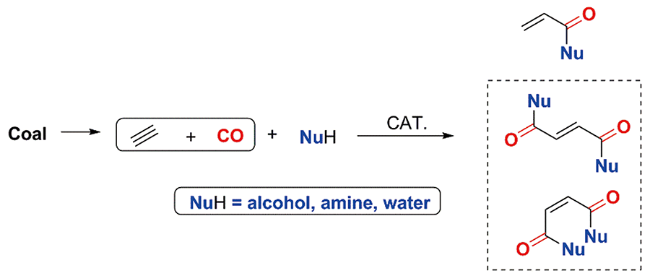
1 引言
2 乙炔羰基化均相催化体系
2.1 羰基金属均相催化体系
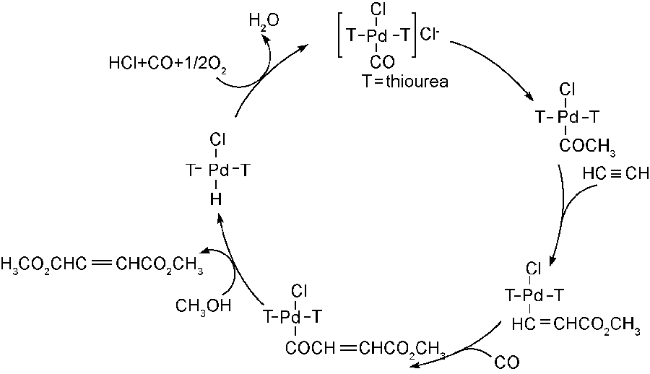
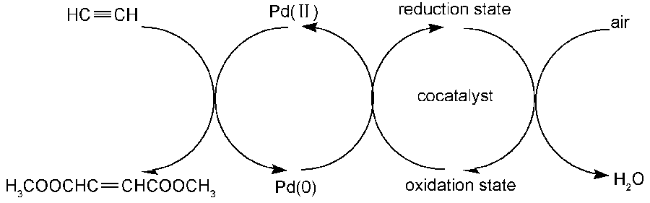
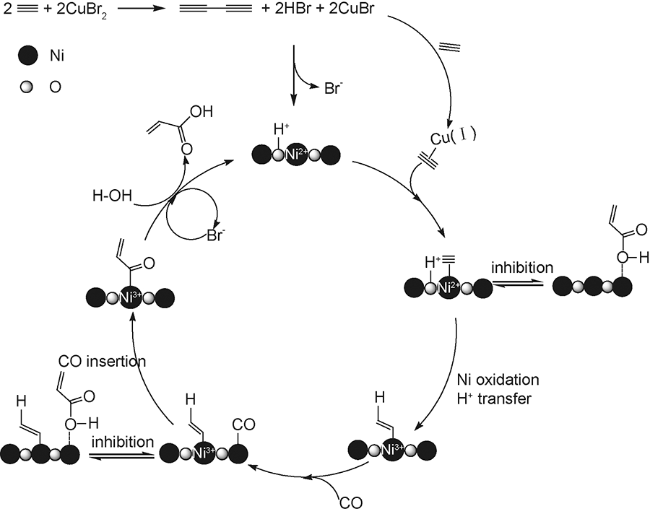
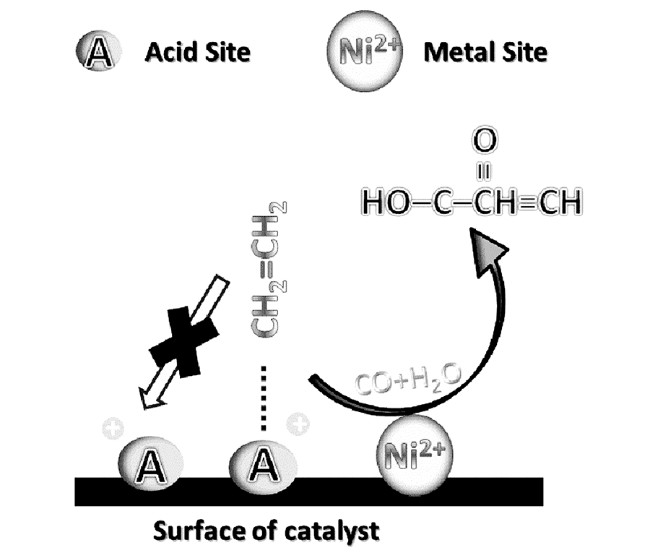
2.2 过渡金属盐均相催化体系
表1 钯基均相催化炔烃羰化反应活性Table 1 Palladium-based homogeneous catalytic carbonylation of alkynes |
| Entry | Catalyst | T (℃) | P (MPa) | Yield (%) | ref |
|---|---|---|---|---|---|
| 1 | Pd/Cl2 | 100 | 9.8 | 38.5 | 23 |
| 2 | Pd(OAc)2-diphenyl-2- pyridylphosphine | 50 | 5 | 85.0 | 24 |
| 3 | PdCl2-HgCl2 | -20 | 0.1 | 96.0 | 25 |
| 4 | PdCl2-SnCl2 | r.t | > 0.1 | 100 | 26 |
| 5 | PdCl2-thiourea | 20 | 0.1 | 90 | 28 |
| 6 | PdCl2/CuCl2/ HCl/O2 | r.t | 0.1 | Eq. | 29 |
| 7 | PdCl2/FeCl3/ H2SO4/O2 | 35 | 0.004 | 47.8 | 30 |
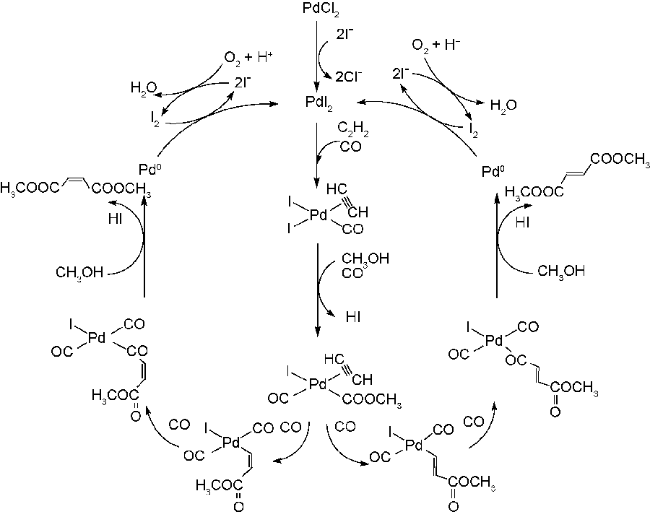
| 8 | PdI2/KI/Air | 60 | 3.0 | 92 | 31 |
| 9 | Pd(OAc)2/HQ-Cl/ NPMoV/O2 | 25 | 0.1 | 85 | 32 |
| 10 | Pd(xantphos)Cl2 | 25 | 0.1 | 97 | 33 |
| 11 | PdX2-HY-Ox-O2 | 25 | 0.1 | 100 | 35 |
| 12 | PdBr2-LiBr | 25 | 0.1 | 94.9 | 37 |