1 引言
2 基于siRNA的RNA干扰调控靶点
2.1 ATP结合盒转运体
2.2 与凋亡相关的蛋白
2.3 其他靶点
3 共负载siRNA和化疗药物的纳米载体
3.1 介孔二氧化硅纳米载体
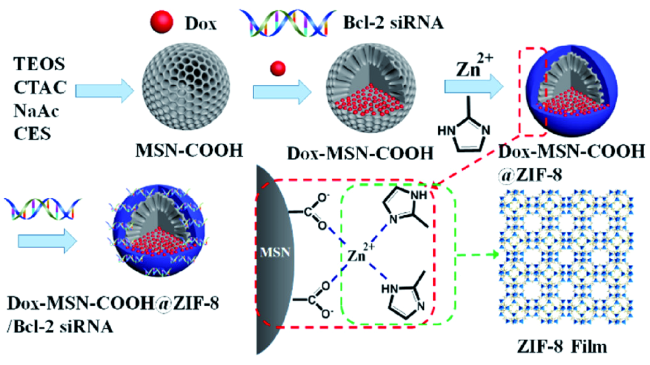
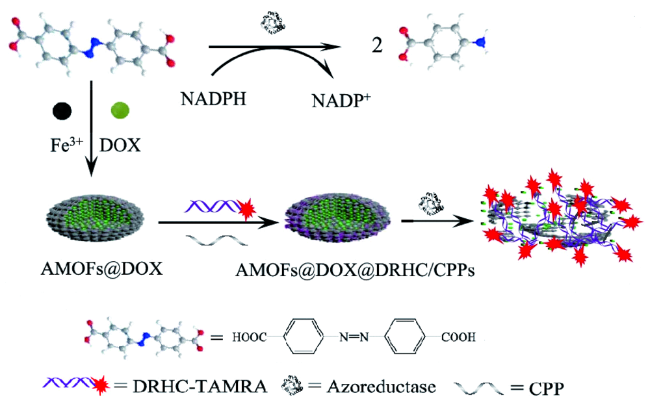
3.2 金属有机框架
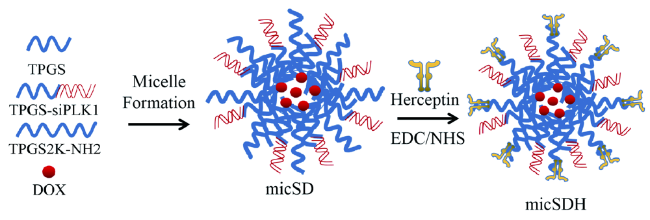
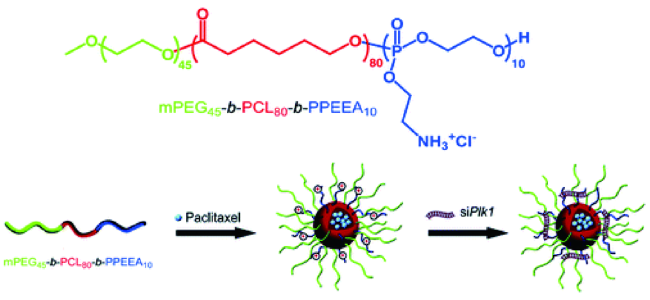
3.3 聚合物胶束
3.4 脂质体/囊泡
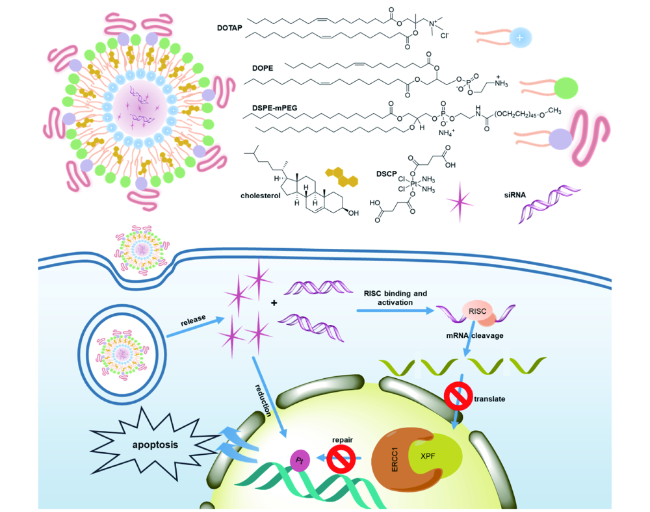
图5 自组装脂质纳米粒共同递送Pt(Ⅳ)前药-DSCP和靶向XPF的siRNA的示意图。释放出DSCP破坏DNA的同时携带siRNA到细胞中,特异性下调XPF mRNA和蛋白质表达,从而增强铂类药物的作用[83]Fig. 5 Schematic view of our design to co-deliver the Pt(Ⅳ) prodrug DSCP and XPF-targeted siRNA using self-assembled lipid nanoparticles. Cisplatin prodrug DSCP is released and activated to damage DNA. At the same time, siRNA is carried into cells and specifically down-regulates both mRNA and protein levels of endonuclease XPF to prevent the repair of Pt-DNA damage to potentiate the platinum drug[83].Copyright 2019, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim |
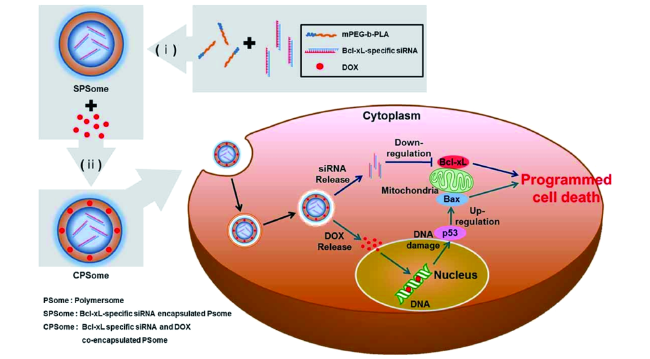
图6 使用可生物降解PSomes来递送Bcl-xL siRNA和DOX的共递送系统的示意图.(i)Bcl-xL-siRNA直接包埋在PSomes(SPSomes)中;(ii)然后通过疏水作用将DOX装入SPSomes的壳中形成CPSomes[93]Fig. 6 Schematic illustration of the co-delivery system using biodegradable PSomes to deliver Bcl-xL siRNA and DOX.(i) Bcl-xL siRNA is directly encapsulated into PSomes(SPSomes).(ii) DOX is then loaded into the shell of SPSomes through hydrophobic interaction to form CPSomes[93]. Copyright 2013, WILEY-VCH Verlag GmbH & Co |
3.5 树状大分子
3.6 层层组装纳米粒子
3.7 透明质酸纳米系统
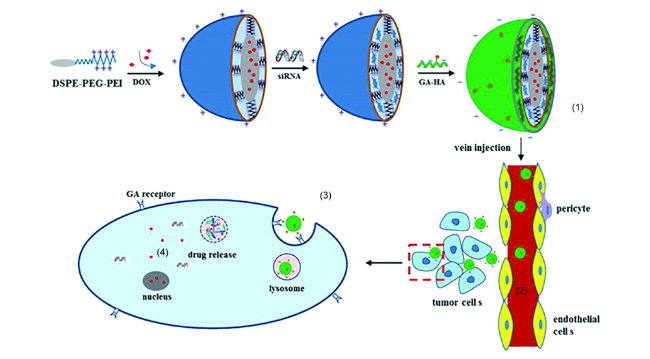
图8 siRNA/DOX/GH-DPP纳米粒制备以及在体内循环及细胞内作用示意图.(1)siRNA/DOX/GH-DPP纳米粒的制备(2)经血液循环,肝靶向药物传递(3)细胞摄取(4)pH触发的Bcl-2 siRNA和DOX释放[101]Fig. 8 Schematic illustration of (1)preparation of siRNA/DOX/GH-DPP nanoparticles(2)liver-targeted drug delivery via blood cycle(3)cellular uptake(4)pH-triggered release of Bcl-2 siRNA and DOX[101]. Copyright 2019 |
3.8 小结
表1 共负载siRNA和化疗药物纳米体系汇总表Table 1 Summary of co-loaded siRNA and chemotherapeutic drug nanosystems |
| Materials for surface modification | Drug | siRNA | Substances with targeting effect | Release conditions | References | Advantages of carrier | Deficiency of carrier | |
|---|---|---|---|---|---|---|---|---|
| MSN | PEI-PEG | DOX | P-gp、Bcl-2、c-Myc、PXR | - | Acidic | 56 | Biological stability; Low toxicity; Biodegradable;Modifiability;High porosity; Uniform and adjustable aperture; Better load capacity | Risk of hemolysis; Complicated preparation |
| ZIF-8 | DOX | Bcl-2 | - | Lysosome | 57 | |||
| PEG | DOX | T-type Ca2+ channel | - | Acidic | 58 | |||
| S-S bond、PAE | DOX | P-gp | - | Reductive(GSH) | 59 | |||
| PEI | DOX | P-gp | - | Reductive(GSH) | 62 | |||
| CA | PTX DTX | AKT ERBB2 | - | Acidic | 63 | |||
| LDHs | Se | P-gp β-tubulin Ⅲ | - | Biodegradation | 65 | |||
| Ca/P/Liposome | DTX | GRP78 | RGD | Biodegradation | 36 | |||
| MOF | UiO | DPP | P-gp、Bcl-2 Survivin | - | Phosphate | 68 | Biodegradable; High porosity; Large specific surface area; Better load capacity; self-assembly | Poor biocompatibility; poor drug release propertie |
| MIL-101 | Se、Ru | P-gp | - | Biodegradation | 69 | |||
| AMOFS | DOX | HIF-1α | CPPS | Azoreduction | 70 | |||
| Polym ericmi celles | LDL NSC-SS-UA | PTX | BCRP | LDL | Reductive (GSH)、Acidic | 71 | High stability in vivo; Controlled drug release; Functional design | Poor storage stability; Toxicity; Prepared by chemical reaction |
| TPGS | DTX | PLK1 | Herceptin | Reductive (GSH)、Acidic | 72 | |||
| HA-ss-(OA-g-bPEI) | PTX | AURKA | HA | Reductive(GSH) | 73 | |||
| C18-N DSPE-PEG2000 | DOX | PLK1 | - | Acidic | 74 | |||
| DPA+PEI | PTX | Akt | - | Acidic | 75 | |||
| mPEG45-b-PCL80-b-PPEEA | PTX | PLK1 | - | Biodegradation | 76 | |||
| Liposome/ Niosome | DOTAP、CHOL DSPE-mPEG DPPC | PTX | GAPDH | - | Biodegradation | 78 | Easy assembly; High entrapment efficiency; Narrow size distribution; Controlled drug release | Poor storage stability; High-cost |
| DOTAP、CHOLDSPE- mPEG DOPE | DSCP | XPF | - | Acidic | 79 | |||
| PRTM、DOPE DDCTMA | PTX | survivin | - | Biodegradation | 80 | |||
| PRTM、DOTAP CHOL | Gem | Mcl-1 | - | Biodegradation | 81 | |||
| mPEG-PLGA EPL、PEG | Gem | HIF-1a | - | Biodegradation | 82 | |||
| LHSSG2C14 SPC、CHOL | PTX | Survivin | - | Reductive(GSH) | 83 | |||
| PRTM、DOPE CHOL | DOX | Fab | - | Biodegradation | 84 | |||
| EDOPC | PTX | Mcl-1 | - | Biodegradation | 86 | |||
| LDL、DOPE CHOLDSPE-PEG | PTX | Bcl-2 | - | Biodegradation | 87 | |||
| Span80、DOTAP | DOX | Bcl-2 BCRP | - | Biodegradation | 88 | |||
| mPEG-b-PLA | DOX | Bcl-xl | - | Biodegradation | 89 | |||
| Dendrimer | Fol-PEG-GUG-β-CDE | DOX | PLK1 | FA | Acidic | 92 | Structural uniformity; Easily attached | Toxicity; Complicated preparation |
| LbL | AuNP | IM | STAT3 | - | Biodegradation | 94 | Modular design; Modifiability; Controlled drug release; | Poor bearing capacity; Less available materials |
| PLA、HA | DOX | MRP1 | HA | Biodegradation | 95 | |||
| HA | CaP、DPA/ZnHA-CA | DOX | P-gp | HA | Acidic | 96 | Biocompatibility; Targetability; Modifiability; High degradability; | Poor bearing capacity; Uncontrolled drug release |
| DSPE-PEG-PEIGA-HA | DOX | Bcl-2 | GA-HA | Acidic | 97 |
表2 缩略语表Table 2 List of abbreviation |
| Abbreviation | full name | Abbreviation | full name |
|---|---|---|---|
| MDR | multi-drug resistence (多药耐药) | DSCP | disuccinatocisplatin (琥珀酸顺铂) |
| P-gp | P-glycoprotein (P-糖蛋白) | IM | imatinib mesylate (甲磺酸伊马替尼) |
| MRP1 | multidrug resistance-associated protein 1 (多药耐药相关蛋白1) | GST | glutathione S-transferase (谷胱甘肽巯基转移酶) |
| BCRP | breast cancer resistance protein (乳腺癌耐药蛋白) | MGMT | O6-methyguanine-DNA methytransferase (O6-甲基鸟嘌呤-DNA-甲基转移酶) |
| Bcl-2 | B-cell lymphoma-2 (B淋巴细胞瘤-2基因) | RRM2 | ribonucleotide reductase M2 (核糖核苷酸还原酶M2) |
| Mcl-1 | myeloid cell leukemia 1 (一种凋亡调控基因) | GAPDH | glyceraldehyde-3-phosphate Dehydrogenase (甘油醛-3-磷酸脱氢酶) |
| PLK1 | Polo-like Kinase 1 (Polo样蛋白质激酶1) | HIF-1 | hypoxia-inducible factor-1 (缺氧诱导因子1) |
| EPR 效应 | enhanced permeability and retention effect (高渗透长滞留效应) | c-Myc | 一种可使细胞无限增殖的基因 |
| RES 系统 | reticuloendothelial system (网状内皮系统) | MSN | mesoporous Silica Nanoparticles (介孔二氧化硅) |
| CPPs | cell penetrating peptide (细胞穿透肽) | MON | mesoporous Organosilica Nanoparticles (介孔有机二氧化硅) |
| LDL | low-density Lipoprotein (低密度脂蛋白) | MOF | metal-Organic Frameworks (金属有机框架) |
| PXR | pregnane X receptor (孕烷X受体) | DPA | dipicolylamine (二甲基吡啶胺) |
| PAE | poly (β-amino esters) (聚β-氨基酯) | PRTM | protamine (鱼精蛋白) |
| DPPC | 1,2-Dihexadecanoyl-rac-glycer0-3-phosp (二棕榈酰磷脂酰胆碱) | EPL | ε-polylysine (ε-聚赖氨酸) |
| DOTAP | N-[1-(2,3-dioleyloxy)proply]-N,N, N-trimethylammonium chloridep (1,2-二油酰-3-三甲基丙烷基氯化铵) | DOPE | dioleoyl Phosphoethanolamine (二油酰基磷脂酰乙醇胺) |
| XPF | xeroderma pigmentosum complementation group F (F组着色性干皮病偶联因子重组蛋白) | DSPE | 1,2-distearoyl-sn-glycero-3-phosphoethanolamine (二硬脂酰基磷脂酰乙醇胺) |