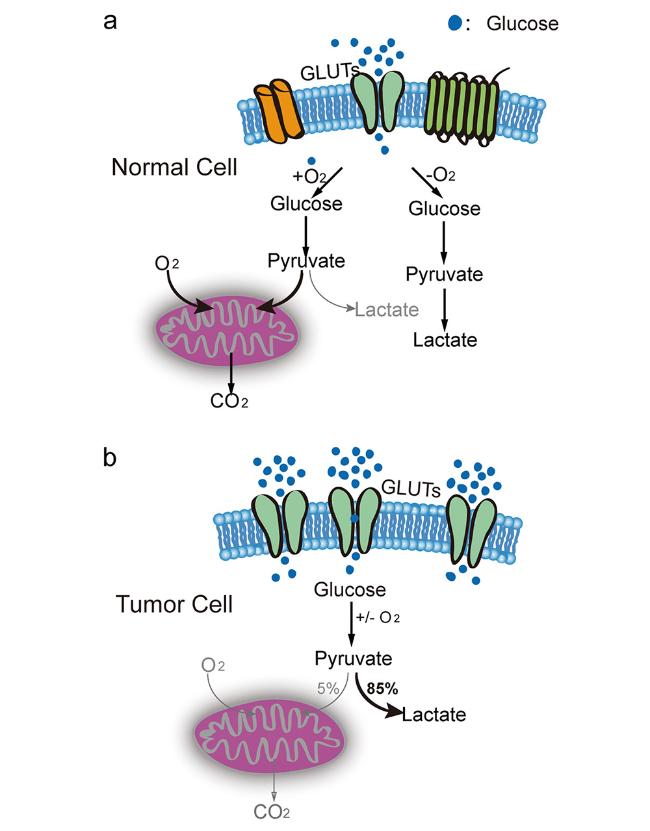
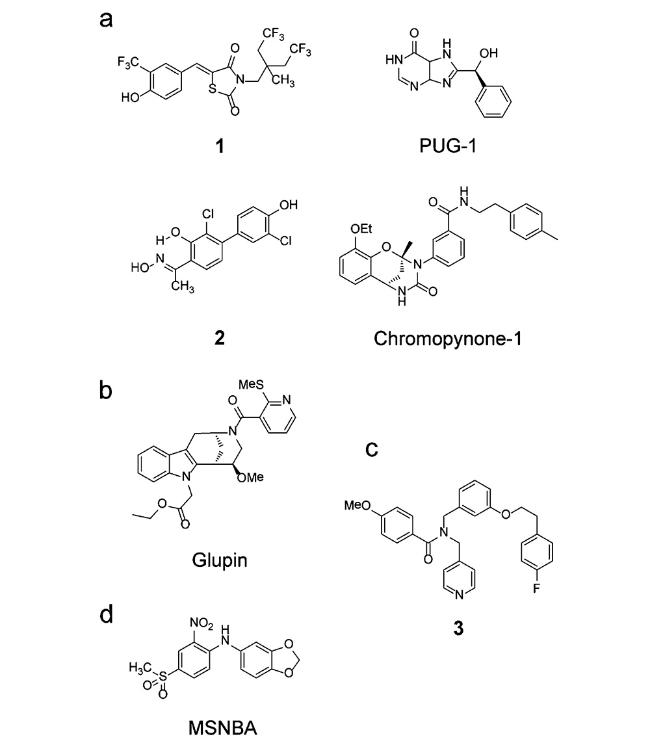
目前,许多具有抗肿瘤活性的GLUTs小分子抑制剂正处于临床前开发阶段(如
图3)。2008年,Yang等
[38]发现噻唑烷二酮过氧化物酶增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)激动剂可以有效阻止葡萄糖的吸收,具有良好的抗肿瘤活性。随后,Wang等
[39]在这个受体激动剂的基础上进行结构衍生与修饰,设计并合成了30个化合物,经过针对前列腺癌细胞(LNCaP细胞)的体外抗肿瘤活性测试,发现化合物1对LNCaP细胞表现出更强的葡萄糖摄取抑制作用(IC
50=2.5 μM),且对正常前列腺上皮细胞和正常乳腺上皮细胞没有产生明显的毒性。通过分子对接分析发现化合物1对葡萄糖的抑制作用归因于与GLUT1的选择性结合,因此被认为是一种有效的GLUT1抑制剂。2016年,Ung等
[40]基于大肠杆菌木糖转运蛋白(
E. coli xylose transporter,XyIE)的X射线晶体结构,构建了人GLUT1(human GLUT1,hGLUT1)同源模型。通过与已确定的hGLUT1晶体结构对比,发现了葡萄糖结合位点旁边存在一个疏水口袋。计算机辅助虚拟筛选研究最终发现了7种新的GLUT1配体(IC
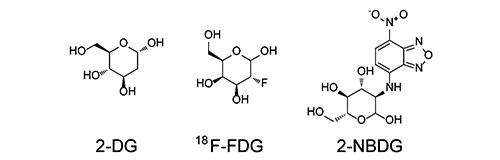
50=0.45~59 μM),并利用高表达hGLUT1的中国仓鼠乳腺细胞(Chinese hamster ovary,CHO)进行2-脱氧-D-葡萄糖(2-deoxy-D-glucose,2-DG)吸收实验,发现化合物PUG-1作为GLUT1抑制剂能显著抑制2-DG的吸收(IC
50=0.45 μM)。Granchi等
[41]利用四芳基取代的水杨酮肟结构骨架合成了一系列对肺癌细胞有明显抑制作用的化合物,其中,化合物2抑制肺癌细胞(A549)的活性最好(IC
50=7.0 μM),优于同类型的其他GLUT1抑制剂。随后通过荧光显微镜观察到,化合物2处理后的A549癌细胞对GLUT1荧光底物2-(
N-7-硝基-2,1,3-苯并口恶二唑-4-氨基)-2-脱氧-D-葡萄糖(2-(
N-(7-nitrobenz-2-oxa-1,3-diazol-4-yl)amino)-2-deoxyglucose,2-NBDG)的吸收明显减少(下降约38%)。2018年,Karageorgis等
[42]将色原烷和四氢嘧啶酮进行生物定向合成(biology-oriented synthesis,BIOS),制备了一种新型靶向GLUT1和GLUT3的抑制剂Chromopynone-1,并发现它能有效抑制胰腺癌细胞(MIA PaCa-2)和结肠癌细胞(HCT116)的生长。2019年,Ceballos等
[43]也基于吲哚胺类天然产物的母核结构,衍生合成了一种靶向GLUT1和GLUT3的抑制剂Glupin,证实能够有效抑制乳腺癌细胞生长。