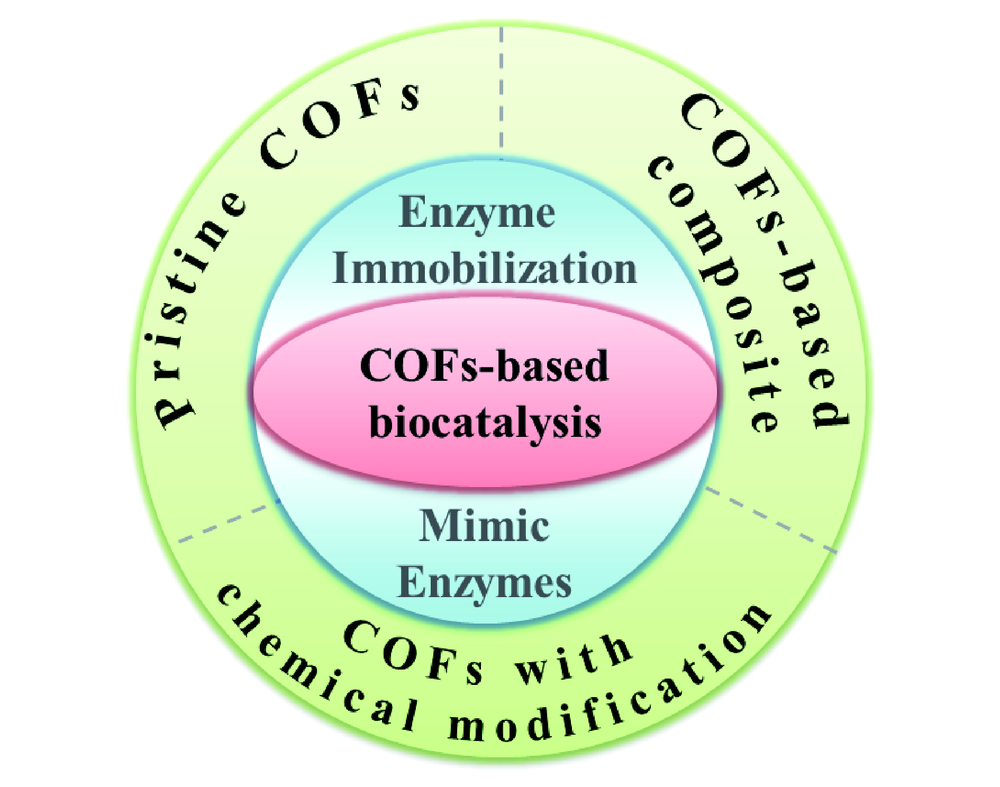
1 引言
2 COFs材料在酶催化领域的应用
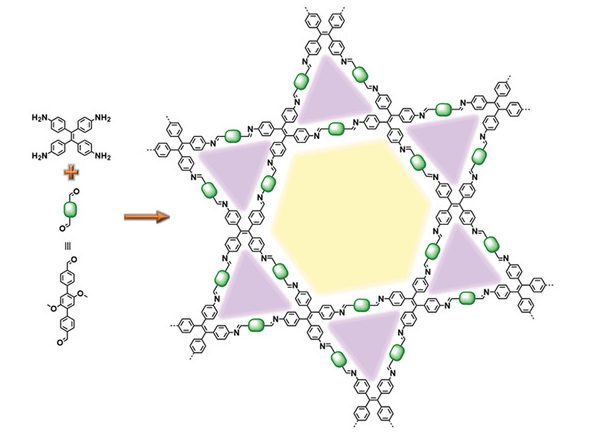
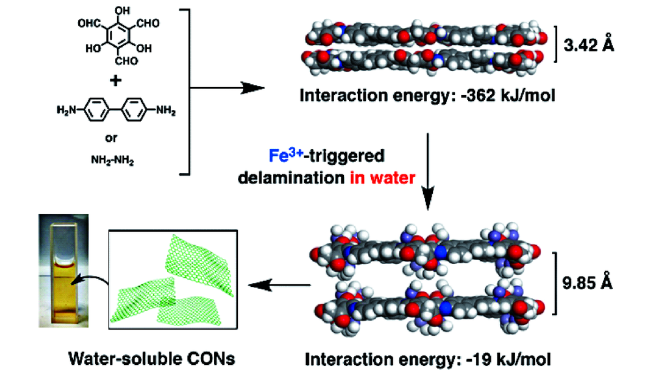
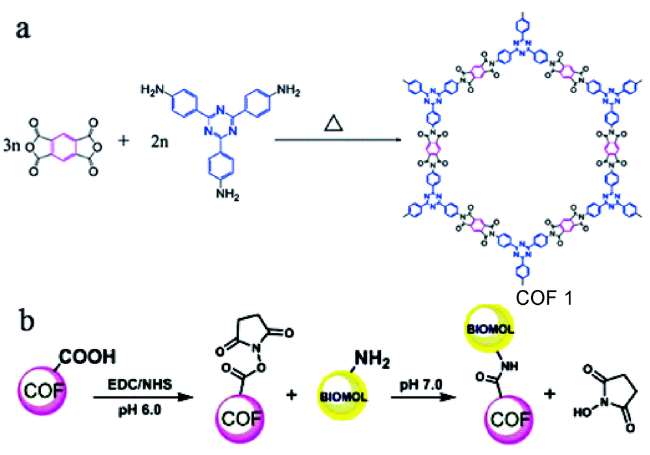
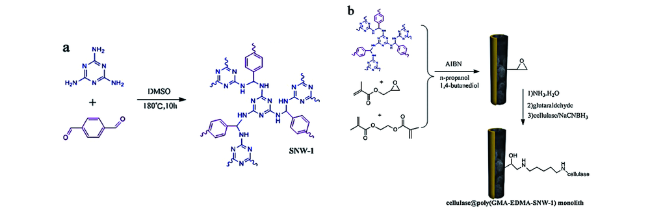
2.1 COFs作为固定化酶载体
表1 各种多孔材料结构参数及脂肪酶负载量[29]Table 1 Textural parameters of various porous materials before and after loading of lipase PS as well as the corresponding loading capacity[29] |
| Materials | BET(m2·g-1) | Loading capacity (mg·mg-1) |
|---|---|---|
| COF-OH | 1620 | / |
| lipase@COF-OH | 756 | 0.75 |
| COF-ONa | 1492 | / |
| lipase@COF-ONa | 854 | 0.59 |
| POP-OMe | 1056 | / |
| lipase@POP-OMe | 605 | 0.58 |
| POP-V | 952 | / |
| lipase@POP-V | 585 | 0.50 |
| MCM-41 | 1008 | / |
| lipase@MCM-41 | 712 | 0.35 |
| PCN-128 | 2680 | / |
| lipase@PCN-128 | 1295 | 0.64 |
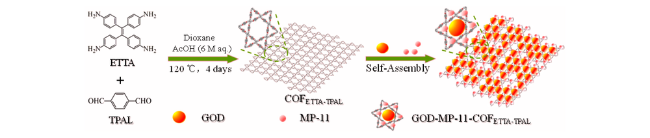
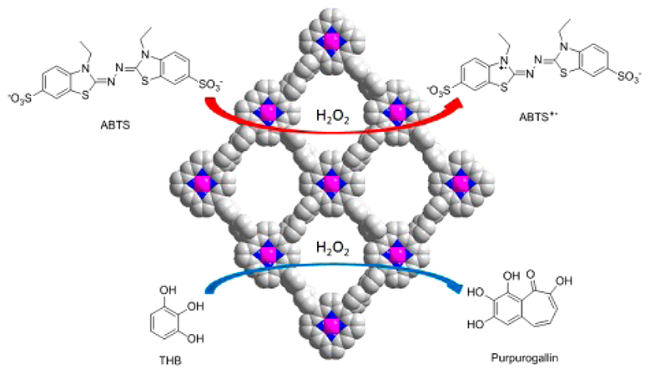
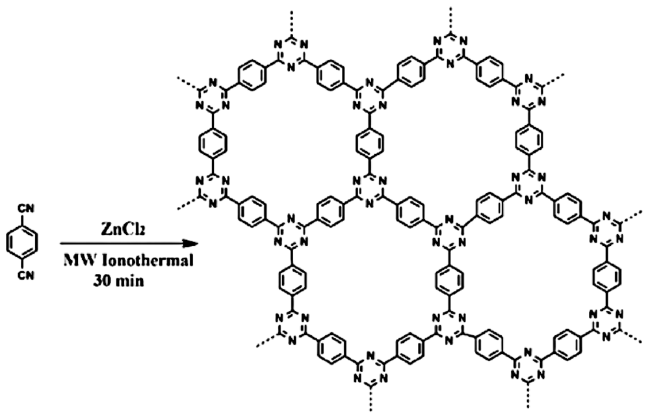
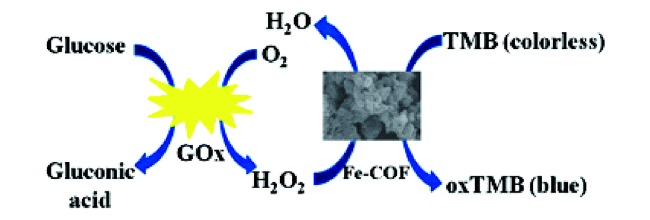
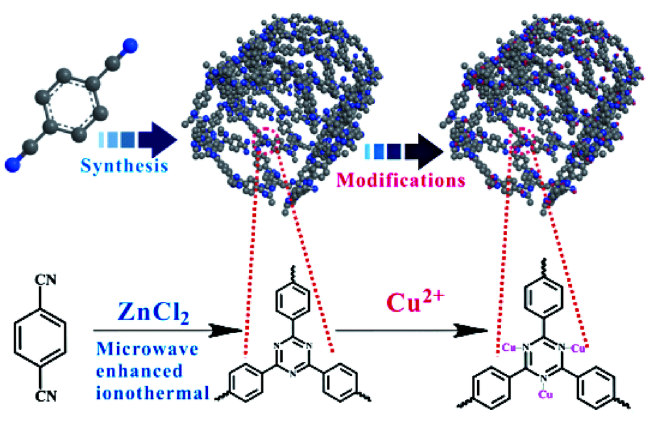
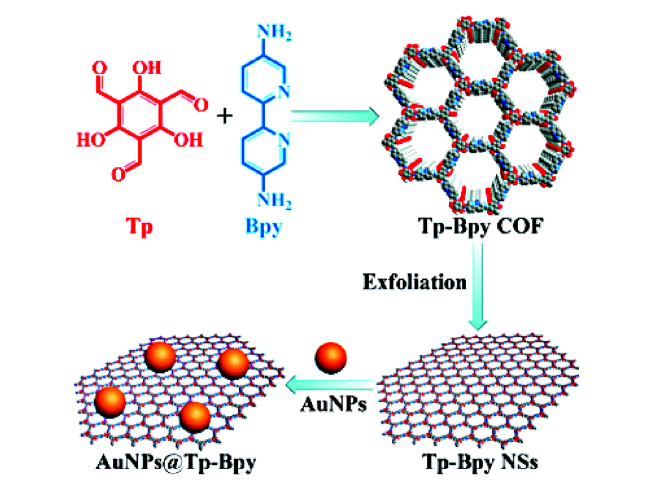
2.2 COFs作为模拟酶
表2 不同催化剂催化效率对比[51]Table 2 Kinetic parameters for the oxidation of substrates by different catalysts[51] |
| Substrate | Catalyst | k cat(min-1) | K m(mM) | k cat/K m(M-1·min-1) | ref |
|---|---|---|---|---|---|
| ABTS | CHF-1 | 0.45 | 0.022 | 2.06×104 | 51 |
| FeTPPCL | 3.67 | 0.0055 | 6.62×105 | ||
| HRP | 887.54 | 0.15 | 5.94×106 | 52 | |
| THB | |||||
| CHF-1 | 0.33 | 0.0040 | 8.26×104 | ||
| HRP | 1965 | 0.89 | 2.2×106 | ||
| hemin-graphene | 246 | 1.22 | 2.0×105 | ||
| FeTMPyP-graphene | 545 | 0.96 | 5.7×105 | ||
| PCN-222(Fe) | 16.1 | 0.33 | 4.85×104 | 53 |
表3 Fe-COF稳态动力学拟合参数V max和K m的比较[24]Table 3 Comparison of the steady-state kinetic fitting parameters V max and K m[24] |
| Catalyst | K m(mM) | V max(M·s-1) | ref | ||
|---|---|---|---|---|---|
| TMB | H2O2 | TMB | H2O2 | ||
| Fe-COF | 0.02 | 0.143 | 3.83×10-8 | 4.74×10-8 | 24 |
| MIL-53(Fe) | 1.08 | 0.04 | 8.78×10-8 | 1.86×10-8 | 34 |
| HRP | 0.434 | 3.7 | 1.0×10-7 | 8.71×10-8 | 56 |
| Fe3O4@MIL-100(Fe) | 0.112 | 0.077 | 1.14×10-7 | 1.8×10-7 | 57 |
| CuNPs@C | 1.65 | 1.89 | 1.21×10-7 | 5.3×10-8 | 58 |
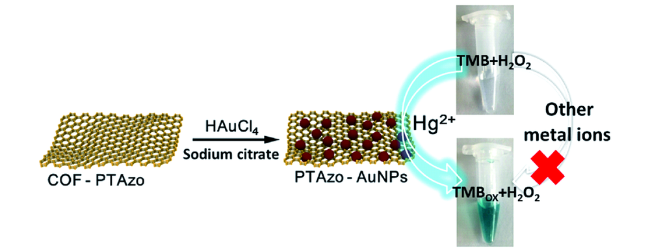
表4 PTAZo-Au和其他材料检测性能对比[59]Table 4 Comparison of detection performances of PTAZo-Au and other materials[59] |
| Material | Method | Linear range(nM) | Detection limit(nM) | ref |
|---|---|---|---|---|
| PTAZo-Au | colorimetric | 5~300 | 0.75 | 59 |
| Rox-DNA functionalized silicon nanodots | fluorescence | 10~1500 | 9.2 | 60 |
| DNA-templated quantum dots | phosphorescence | 20~800 | 4.8 | 61 |
| AuNPs | colorimetric | 1~600 | 0.3 | 62 |
| COF-LZU8 | fluorescence | 250~1000 | 125 | 63 |
| Catalyst | Linear range | LOD | ref |
|---|---|---|---|
| CTF | 1.0~80 μg/L(15.75 nM~1.26 mM) | 0.08 μg/L(1.25 nM) | 65 |
| Br-PEI-AuNPs | 0.1~10 μM | 0.03 μM | 66 |
| ZnO@ZnS core-shell nanoparticles | 15~1500 μM | 15 μM | 67 |
| Au@Pt nanohybrids | 0.02~0.5 μM | 4.0 nM | 68 |
| MOF(UIO-66) | 0.00157~0.15737 μM | 7.8 nM | 69 |
| TiO2 | 16.2 nM~0.98 mM | 16.2 nM | 70 |