1 引言
2 光电催化海水分解制氢
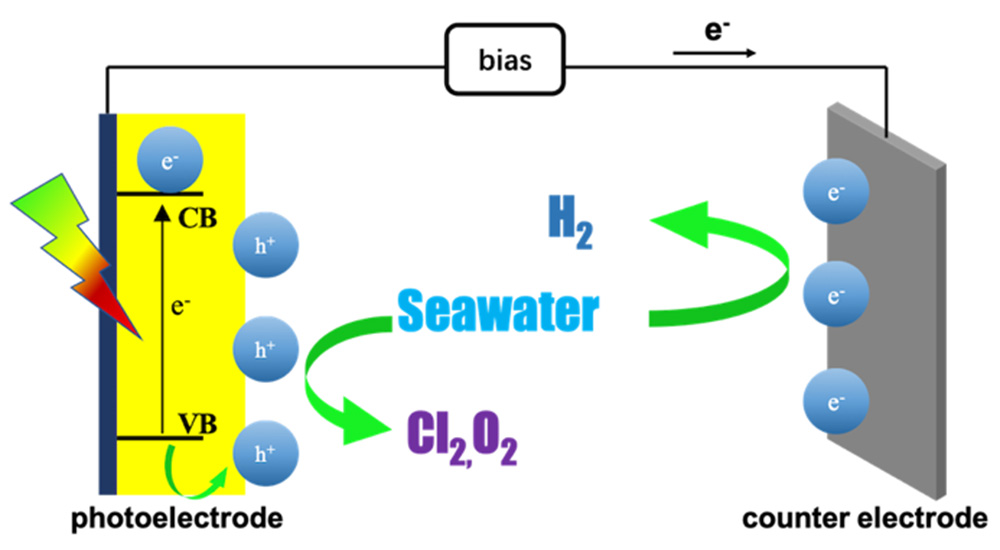
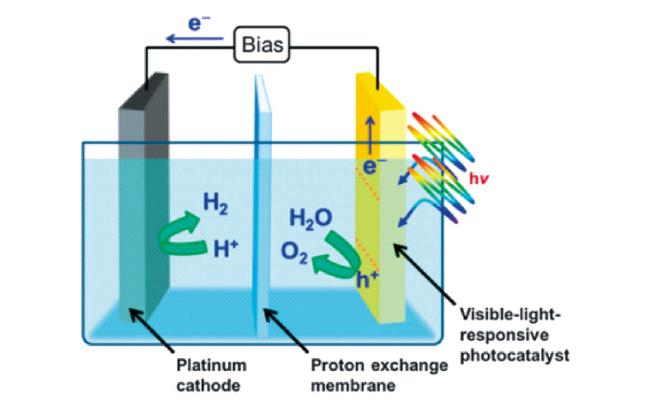
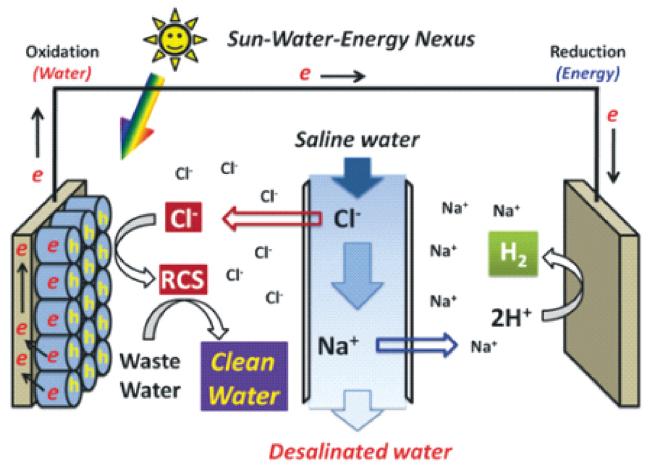
2.1 光电催化基本原理
2.2 TiO2系材料
表1 TiO2体系光电催化分解海水文献总结[10,11,14~23]Table 1 Literature summary of photoelectrocatalytic seawater splitting in TiO2 system[10,11,14~23] |
| Photoanode | Photocathode | Electrolyte | Bias | Light source (intensity, wavelength) | Photogenerated current density (mA·cm-2) | Hydrogen evolution rate (μmol·cm-2·h-1) | ref |
|---|---|---|---|---|---|---|---|
| TiO2@g-C3N4 nanorod arrays | / | natural seawater | 1.23 V vs RHE | AM 1.5 G | 1.64 | / | 10 |
| anatase TiO2 | / | natural seawater | 0 | 36.2 mW·cm-2 sunlight | 0.0947 | 1.6 | 11 |
| / | p-Si/TiO2/NiO x | simulated seawater | -0.9 V vs RHE | AM 1.5 G | 20 | 27.5 | 14 |
| / | Pt/TiO2 | concentrated seawater | solar cell | (75±5.0) mW·cm-2 UV light | / | 277 | 15 |
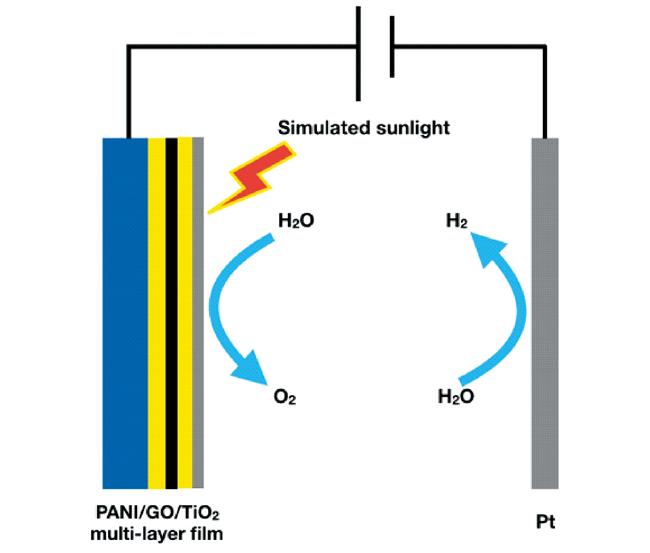
| PANI/GO/TiO2 ternary hybrid films | / | simulated seawater | 0.6 V vs Ag/AgCl | visible light | 0.13 | 30.06 | 16 |
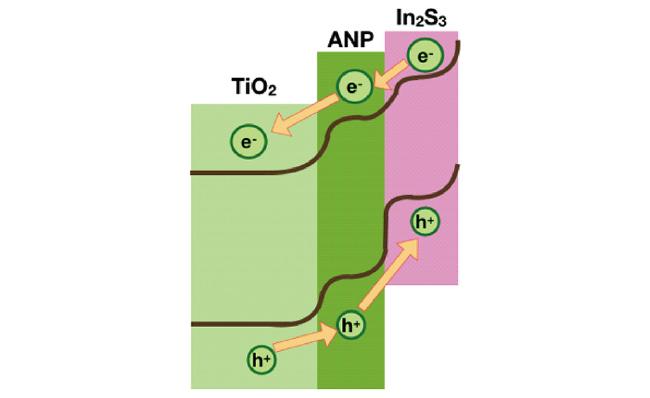
| In2S3/Anatase/Rutile TiO2 dual-staggered-heterojunction nanodendrite array | / | simulated seawater | 1.23 V vs RHE | AM 1.5 G | 1.57 | / | 17 |
| TiO2 nanotube | / | concentrated seawater | 2.0 V | (74±3.4) mW·cm-2 UV light | / | 105 | 18 |
| TiO2 nanotube | / | concentrated seawater | 3.0 V | (75±5.0) mW·cm-2 UV light | / | 270 | 19 |
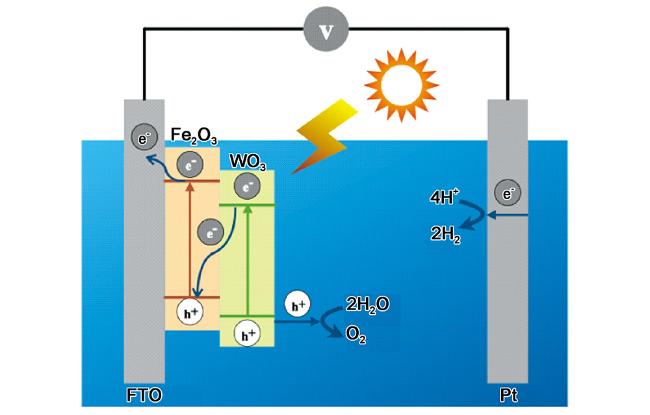
| Fe2O3/TiO2 | / | simulated seawater | 1.23 V vs RHE | AM 1.5 G | 0.4 | / | 20 |
| TiO2 nanotube | / | NaCl solution | 1.0 V vs Ag/AgCl | AM 1.5 G | 2.6 | / | 21 |
| TiO2 nanorod arrays | / | NaCl solution | 0.5 V vs SEC | AM 1.5 G | 2.3 | / | 22 |
| TiO2 nanotube | / | natural seawater | 3.0 V | (75±5.0) mW·cm-2 UV light | / | 215 | 23 |
2.3 其他材料
表2 其他光电催化材料文献总结[6,25~32]Table 2 Literature summary of photoelectrocatalytic seawater splitting in other materials systems[6,25~32] |
| Photoanode | Photocathode | Electrolyte | Bias | Light source (intensity, wavelength) | Photogenerated current density (mA·cm-2) | Hydrogen evolution rate (μmol·cm-2·h-1) | ref |
|---|---|---|---|---|---|---|---|
| orthorhombic Ag8SnS6 | / | 0.5 M NaCl solution | 1.23 V vs RHE | AM 1.5 G | 2.5 | / | 6 |
| / | porous Co3O4 film | natural seawater | -0.96 V vs RHE | AM 1.5 G | 20 | / | 25 |
| / | ReS2 nanosheet | saturated NaCl solution | -0.25 V vs RHE | AM 1.5 G | / | 216 | 26 |
| AlB2 | / | 0.7 M NaCl solution | 0.5 V vs SHE | AM 1.5 G | 1 | / | 27 |
| WO3/g-C3N4 nanosheet arrays | / | natural seawater | 1.23 V vs RHE | AM 1.5 G | 0.73 | / | 28 |
| α-Fe2O3/WO3 nanorod arrays | / | natural seawater | 1.23 V vs RHE | AM 1.5 G | 1 | / | 29 |
| AlGaN/GaN heteroepitaxial films | / | anode: NaCl solution,cathode: natural seawater | 1.0 V vs Ag/AgCl | 300 W Xe lamp | / | 95 | 30 |
| Mo/BiVO4 | / | natural seawater | 1.0 V vs RHE | AM 1.5 G | 2.16 | / | 31 |
| BiVO4 -CoLa(OH) x | / | natural seawater | 1.0 V vs RHE | AM 1.5 G | 0.6 | / | 32 |