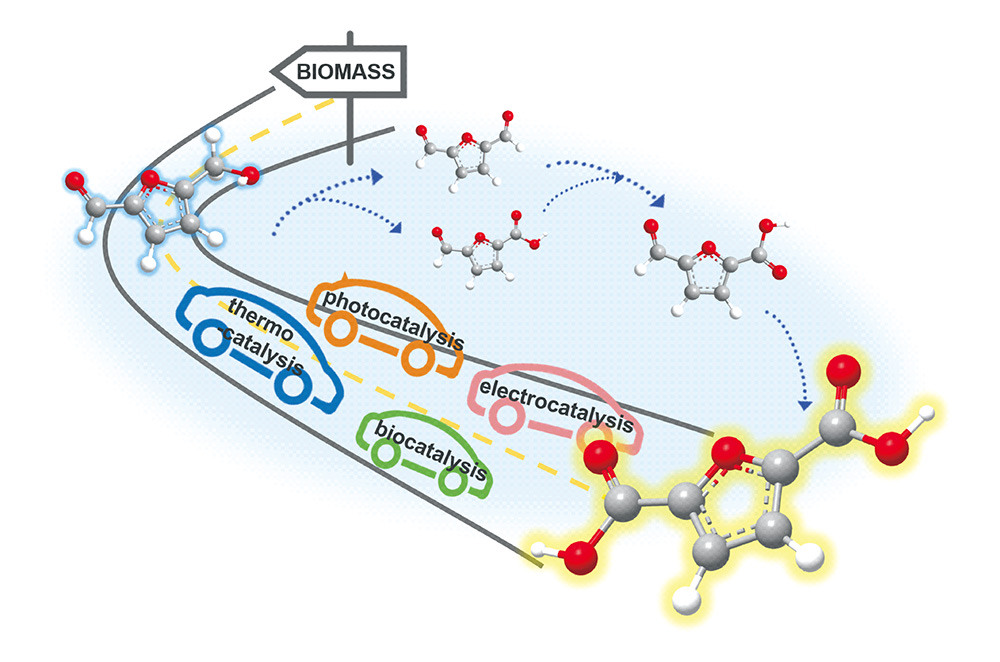
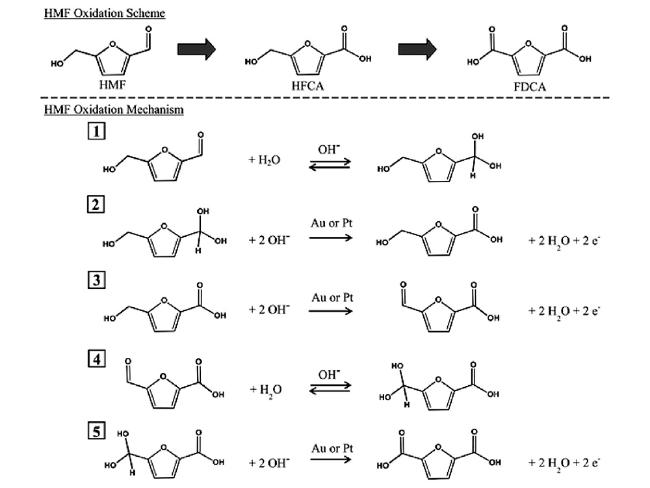
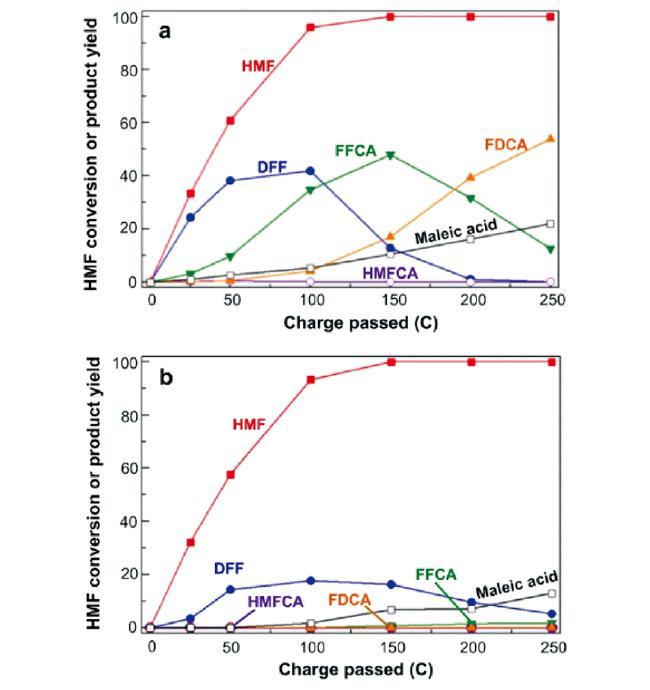
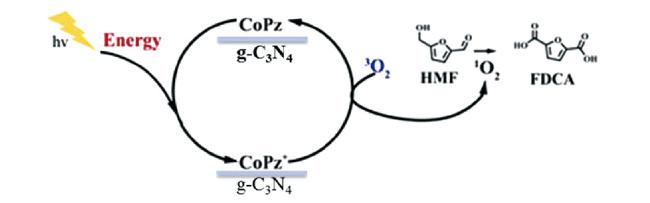
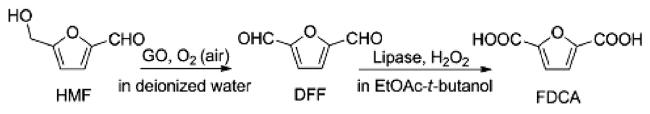
随着全球经济的不断发展,人类对能源和材料的需求日益增加。在传统化学工业中,化学中间体、聚合物的生产都依赖于化石燃料衍生的石化产品。这些石化产品的生产不但造成了日益严重的环境问题,而且随着化石能源逐渐枯竭,其储量已不能满足工业生产中大量化学品与材料的需求。因此,寻找可以作为化石能源替代品的可再生、可持续的原料迫在眉睫
[1]。生物质来源于自然界,储量丰富、分布广泛,可用于生产生物基化学品,因此受到研究人员的广泛关注。以纤维素为例,纤维素是植物细胞的主要结构成分,将结晶纤维素解聚为葡萄糖,可以进一步制得5-羟甲基糠醛(5-hydroxymethylfurfural, HMF)
[2],整个转化过程在捕获利用CO
2、H
2O和阳光的同时释放出HMF、H
2O和O
2,转化效率高,且全程无有害产物,符合环境友好的生产理念
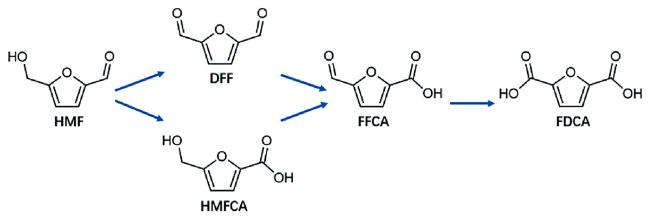
[3]。HMF的生产原料易得,制备路径简单,更重要的是,从HMF出发不仅可以制备各种高价值的化学品,如乙酰丙酸(levulinic acid, LA)
[4]、2,5-呋喃二甲醇(2,5-dihydroxymethylfuran, DHMF)、2,5-呋喃二甲醛(2,5-diformylfuran, DFF)
[5]和2,5-呋喃二甲酸(2,5-furandicarboxylic acid, FDCA)
[6],还可以生成液体燃料替代品,如2,5-二甲基呋喃(2,5-dimethylfuran, DMF)
[7]、乙酰丙酸乙酯(ethyl levulinate, EL)
[8]、5-乙氧基甲基糠醛(5-ethoxymethylfurfural, EMF)
[9]和长链烷烃(long chain alkane, LLA)
[10]等。因此,HMF被认为是生物质转化过程中一个非常重要的平台化合物,同时也是联结生物质资源与石油工业的桥梁。
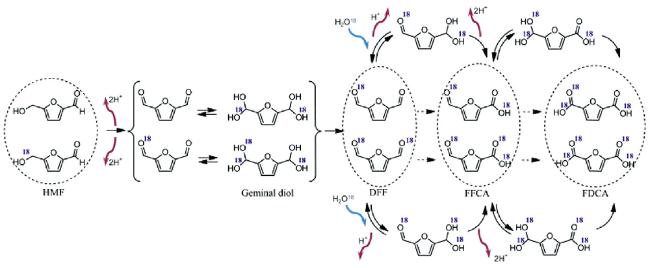
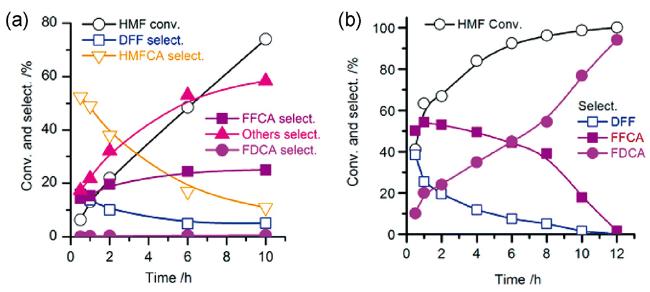
 O基团在DMSO/H2O体系中被DMSO优先溶剂化,提高了HMF的LUMO能级,降低了它对亲核攻击的敏感性,从而减少了低价值的副产物生成。这一结果以及DMSO对HMF的优先溶解解释了DMSO/H2O混合体系中HMF稳定性的增强。这些研究结果证明,有机溶剂与水的混合体系避免了大量有机试剂的使用,同时能够实现对反应速率和产物选择性的提高,为研究通过对溶剂的改变提高FDCA产率提供了新思路。
O基团在DMSO/H2O体系中被DMSO优先溶剂化,提高了HMF的LUMO能级,降低了它对亲核攻击的敏感性,从而减少了低价值的副产物生成。这一结果以及DMSO对HMF的优先溶解解释了DMSO/H2O混合体系中HMF稳定性的增强。这些研究结果证明,有机溶剂与水的混合体系避免了大量有机试剂的使用,同时能够实现对反应速率和产物选择性的提高,为研究通过对溶剂的改变提高FDCA产率提供了新思路。