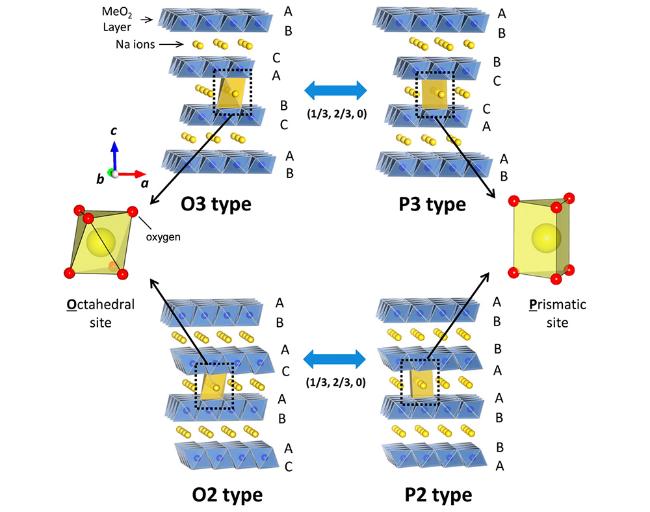
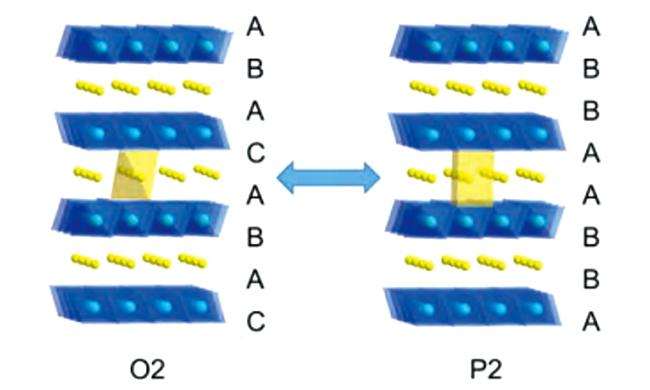
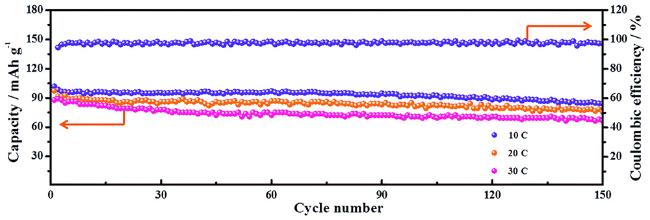
1 引言
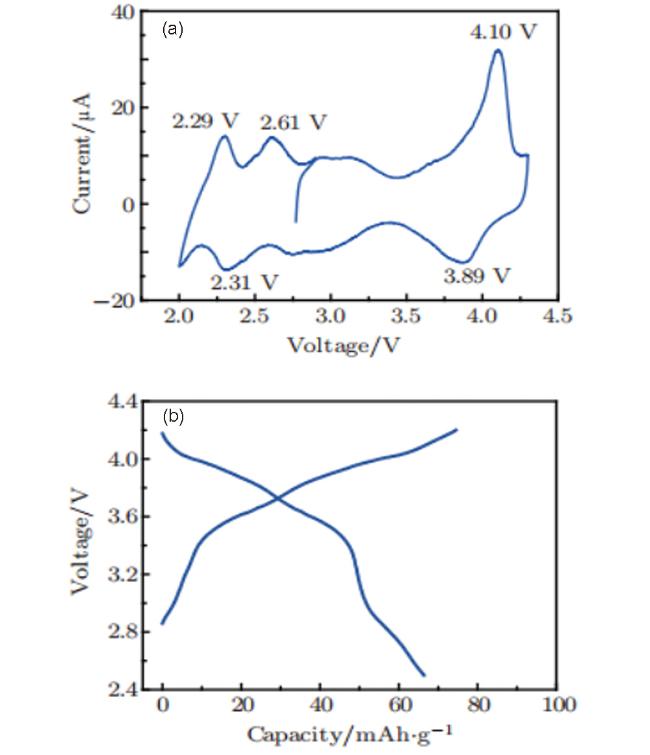
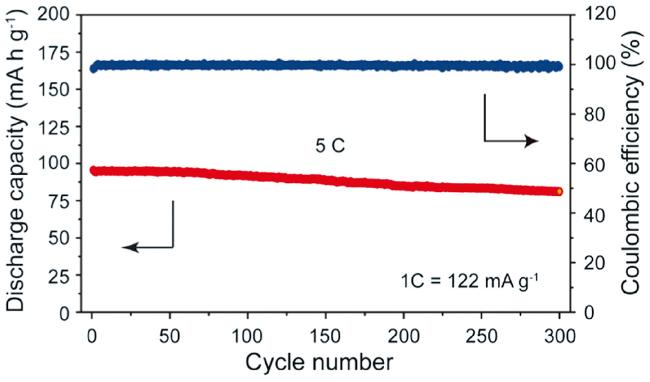
2 含单一过渡金属的P2结构材料
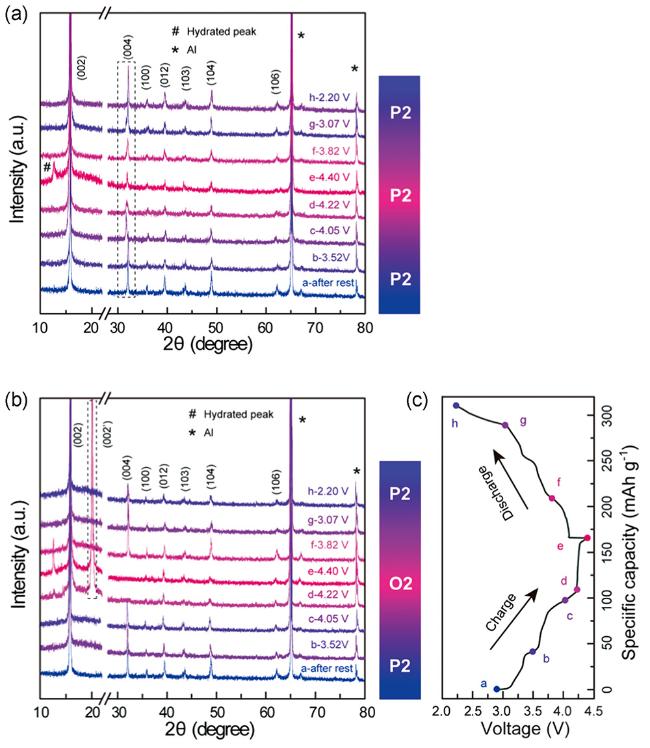
3 由二元过渡金属组成的P2结构材料
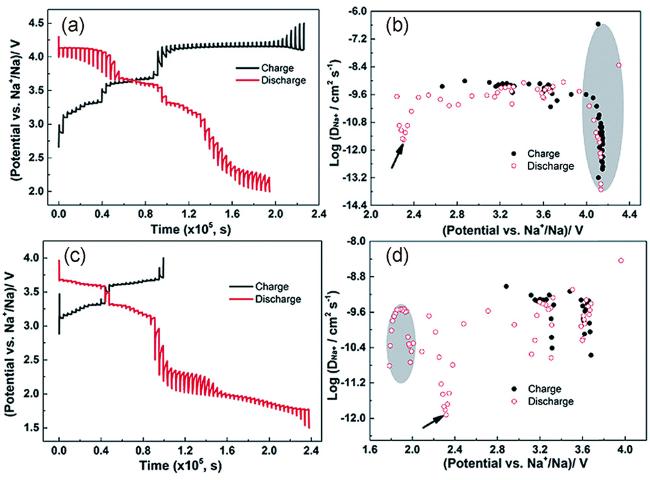
图3 (a) Na/NNMO电池首圈充放电状态的GITT曲线及(b)相应的钠离子扩散系数($D_{Na^{+}}$)在4.5 ~ 2.0 V之间;(c)Na/NNMO电池首圈充放电状态的GITT曲线以及(d) 相应的钠离子扩散系数($D_{Na^{+}}$)在2.0 ~ 1.5 V[89]Fig. 3 (a) GITT curves for the charge and discharge states of the first cycle and (b) corresponding sodium-ion diffusion coefficient ($D_{Na^{+}}$) of Na/NNMO cell cycling between 4.5 and 2.0 V;(c) GITT curves for the charge and discharge states of the first cycle and (d) corresponding $D_{Na^{+}}$ of Na/NNMO cell cycling between 2.0 and 1.5 V electrode at current rate of 6C[89] |