Contents
1 引言
表1 以MOFs为模板制备的金属氧化物及其复合材料应用于锂离子电池Table 1 Metal oxides and composite materials prepared from MOFs applied in lithium ion batteries |
| MOFs | Sample | Voltage range (V) | RCa) (mAh·g-1/cycles) | CDb) (mA·g-1) | DCc)/CCd) (mAh·g-1) | CEe) | ref | |
|---|---|---|---|---|---|---|---|---|
| ZIF-67 | Co3O4 | 0.01~3.0 | 1335/100 | 100 | 1735/1083 | 96% | 31 | |
| MOF-71 | Co3O4 | 0.001~3.0 | 913/60 | 200 | 1286.1/879.5 | 97% | 32 | |
| {Ni3(HCOO)6·DMF} n | NiO | 0.01~3.0 | 760/100 | 200 | 1149/850 | ~100% | 33 | |
| Cu-BTC | CuO | 0.01~3.0 | 1085/100 | 100 | 1334.7/836.1 | 99% | 34 | |
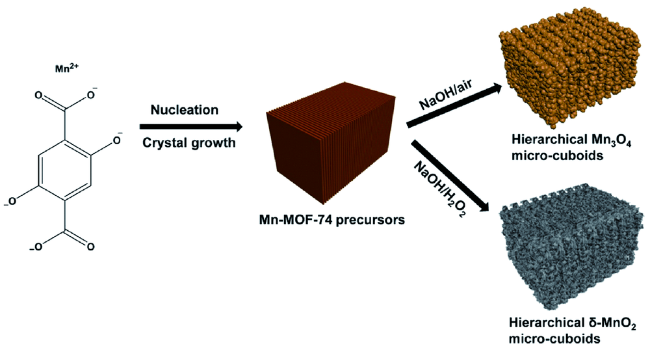
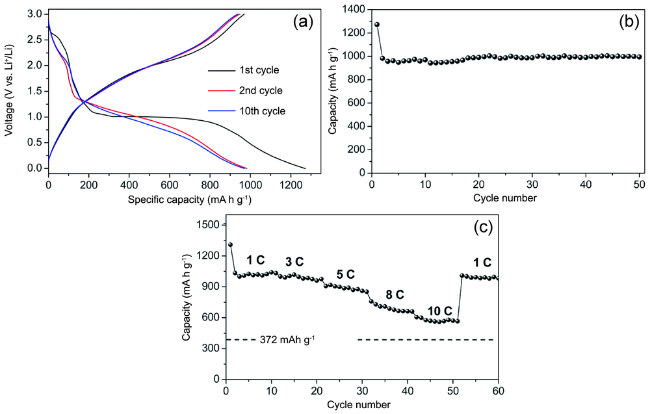
| Mn-MOF-74 | Mn3O4 | 0.01~3.0 | 890.7/400 | 200 | 1078.9/625.1 | ~100% | 35 | |
| Mn-MOF-74 | δ-MnO2 | 0.01~3.0 | 991.5/400 | 200 | -/- | 99.4% | 35 | |
| MIL-88-Fe | α-Fe2O3 | 0.01~3.0 | 911/50 | 200 | 1372/940 | 97% | 36 | |
| MIL-53(Fe)-2 | Fe2O3-2 | 0.005~3.0 | 1176/200 | 100 | 1456/1048 | ~100% | 37 | |
| Zn-Co-ZIFs | ZnxCo3- x O4 | 0.01~3.0 | 990/50 | 100 | 1272/969 | 76.2% | 38 | |
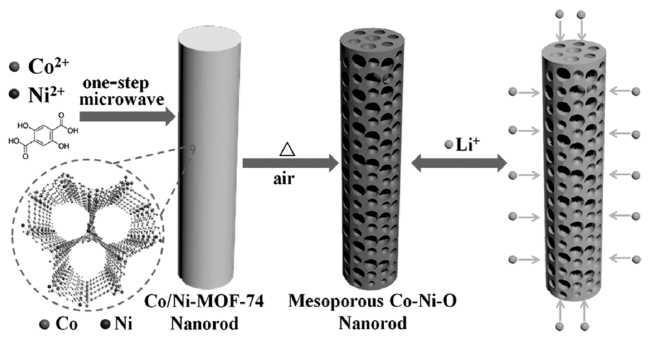
| Co/Ni-MOF-74 | Ni0.3Co2.7O4 | 0.01~3.0 | 1410/200 | 100 | 1737/1189 | - | 39 | |
| Co/Ni-MOF-74 | NiCo2O4 | 0.01~3.0 | 1157/200 | 100 | 1693/1057 | - | 39 | |
| Co[Fe(CN)6]0.667 | CoFe2O4 | 0.01~3.0 | 1115/200 | 1000 | 1352/1190 | 85.3% | 40 | |
| NMOFs | NiFe2O4 | 0.01~3.0 | 1071/200 | 1000 | 1245/1152 | - | 41 | |
| ZF-MOFs | ZnFe2O4/ZnO | 0.01~3.0 | 537/500 | 500 | 1156/839 | ~100% | 42 | |
| Ni-BTC | CuO@NiO | 0.005~3.0 | 1061/200 | 100 | 1218/856 | ~100% | 43 | |
| Co3[Fe(CN)6]2@Ni3[Co(CN)6]2 | Fe2O3@NiCo2O4 | 0.01~3.0 | 1079.6/100 | 100 | 1311.4/902.7 | 96% | 44 | |
| [Cu3(btc)2)] n | CuO/Cu2O | 0.01~3.0 | 740/250 | 100 | 727/513 | - | 45 | |
| MIL-101(Cr3+) | Cr2O3@TiO2 | 0.05~3.0 | 510/500 | 500 | 1138/- | - | 46 | |
| IRMOF-1 | ZnO QDs@C | 0.002~3.0 | 1200/50 | 75 | 2300/- | ~100% | 47 | |
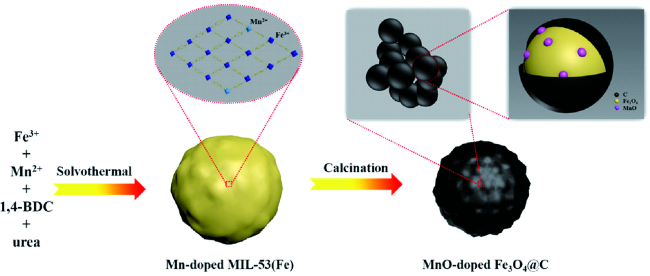
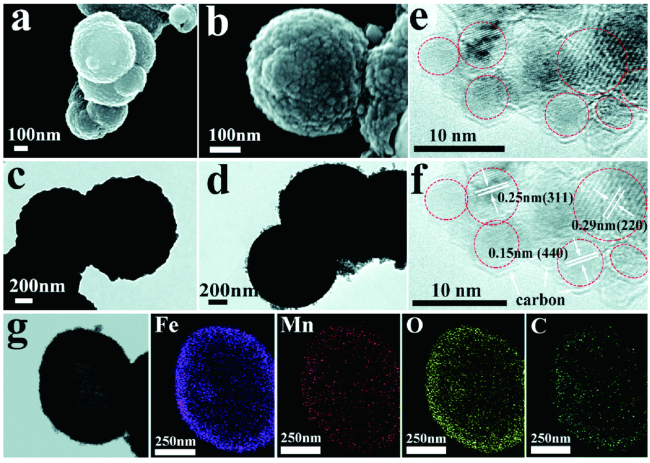
| Mn-doped MIL-53(Fe) | MnO-Fe3O4@C | 0.01~3.0 | 1297.5/200 | 200 | 1281.4/938.6 | 96.5% | 48 | |
| ABO3-type MOF | Fe3O4@C | 0.01~3.0 | 1041/50 | 100 | 1714/1333 | 96%~99% | 49 | |
| CoⅡ(2,3-chedc)(DABCO)0.5 | CoO-NCNTs | 0.01~3.0 | 450/300 | 500 | 1156/945 | ~100% | 50 | |
| Ni@ZIF-8 | Ni@ZnO/CNF | 0.01~3.0 | 1051/100 | 100 | 1547/1100 | ~99% | 27 | |
| Co-Ti-MOF | Ti-CoO@C | 0.01~3.0 | 1108/150 | 200 | 1749/830.7 | 86.6% | 51 | |
| Zn-Mn-BTC | Zn x MnO@C | 0.01~3.0 | 1050/200 | 100 | 1565.9/954.6 | 99% | 52 | |
| ZIF-8 | C-ZnCo2O4-ZnO | 0~3.0 | 1318/150 | 200 | 1311/898 | ~100% | 53 | |
| Fe/Mn-MOF-74 | Fe-Mn-O/C | 0~3.0 | 1294/200 | 100 | 1333/837 | 98.5% | 54 |
a)RC: reversible capacity;b)CD: current density;c)DC: discharge capacity;d)CC: charge capacity;e)CE: coulombic efficiency. |
表2 各种MOFs及其衍生物负极材料与不同正极组合成全电池的性能对比Table 2 Full cell performance comparison of various nanostructured anode materials with different cathodes |
| Cathode | Anode | Current Density | Capacity retention (after n cycles) | Specific capacity (mAh·g-1) | Energy density (Wh·kg-1) | ref |
|---|---|---|---|---|---|---|
| LiFePO4 | bp-Fe2O3 | 0.1 A·g-1 | (n=80) | 421.2 | 247.03 | 66 |
| LiMn2O4 | Zn0.5MnO@C | 0.1 A·g-1 | 70.4%(n=120) | - | 122 | 52 |
| LiFePO4 | Fe-MIL-88B | 0.25 C | 73.7%(n=100) | 86.8 | - | 67 |
| LiFePO4 | Fe-MIL-88B | 0.5 C | 61%(n=200) | 55.3 | - | 67 |
| LiNi0.6Co0.2Mn0.2O4 | Si@Sn-MOF | 20 mA·g-1 | 87.8%(n=100) | 117.7 | - | 68 |
| LiCoO2 | Ni0.62Fe2.38O4 | 0.25 A·g-1 | 70%(n=100) | 94 | 213 | 69 |
2 MOFs衍生金属氧化物及其复合材料作为锂离子电池负极材料
2.1 单金属氧化物
2.2 双金属氧化物
图3 Zn x Co3- x O4空心十二面体作为电极材料的电化学性能:(a) 在电流密度为100 mA·g-1时充放电曲线,(b) 在电流密度为100 mA·g-1时放电循环性能曲线,(c) 在1 ~ 10 C不同倍率时的倍率曲线[38]Fig.3 Electrochemical properties of the porous ZnxCo3- x O4 hollow polyhedra as electrodes in LiBs:(a) charge-discharge voltage profiles at a current density of 100 mA·g-1,(b) discharge capacities versus cycle number at a current density of 100 mA·g-1, and(c) rate capability at various current rates between 1 and 10 C[38]. Copyright 2014,ACS |
2.3 双组分金属氧化物
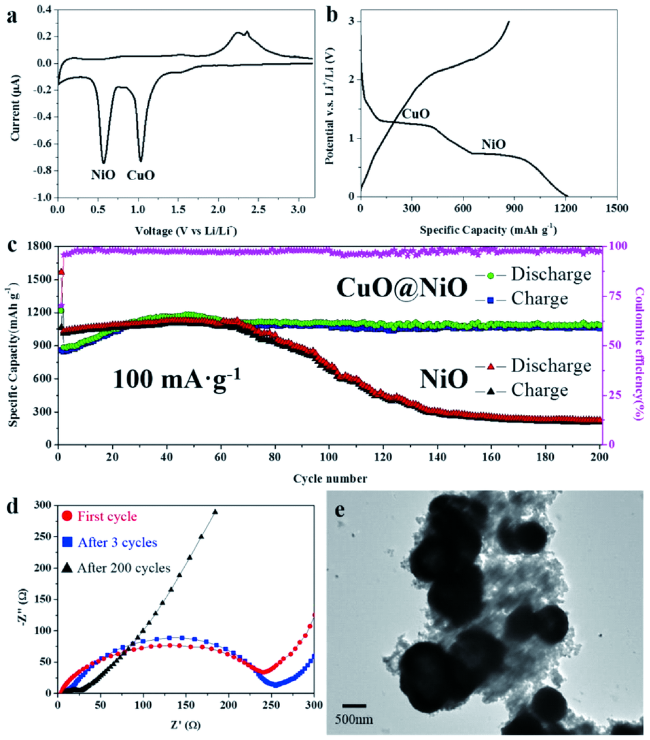
图5 多层CuO@NiO微球的电化学性能:(a) 伏安循环图,(b) 第一次循环放电(锂嵌入)和充电(锂萃取)曲线,(c) 电流为 0.1 Ah·g-1时的循环性能曲线,(d)第一、第三和第200次循环后的奈奎斯特曲线,(e) 200循环后阳极TEM图像[43]Fig.5 Electrochemical performances of multilayer CuO@NiO spheres:(a) cycle voltammogram profile,(b) first cycle discharge(lithium insertion) and charge(lithium extraction) curve,(c) cycling performance at a current of 0.1 Ah·g-1, (d) Nyquist plots for the first, third and 200 cycles, (e) TEM image of the anode after 200 cycles[43].Copyright 2015, ACS |
2.4 金属氧化物/碳复合材料
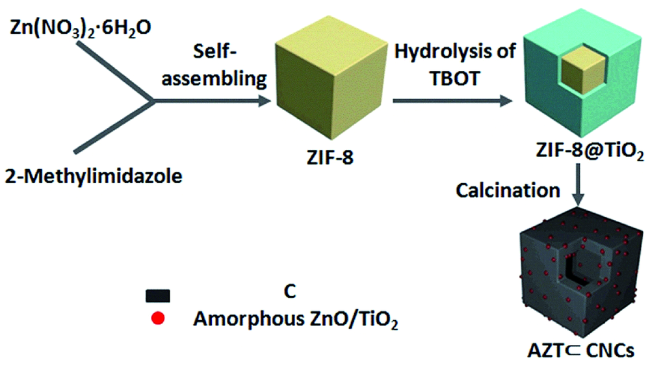
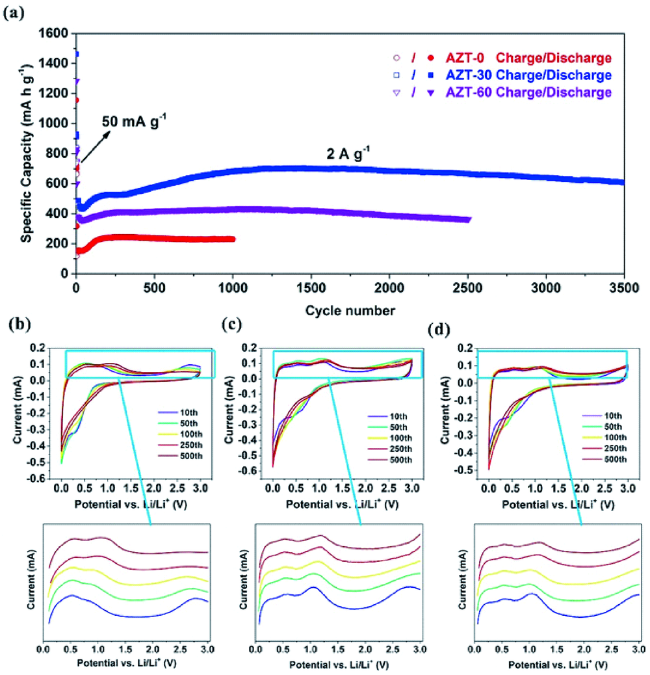
图9 a) AZT-0、AZT-30、AZT-60在2.0 A·g-1的高电流密度下的超长循环性能;b) AZT-0、 c) AZT-30、 d) AZT-60在10、50、100、250和500次充放电循环后扫描速率为0.1 mV·s-1的CV曲线[29]Fig.9 a) Ultralong cycling performance of AZT-0, AZT-30, and AZT-60 at a high current density of 2.0 A·g-1. CV curves of b) AZT-0, c) AZT-30, and d) AZT-60 at a scan rate of 0.1 mV·s-1 after 10, 50, 100, 250, and 500 charge/discharge cycles[29]. Copyright 2018, Wiley |