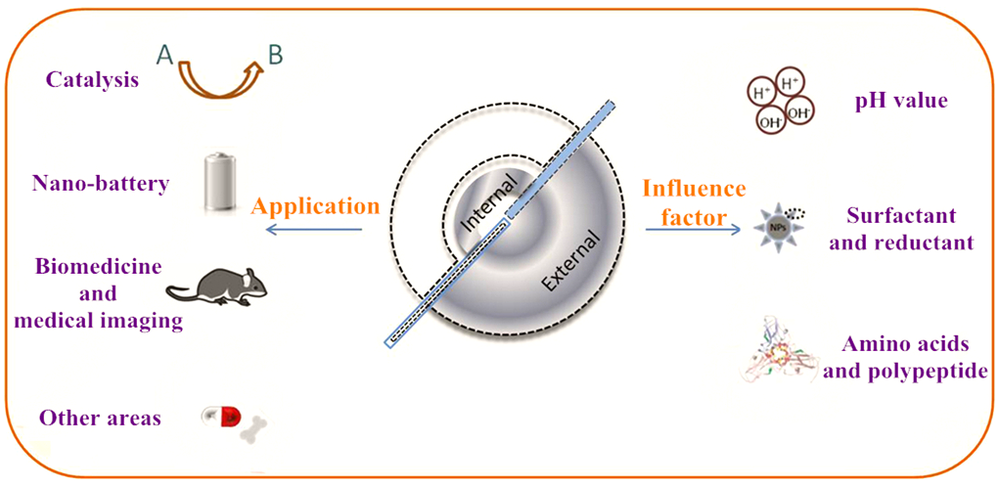
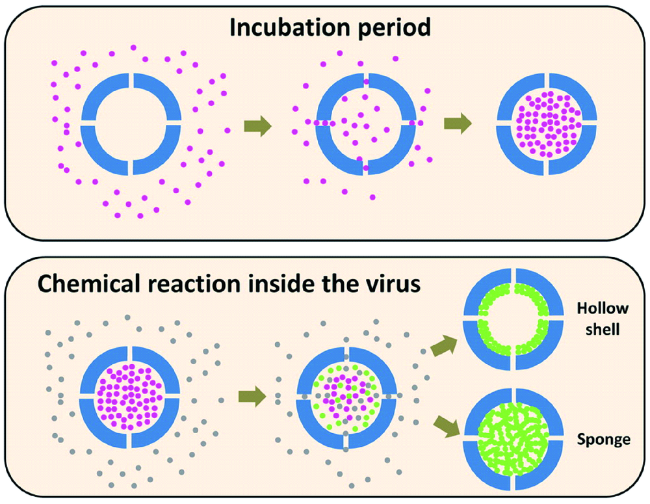
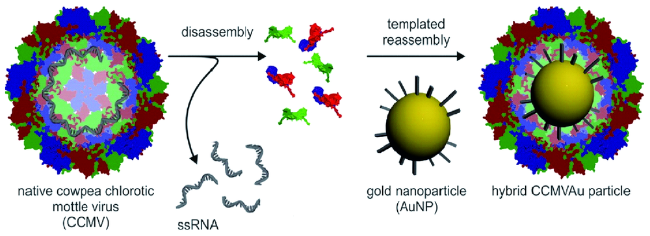
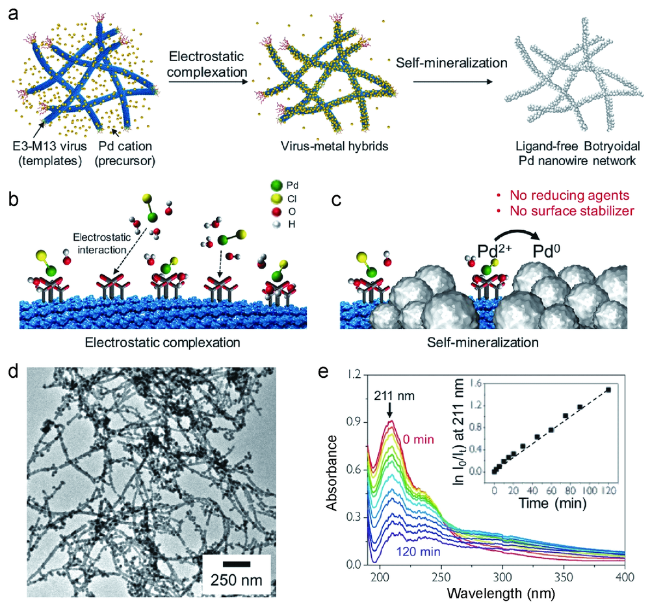
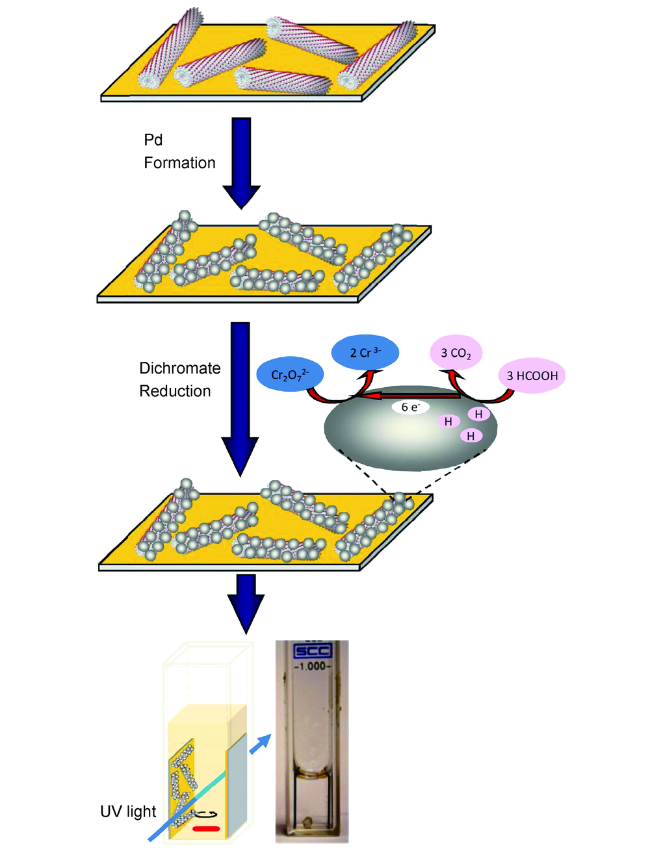
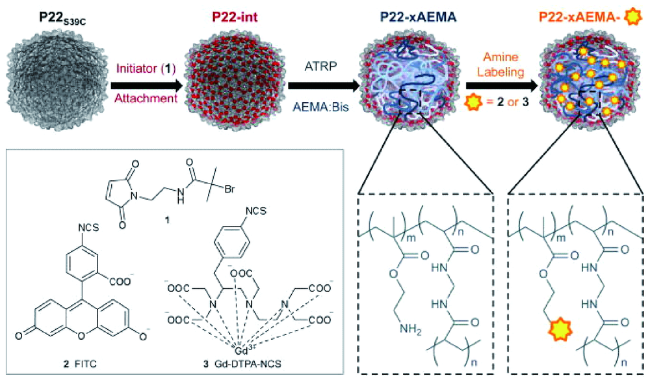
通常利用噬菌体展示技术筛选出可特异性结合金属化合物的多肽片段,这些多肽具有特异结合金属纳米化合物、控制纳米颗粒成核、根据病毒固有的各向异性进行排序的能力。将它们通过基因工程技术整合到病毒衣壳中,可以使病毒特异结合相应金属化合物,控制纳米颗粒的组成和形状,因此也可以根据不同类型的纳米材料对病毒进行特定修饰。例如,Blecher等
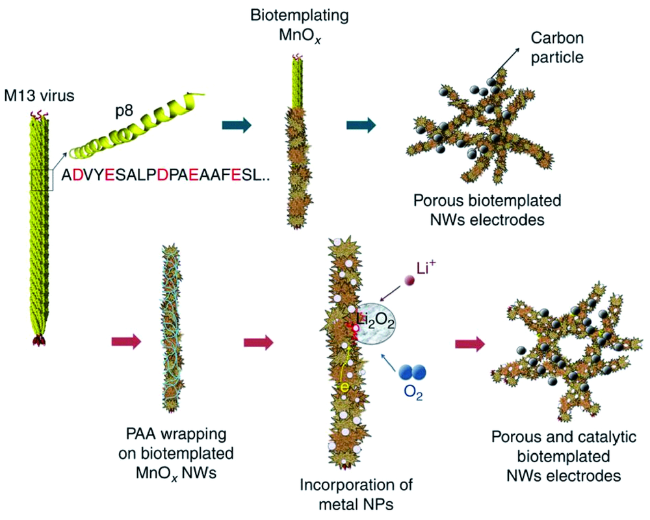
[71]能够合成ZnS、CdS、FePt、CoPt纳米材料,就是通过基因工程技术将能够特异性吸附金属化合物的多肽片段(CNNPMHQNC,即A7,识别ZnS;SLTPLTTSHLRS,即J140,识别CdS;HNKHLPSTQP LA,即 FP12,识别FePt;CNAGDHANC,即CP7,识别CoPt)整合到丝状噬菌体M13衣壳中。Prevelige等
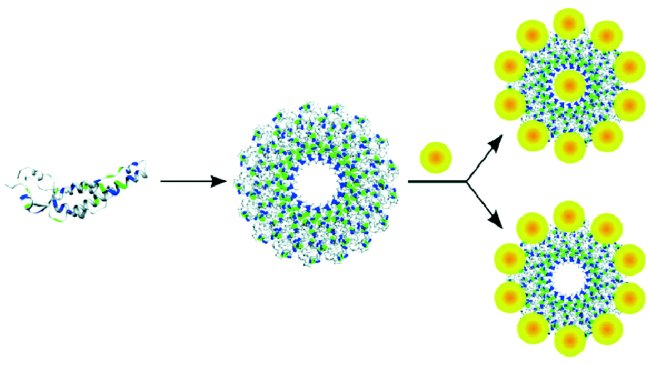
[72]也是通过基因工程手段在P22基因中克隆入两段基因分别编码两个多肽,即T1(CHKKPSKSC)和T2(RKLPDAPGMHTW),这两段多肽可以特异性结合TiO
2粒子,并促进其晶体生长,从而在中性pH值和室温下,于P22内部合成了粒径约34 nm的TiO
2纳米粒子,该方法明显提高了材料的光催化活性。Johnson等
[73]将6个组氨酸基因导入到CPMV基因组中的不同位置,获得了5个不同突变体,研究发现,突变体颗粒对金属Ni的结合表现出不同的亲合力,其静电特性与暴露的组氨酸序列质子化状态有关。