Contents
1 引言
2 β-环糊精有机小分子凝胶的种类
2.1 热致及常温凝胶
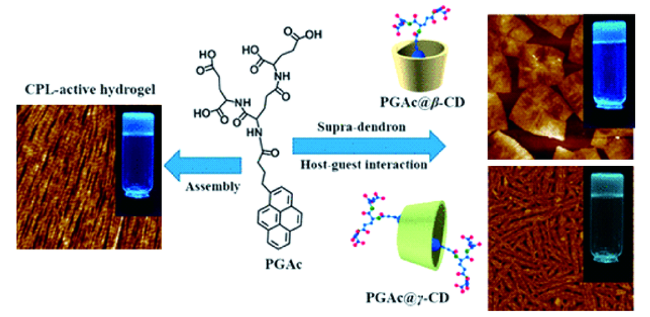
2.2 单凝胶因子及多凝胶因子凝胶
3 不同因素对β-环糊精有机小分子凝胶形成的影响
3.1 温度
3.2 主体分子
表1 不同种类的环糊精在DMF和水的混合溶剂中的状态Table 1 States of different types of β-cyclodextrin in the DMF/water system |
| Entry | CDs | State |
|---|---|---|
| 1 | α-CD | Sa |
| 2 | β-CD | Gb |
| 3 | γ-CD | Sa |
| 4 | Heptakis(6-deo-I)-β-CD | Pc |
| 5 | Heptakis(2-O-hydroxypropyl)-β-CD | Sa |
| 6 | Heptakis(2-O-sulfobutyl)-β-CD | Sa |
| 7 | Heptakis(2-deo-amino)-β-CD | Sa |
| 8 | Heptakis(2,6-di-O-methyl)-β-CD | Sa |
| 9 | Heptakis(2-O-diethylenetriamino)-β-CD | Sa |
| 10 | Heptakis(6-deo-I)-α-CD | Pc |
| 11 | Poly-β-CD | Sa |
Sa: solution. Gb: gelation. Pc: precipitation. |
3.3 客体分子
3.4 溶剂
表2 不同种类的醇对β-环糊精常温凝胶形成的影响Table 2 The effect of alcohols on the formation of the room-temperature organogel |
| Solution | β-CD/DMAc/LiCl | ||||
|---|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 | |
| Methanol | G | G | G | G | G |
| Ethanol | G | G | G | G | G |
| n-Propylalcohol | G | G | G | G | G |
| i-Propanol | G | G | G | G | G |
| n-Butyl alcohol | G | G | G | G | G |
| i-Butanol | G | G | G | G | G |
| t-Butanol | G | G | G | G | G |
| n-Amyl alcohol | G | G | G | G | G |
| n-Hexyl alcohol | G | G | G | G | G |
| n-Heptyl alcohol | G | G | G | G | G |
| n-Octanol | G | G | G | G | G |
| Phenylcarbinol | G | G | G | G | G |
| Ethanediol | S | S | S | S | S |
| Propanediol | S | S | S | S | S |
| Propanetriol | S | S | S | S | S |
Solution: Cβ-CD 0.167 mol/L, Cguest molecule 0.167 mol/L(guest molecule: 1 BPA, 2 bisphenol F, 3 phenol, 4 p-chlorophenol, 5 p-nitro-phenol), ωLiCl 0.5%, G room-temperature organogel, S a clear solution, DMAc was the solvent, Vsolution:Valcohol 1∶1. |
3.5 金属离子
表3 加入不同浓度的金属离子后体系的状态Table 3 States of the gel after adding different salts at different concentrations |
| Csalt(mM) | LiCl | LiOH | Li2CO3 | NaCl | NaOH | Na2CO3 |
|---|---|---|---|---|---|---|
| 50 | G | CP | - | G | G | G |
| 100 | G | CP | - | G | G | G |
| 150 | G | CP | - | G | G | G |
| 200 | CP | CP | - | G | G | G |
| 300 | CP | CP | - | G | CP | G |
| 500 | CP | CP | - | G | CP | G |
G: gelation; CP: crystallization or precipitation. |
4 β-环糊精有机小分子凝胶形成的可能机理
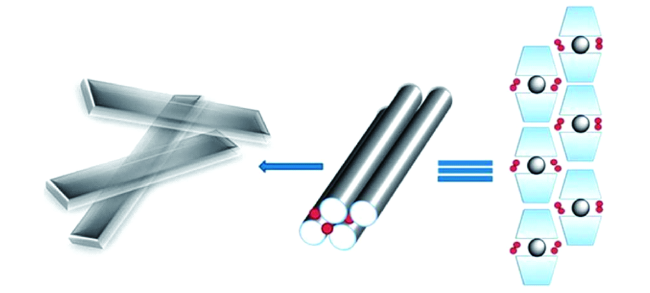
4.1 单凝胶因子β-环糊精凝胶形成机理
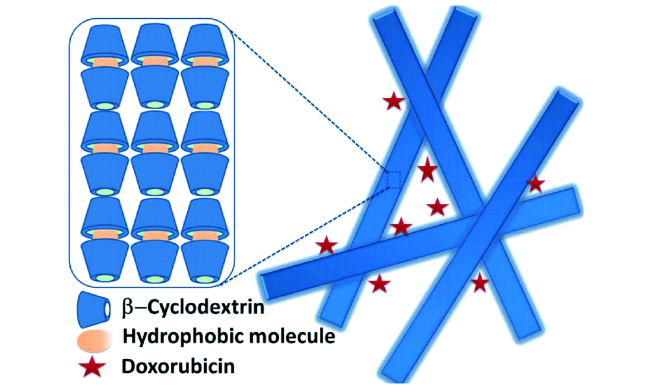
4.2 多凝胶因子β-环糊精凝胶形成机理
5 β-环糊精有机小分子凝胶的刺激响应性
5.1 温度响应
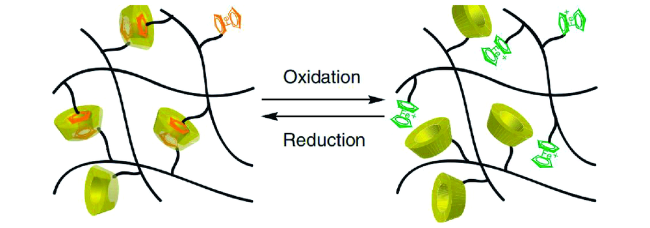
5.2 化学刺激响应
5.3 酸响应
6 β-环糊精有机小分子凝胶在药物载运领域的应用
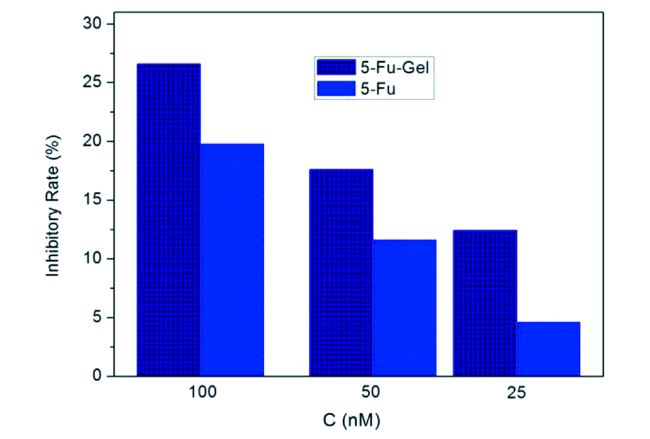
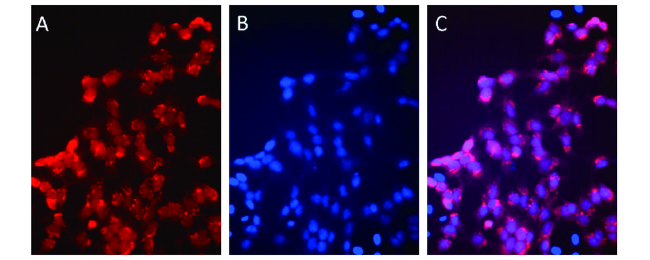
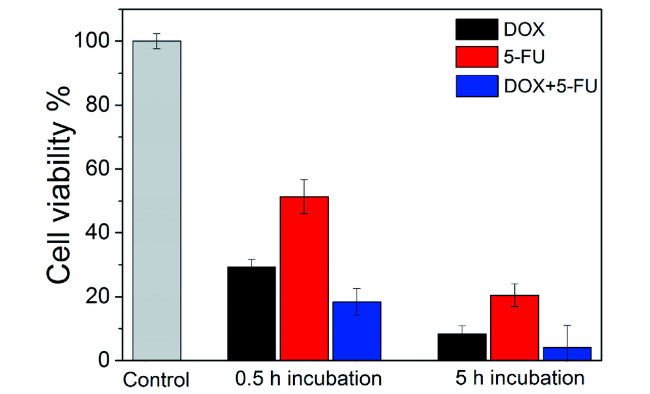
6.1 β-环糊精有机小分子凝胶单重载药
图14 凝胶转变图片:(a)β-环糊精/甘油胶体溶液;(b)β-环糊精/甘油凝胶;(c)载有甲氨蝶呤的β-环糊精/甘油凝胶;(d)载有5-氟尿嘧啶的β-环糊精/甘油凝胶[55]Fig. 14 Photographs of phase transition from(a) the colloidal solution of β-cyclodextrin/glycerol to(b) β-cyclodextrin/glycerol gel, to(c) β-cyclodextrin/glycerol gel loaded with methotrexate, and to(d) β-cyclodextrin/glycerol gel loaded with 5-fluorouracil[55] |