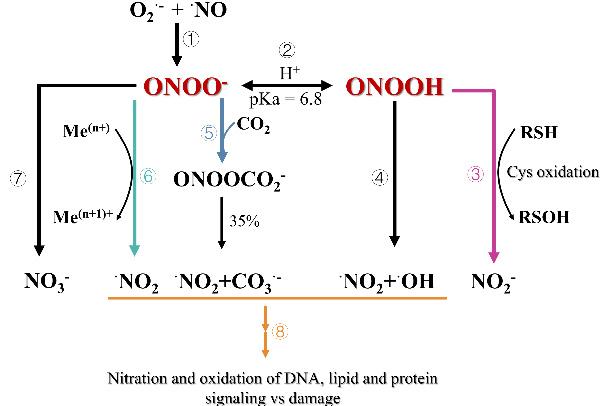
1 引言
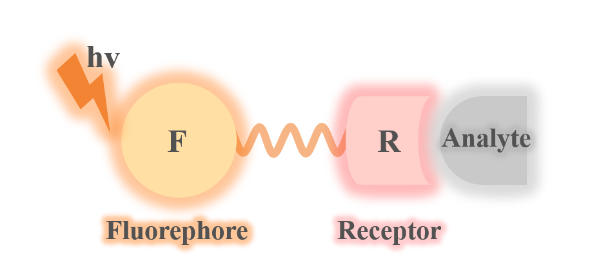
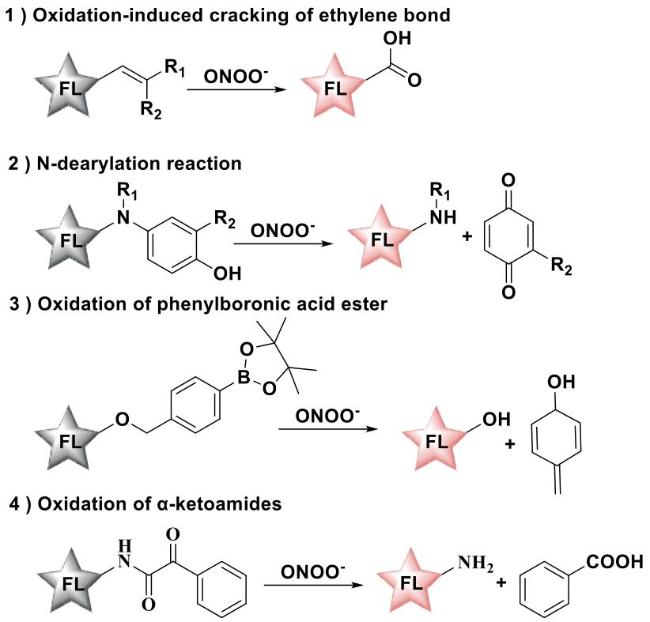
2 ONOO-荧光探针的设计策略
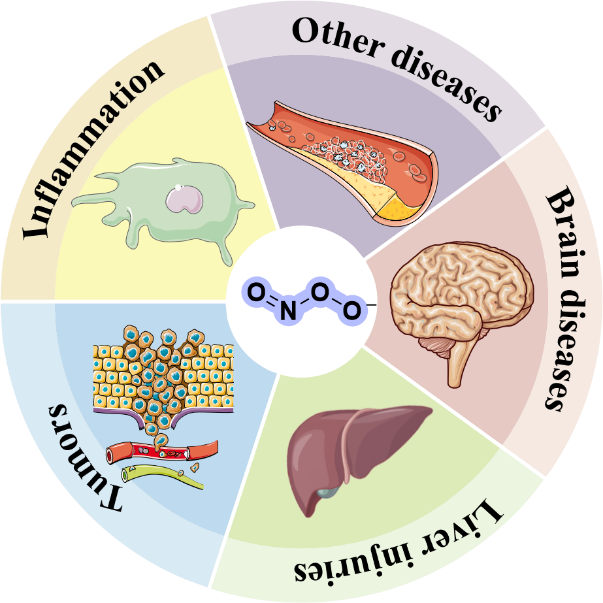
3 疾病相关过程中ONOO-的检测和成像
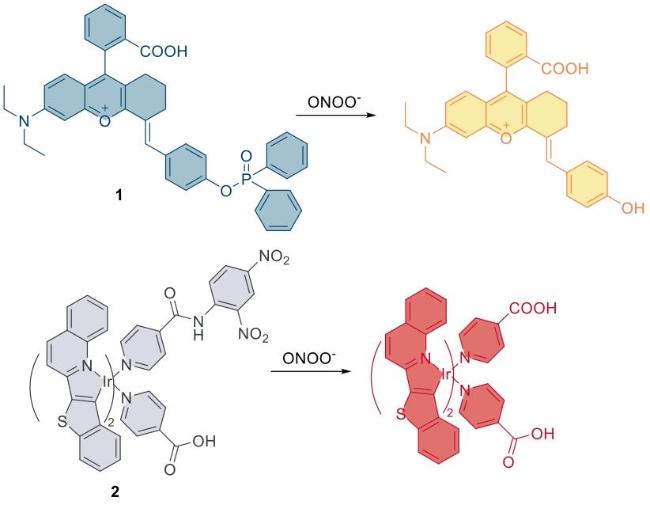
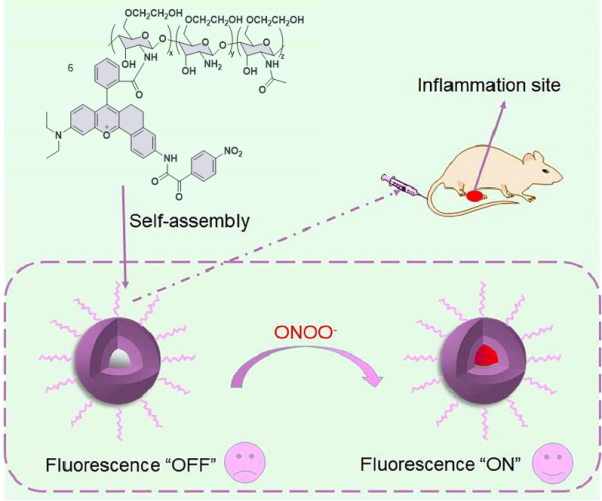
3.1 炎症中ONOO-的检测与成像
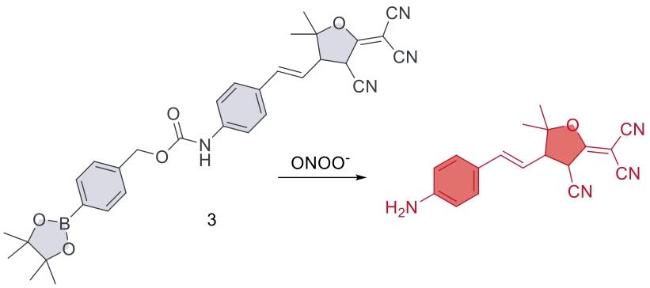
3.2 肿瘤中ONOO-的检测与成像
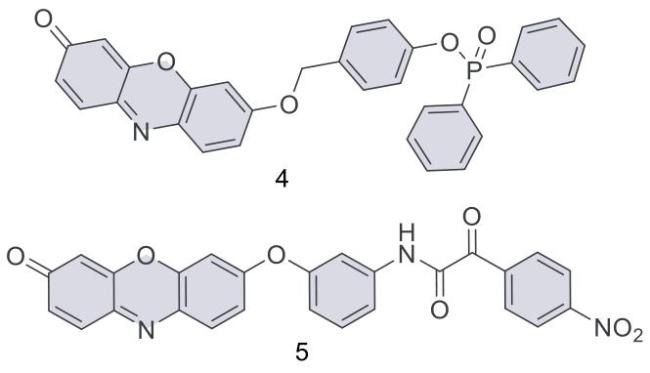
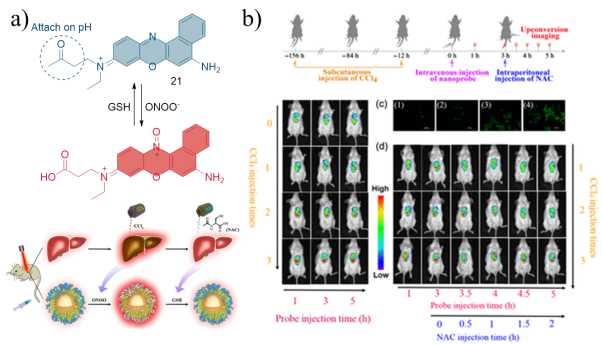
3.3 肝损伤中ONOO-的检测与成像
3.4 脑部疾病中ONOO-的检测与成像
3.5 其他疾病模型中ONOO-的检测与成像
4 结论与展望
表1 ONOO-荧光探针的相关参数Table 1 Related parameters of ONOO- fluorescent probes |
| Probe | Year | Test solution | λex/λem (nm) | Response time (s) | Detection range (μM) | LOD (nM) | Ref |
|---|---|---|---|---|---|---|---|
| 1 | 2016 | DMSO/PBS = 1:1 (v/v,pH = 7.4) | 670/742 | / | 0~40 | 400 | 33 |
| 2 | 2019 | DMSO/PBS = 1:19 (v/v,pH = 7.4) | 500/660 | / | 0~110 | 600 | 34 |
| 3 | 2020 | ACN/PBS = 3:20 (v/v,pH = 7.4) | 540/604 | 40 | 0~10 | 21 | 35 |
| 4 | 2021 | PBS (pH = 7.4,1% DMSO,3 mM CTAB) | 525/590 | 600 | 0~35 | 238 | 36 |
| 5 | 2022 | PBS (pH = 7.4,1% DMSO,3 mM CTAB) | 525/590 | < 300 | 0~30 | 220 | 37 |
| 6 | 2023 | PBS (pH = 7.4) | 570/628 | 60 | 0~1 | 33 | 38 |
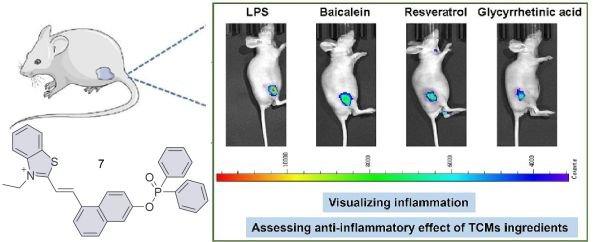
| 7 | 2024 | PBS (pH = 7.4,1% DMSO) | 381/518 | 120 | 0~5×107 | 8.03 | 39 |
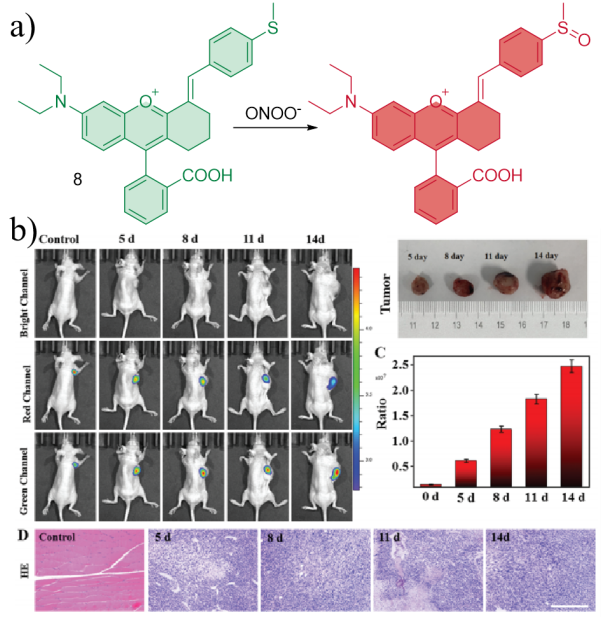
| 8 | 2021 | PBS (pH = 7.4,1% DMSO) | 548/662 | < 5 | 0~26 | 2.6×104 | 43 |
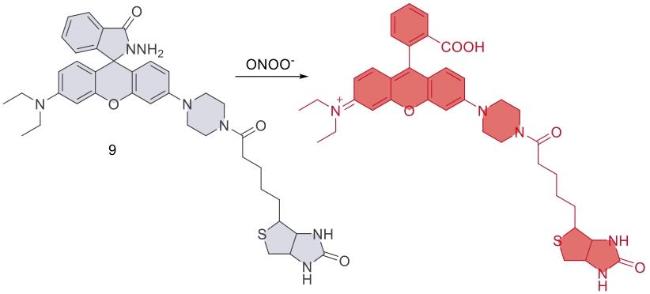
| 9 | 2021 | PBS (pH = 7.4) | 530/545-750 | 5 | 0~10 | 7 | 44 |
| 10 | 2020 | PBS (pH = 7.4,10% DMSO) | 560/652 | < 180 | 0.5~20 | 72 | 45 |
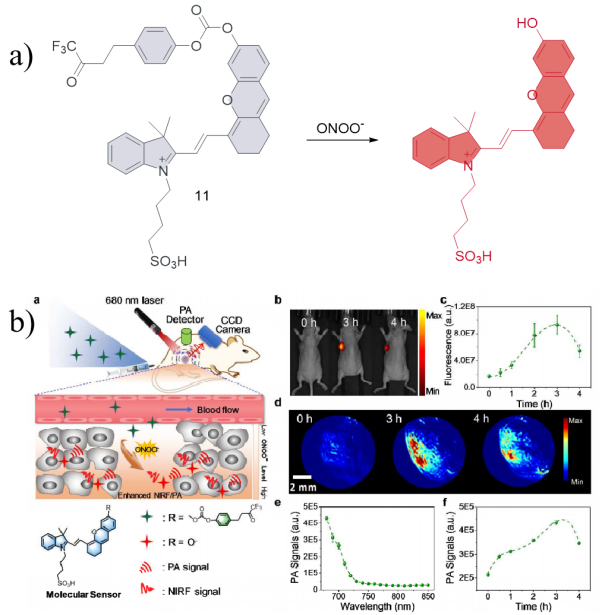
| 11 | 2018 | PBS (pH = 7.4) | 675/712 | / | 50~100 | 53 | 46 |
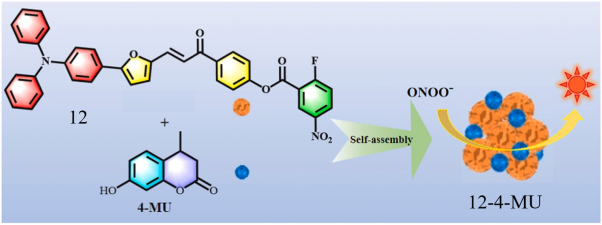
| 12 | 2023 | ACN/PBS = 4:6 (v/v,pH = 7.4) | 450/555 | / | 0~14,0~90 | 123,40 | 47 |
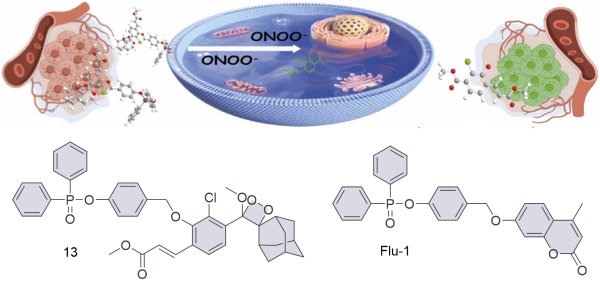
| 13 | 2024 | DMSO/PBS = 1:9 (v/v,pH = 7.4) | 400/550 | 600 | 0~2.5×105 | 9.8,98 | 48 |
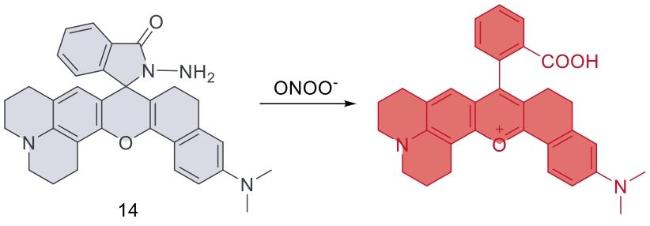
| 14 | 2021 | PBS (pH = 7.4) | 620/660 | 10 | 0.05~10 | 15 | 53 |
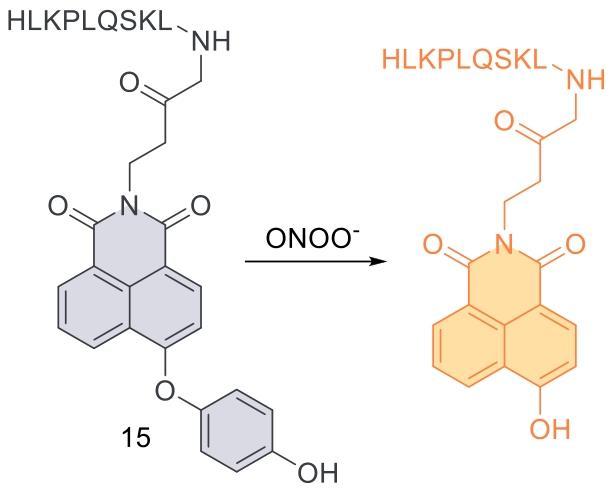
| 15 | 2016 | PBS (pH = 8.2) | 405/553 | / | 0~10 | 6.2 | 54 |
| 16 | 2019 | PBS (pH = 7.4) | 440/500,720 | / | 500~1.5×104 | 1.7×105 | 55 |
| 17 | 2020 | PBS (pH = 7.4,40% DMSO) | 420/635 | 300 | 0~1 | 1.69 | 56 |
| 18 | 2024 | PBS (pH = 7.4,30% DMSO) | 518/655 | 2 | 0~28 | 27 | 57 |
| 19 | 2020 | EtOH/PBS = 2:9 (v/v,pH = 7.4) | 405/469,703 | 25 | 0~7 | 4.1 | 58 |
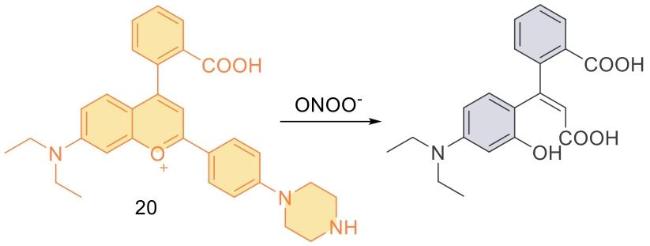
| 20 | 2023 | Purified water | 580/638 | 19 | / | 9.36 | 59 |
| 21 | 2022 | PBS (pH = 7.4,1% Ethanol) | 550/600 | < 10 | / | / | 60 |
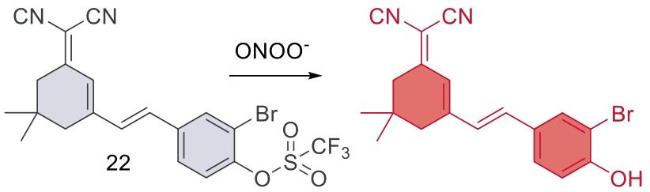
| 22 | 2024 | PBS (pH = 7.4,20% DMSO) | 500/655 | 600 | 20~40 | 65.8 | 61 |
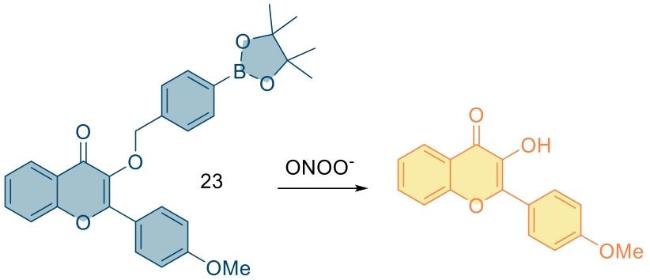
| 23 | 2018 | Tris-HCl (pH = 7.4) | 365/420,530 | / | 0~2 | 65.5 | 64 |
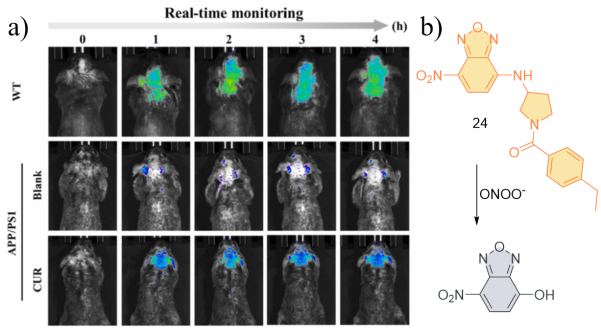
| 24 | 2024 | PBS (pH = 7.4,1% DMSO) | 474/544 | 3 | 0~38 | 11 | 65 |
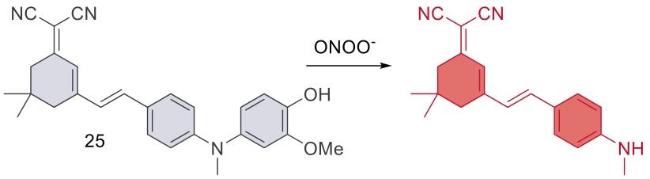
| 25 | 2020 | PBS (pH = 7.4,0.4% Tween 80) | 511/670 | < 5 | 0~15 | 3.3 | 66 |
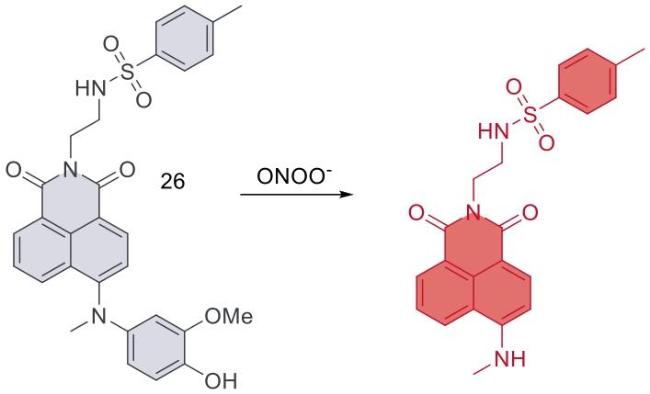
| 26 | 2021 | PBS (pH = 7.4,2% DMSO,0.4% Tween 80) | 450/540 | 25 | 0~5 | 8.3 | 67 |
| 27 | 2023 | PBS (pH = 7.4) | 350/490 | 60 | 0~3 | 9.89 | 68 |
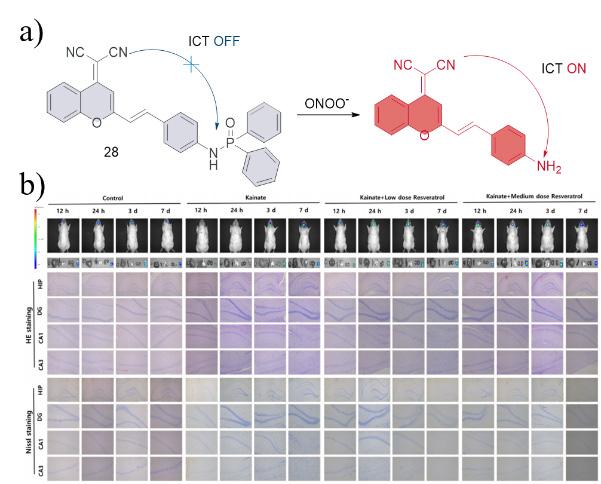
| 28 | 2021 | PBS (pH = 7.4,30% DMSO) | 520/685 | 600 | 0~20 | 96 | 69 |
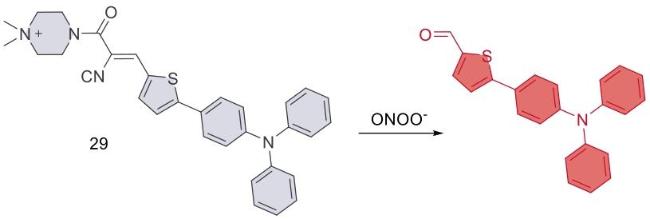
| 29 | 2023 | PBS (pH = 7.4,1% DMSO) | 425/548 | < 2 | 0~10 | 900 | 70 |
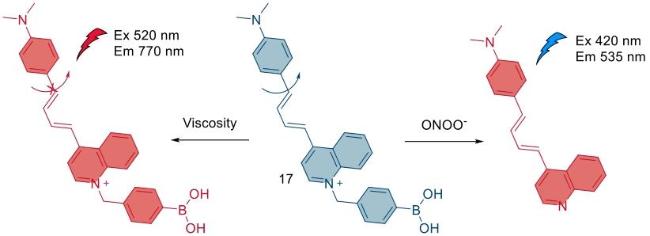
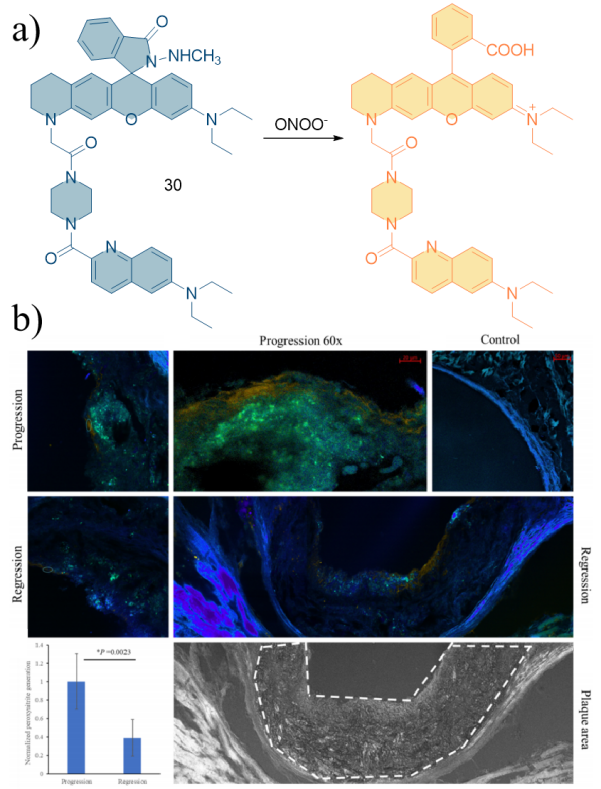
| 30 | 2021 | PBS (pH = 7.4,10% CH3CN) | 580/770 | < 120 | 0~10 | 330 | 71 |
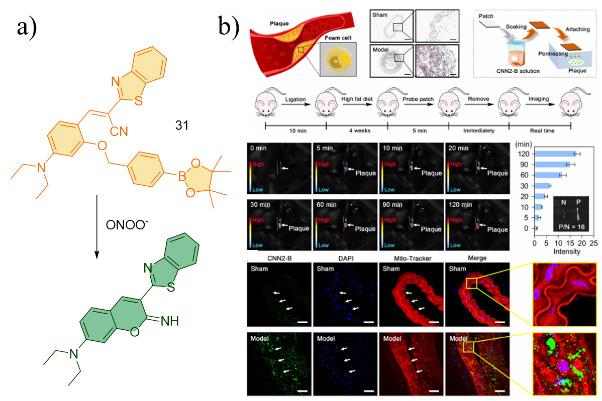
| 31 | 2023 | PBS | 365/474,574 | 120 | 4~10 | 1.33 | 72 |
表2 ONOO-荧光探针的病理信息Table 2 Pathological information of ONOO- fluorescent probes |
| Probe | Cell imaging | Tissue imaging | Disease models | Disease | Ref |
|---|---|---|---|---|---|
| 1 | RAW 264.7 | / | Mice were intraperitoneally injected with LPS and PMA | Inflammation | 33 |
| 2 | MCF-7 | / | Mice were intraperitoneally injected with LPS and PMA | Inflammation | 34 |
| 3 | CHO-KE | / | Zebrafish larvae were immersed in LPS | Inflammation | 35 |
| 4 | HepG2,RAW 264.7 | / | LPS was injected subcutaneously into the left leg of nude mice | Inflammation | 36 |
| 5 | HepG2,RAW 264.7,HeLa | / | LPS was injected subcutaneously into the right leg of nude mice | Inflammation | 37 |
| 6 | RAW 264.7 | / | LPS was injected subcutaneously into the left leg of mice | Inflammation | 38 |
| 7 | LO2,MCF-7 | / | LPS was injected subcutaneously into the hind legs of nude mice | Inflammation | 39 |
| 8 | RAW 264.7 | Tumor tissues | LPS induced acute peritonitis in mice Xenotransplantation of HepG2 tumor cells in nude mice | Tumor | 43 |
| 9 | Cal-27,HSC-2,MC3 | / | Xenotransplantation of HSC-2 tumor cells in nude mice | Tumor | 44 |
| 10 | HeLa,RAW 264.7 | Zebrafish pancreatic tissue | Subcutaneous transplantation of 4T1 tumor cells in nude mice | Tumor | 45 |
| 11 | RAW 264.7 | / | Subcutaneous transplantation of 4T1 tumor cells in nude mice | Tumor | 46 |
| 12 | RAW 264.7 | / | / | Tumor | 47 |
| 13 | HepG2,A549, SH-SY5Y,LO2 | Human liver cancer tissue | Xenotransplantation of HepG2 tumor cells into nude mice | Tumor | 48 |
| 14 | HeLa,RAW 264.7 | Mice liver tissue | APAP induced hepatotoxicity in mice | Liver injury | 53 |
| 15 | SMMC-7721,HL-7702 | Mice liver tissue | CCl4 induced acute liver injury in mice | Liver injury | 54 |
| 16 | HepG2,HCT116,HeLa ,MCF-7 | Mice liver tissue | APAP induced hepatotoxicity in mice | Liver injury | 55 |
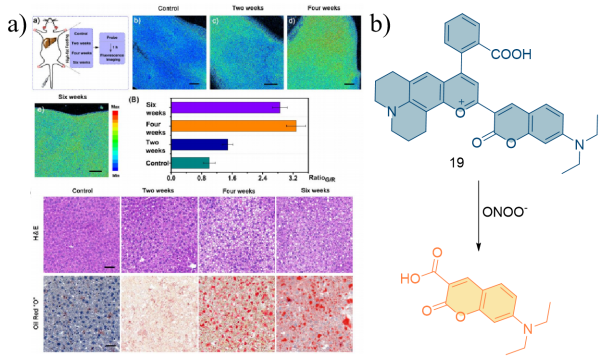
| 17 | HeLa | Mice liver tissue | APAP induced liver injury in mice LPS and IFN-γ stimulated zebrafish Subcutaneous injection of exogenous ONOO- mice | Liver injury | 56 |
| 18 | HepG2 | / | / | Liver injury | 57 |
| 19 | HepG2,LO2 | / | HFD induced nonalcoholic fatty liver mice | Liver injury | 58 |
| 20 | HepG2 | Mice liver tissue | APAP induced liver injury in mice | Liver injury | 59 |
| 21 | HepG2,RAW 264.7 | Mice liver tissue | CCl4 induced acute liver injury in mice | Liver injury | 60 |
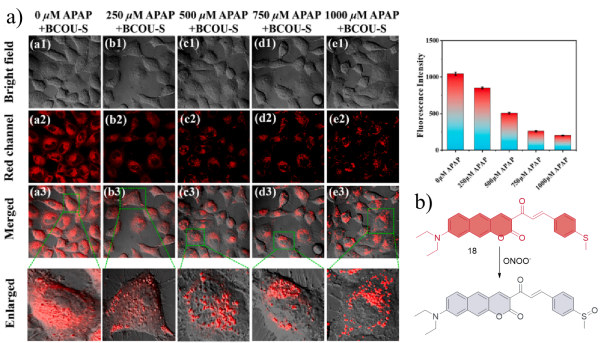
| 22 | LO2 | Mice liver tissue | APAP and INH induced ferroptosis-mediated drug induced liver injury in zebrafish and mice | Liver injury | 61 |
| 23 | / | Brain tissue of AD | AD transgenic mice | Neurodegenerative diseases | 64 |
| 24 | SH-SY5Y | Murine brain | APP/PS1 transgenic mice | Neurodegenerative diseases | 65 |
| 25 | PC12 | Drosophila brain tissues | MPTP induced Parkinson 's disease in mice LRRK2 overexpression constructed WLZ3 C.elegans Parkinson's disease | Neurodegenerative diseases | 66 |
| 26 | PC12 | / | LRRK2 overexpression constructed WLZ3 C.elegans Parkinson's disease | Neurodegenerative diseases | 67 |
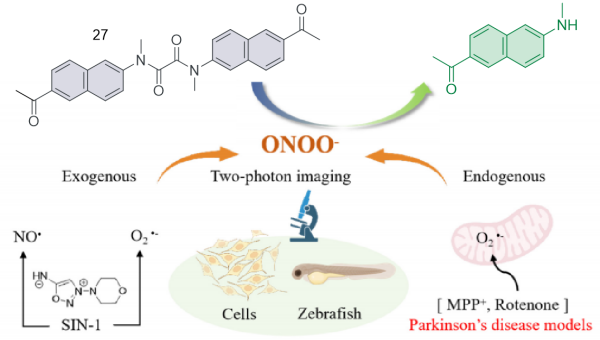
| 27 | SH-SY5Y | / | SIN-1 and MPP+ stimulated zebrafish | Neurodegenerative diseases | 68 |
| 28 | RAW 264.7,HT22 | Brain sections of epileptic rats | KA induced epilepsy in rats | Neurodegenerative diseases | 69 |
| 29 | U87MG | Glioblastoma tissue | Xenotransplantation of U87MG cells into the brain of nude mice | Neurodegenerative diseases | 70 |
| 30 | RAW 264.7 | Mouse aortic tissue | High fat fed low-density lipoprotein receptor knockout (Ldlr-/-) mice | Cardiovascular | 71 |
| 31 | A549,RAW 264.7 | / | Carotid artery ligation combined with high-fat diet feeding ApoE gene-deficient mice | Cardiovascular | 72 |