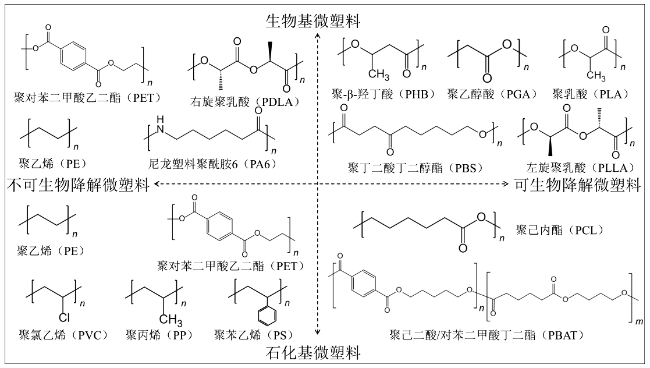
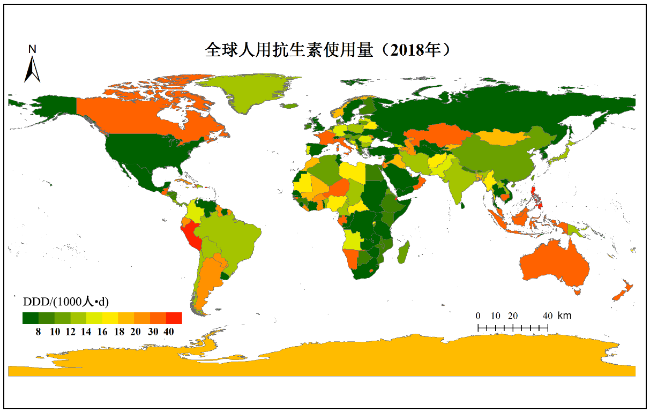
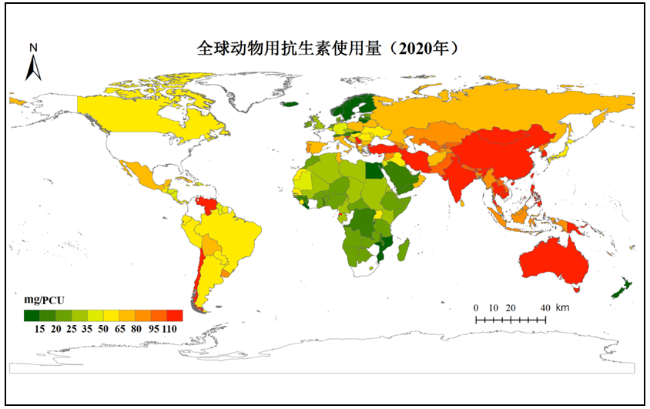
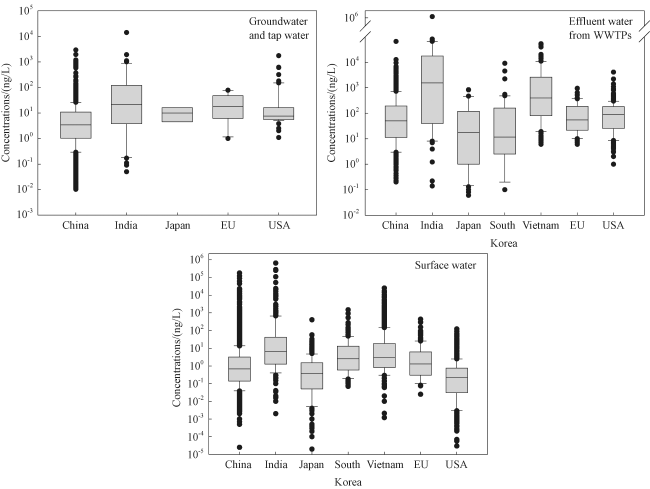
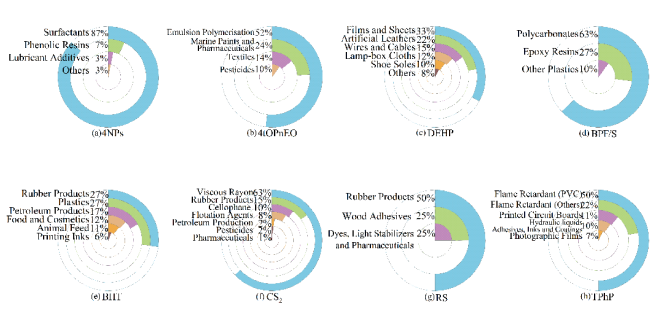
1 新污染物的概念、种类和特征
1.1 新污染物的定义及基本特征
表1 《2023年重点管控新污染物清单》中列出的14种化学品[10]Table 1 Fourteen types of chemicals listed in 2023 List of Key Controlled New Pollutants[10] |
| 编号 | 新污染物名称 | 新污染物英文名称 | CAS号 |
|---|---|---|---|
| 1 | 全氟辛基磺酸及其盐类和全氟辛基磺酰氟(PFOS类) | Perfluorooctanesulfonic acid (PFOS) and its salts, and perfluorooctanesulfonyl fluoride (PFOSF) (PFOS group) | 1763-23-1 307-35-7 2795-39-3 29457-72-5 29081-56-9 70225-14-8 56773-42-3 251099-16-8 |
| 2 | 全氟辛酸及其盐类和相关化合物(PFOA类) | Perfluorooctanoic acid (PFOA) and its salts and related compounds (PFOA group) | ― |
| 3 | 十溴二苯醚 | Decabromodiphenyl ether | 1163-19-5 |
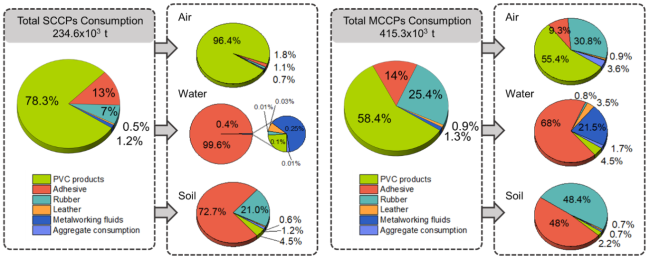
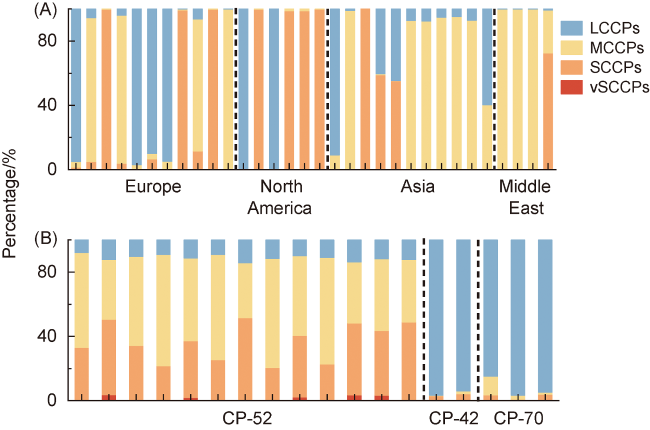
| 4 | 短链氯化石蜡 | Short-chain chlorinated paraffins(SCCPs) | 85535-84-8 68920-70-7 71011-12-6 85536-22-7 85681-73-8 108171-26-2 |
| 5 | 六氯丁二烯 | Hexachlorobutadiene | 87-68-3 |
| 6 | 五氯苯酚及其盐类和酯类 | Pentachlorophenol and its salts and esters | 87-86-5 131-52-2 27735-64-4 3772-94-9 1825-21-4 |
| 7 | 三氯杀螨醇 | Dicofol | 115-32-2 10606-46-9 |
| 8 | 全氟己基磺酸及其盐类和相关化合物(PFHxS类) | Perfluorohexanesulfonic acid (PFHxS) and its salts and related compounds (PFHxS group) | ― |
| 9 | 得克隆及其顺式异构体和反式异构体 | Dechlorane plus (both cis and trans isomers) | 13560-89-9 135821-03-3 135821-74-8 |
| 10 | 二氯甲烷 | Dichloromethane | 75-09-2 |
| 11 | 三氯甲烷(氯仿) | Chloroform | 67-66-3 |
| 12 | 壬基酚 | Nonylphenols | 25154-52-3 84852-15-3 |
| 13 | 抗生素 | Antibiotics | ― |
| 14 | 已淘汰类:六溴环十二烷、氯丹、灭蚁灵、六氯苯、滴滴涕、α-六氯环己烷、β-六氯环己烷、林丹、硫丹原药及其相关异构体、多氯联苯 | Hexabromocyclododecane (HBCD)、Chlordane、Mirex、Hexachlorobenzene、Dichlorodiphenyltrichloroethane (DDT)、α-Hexachlorocyclohexane (α-HCH)、β-Hexachlorocyclohexane (β-HCH)、Lindane、Endosulfan (as a raw material and its isomers)、Polychlorinated biphenyls (PCBs) | ― |
1.2 典型新污染物
1.2.1 全氟化合物
1.2.2 溴系阻燃剂
表2 各类环境介质和生物样品中 BFRs 的浓度[55]Table 2 Concentrations of BFRs in environmental matrices and biota samples[55] |
| BFRs | Soil(dw)/ (ng/g) | Sediment(dw)/ (ng/g) | Water/ [ng/(g/mL)] | Air/ (ng/cm3) | Dust(dw)/ (ng/g) | Fish(ww)/ (ng/g) | Bird(ww)/ (ng/g) |
|---|---|---|---|---|---|---|---|
| TBBPA | 651.34±1.21E+03 (n=14) | 1.19E+03±7.05E+03 (n=39) | 0.27±0.51 (n=20) | 8.00E-08 (n=1) | 6.62E+04±3.26E+05 (n=34) | 5.61±17.21 (n=12) | NA (n=0) |
| HBCD | 1.65E+03±5.43E+03 (n=55) | 104.21E+02±334.23 (n=97) | 0.13±0.33 (n=31) | 5.37E-04±3.94E-03 (n=82) | 1.25E+04±4.32E+04 (n=129) | 14.92±59.34 (n=43) | 3.24±7.66 (n=32) |
| DBDPE | 2.38E+03±7.21E+03 (n=31) | 83.41±44.92 (n=48) | 700.31±200.21 (n=9) | 4.40E-06±1.87E-05 (n=48) | 1.55E+04±5.56E+04 (n=78) | 0.74±1.41 (n=11) | 0.41±0.39 (n=11) |
| BTBPE | 341.32±7.22E+03 (n=27) | 230.12±259.53E+02 (n=45) | 1.60E-03±0.2 (n=6) | 1.41E-06±4.19E-05 (n=39) | 7.07E+03±5.65E+04 (n=42) | 0.37±1.41 (n=7) | 6.34±0.39 (n=6) |
| HBB | 15.91±47.82 (n=22) | 1.86±4.32 (n=27) | 0.02E-02±2.57E-03 (n=12) | 1.04E-06±4.52E-06 (n=42) | 674.32±2.45E+03 (n=32) | 0.92±0.11 (n=11) | 0.97±0.93 (n=6) |
| TBB | 1.17±2.73 (n=15) | 9.95E+00±1.93E+03 (n=14) | 2.02E-03±1.29E-03 (n=11) | 1.82E-06±8.68E-06 (n=30) | 2.99E+03±1.69E+04 (n=42) | 1.46 (n=1) | 0.38±0.36 (n=6) |
| PBT | 21.32±72.83 (n=9) | 0.22±0.13 (n=15) | 1.81E-03±1.19E-03 (n=3) | 2.04E-07±8.53E-07 (n=23) | 52.52E+01±141.12 (n=19) | 72.71±35.23 (n=11) | 5.98±13.01 (n=6) |
| TBPH | 41.93±124.15 (n=17) | 44.92±133.12 (n=11) | 3.56E-03±2.51E-04 (n=9) | 9.57E-07±2.61E-06 (n=24) | 2.51E+03±7.20E+03 (n=50) | 14.91 (n=1) | 1.46±1.37 (n=6) |
| PBEB | 1.71±1.77 (n=17) | 3.34±13.01 (n=15) | 6.51E-04±2.85E-04 (n=8) | 1.71E-07±7.87E-07 (n=34) | 18.21±47.71 (n=23) | 2.63±3.45 (n=5) | 1.23±2.54 (n=6) |
| TBECH | 0.18±1.13 (n=2) | 23.81±43.82 (n=5) | 8.55E-04±1.54E-04 (n=3) | 2.85E-08±2.02E-08 (n=7) | 23.31±23.52 (n=8) | 2.42±1.57 (n=2) | 3.90 (n=1) |
Note:The data in the table represent the average concentrations of BFRs in different substrates ± standard deviation; dw is dry matter, and ww is wet matter. |
1.2.3 氯化石蜡
1.2.4 环境内分泌干扰物
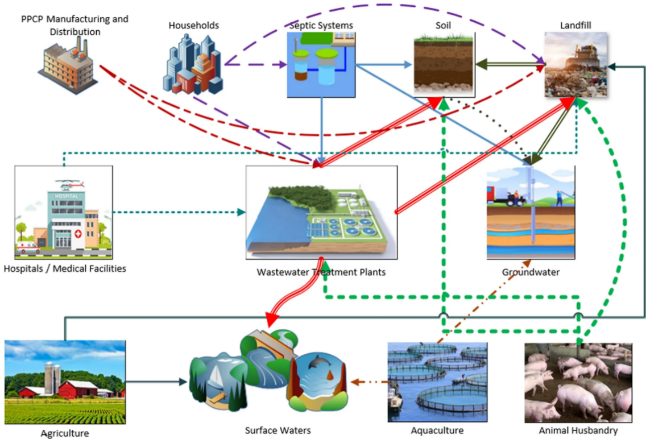
1.2.5 药品和个人护理品
1.2.5.1 PPCPs的污染特征及水平
1.2.5.2 PPCPs的生态及健康风险
1.2.5.3 PPCPs的分析与去除
1.2.6 微塑料
1.2.6.1 微塑料定义和分类
1.2.6.2 微塑料环境分布和丰度
1.2.6.3 环境微塑料特征及效应
1.2.7 抗生素及抗性基因
1.3 新污染物的研究中面临的科学问题
2 新污染物的生产、使用与排放
2.1 POPs的生产、使用与排放
2.1.1 有机氯POPs
2.1.2 有机溴POPs
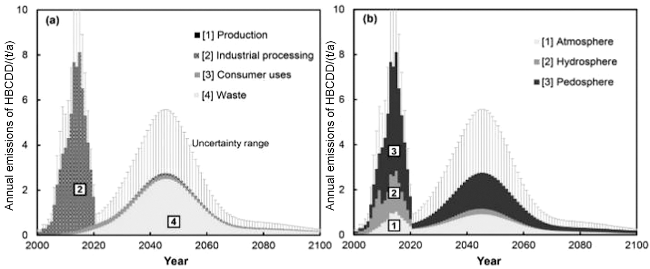
图9 基于动态物质流分析与多介质环境归趋模拟的中国HBCD的全生命周期排放估算:(a)生产、加工、使用和废物过程的排放;(b)向大气、水和土壤的排放[192]Fig. 9 Estimation of emissions of HBCD in China based on dynamic material flow analysis and multimedia environmental fate models: (a) emissions from production, processing, use and waste, (b) emissions to atmosphere, water and soil, redrawn from Li et al [192] |
2.1.3 有机氟POPs
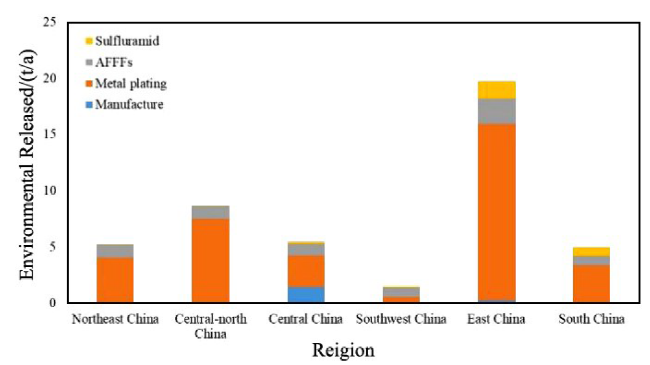
图10 中国各地区电镀、消防和农药行业PFOS环境排放量分布[204]Fig. 10 The distribution of environmental releases of PFOS in metal plating, aqueous film forming foams (AFFFs) and sulfluramid in China[204]Note: Northeast China includes Liaoning, Jilin, Heilongjiang Provinces, Central-north China includes Beijing, Tianjin, Hebei, Shanxi, Shaanxi Provinces, Central China includes Henan, Hubei, Hunan Provinces, Southwest China includes Chongqing, Sichuan, Guizhou, Yunnan Provinces, East China includes Shanghai, Jiangsu, Zhejiang, Anhui, Fujian, Jiangxi, Shandong Provinces, South China includes Guangdong, Guangxi, Hainan Provinces. |
2.1.4 无卤素POPs
2.2 抗生素的生产、使用与排放
2.2.1 抗生素的生产和使用
2.2.2 抗生素的排放与污染浓度
表3 全球水环境中各类别抗生素质量浓度水平Table 3 Concentrations of different types of antibiotic in the global water environment (average (minimum maximum)) ng/L |
| Kind | Countries and regions | Macrolides | Quinolones | Sulfonamides | Tetracyclines | β-lactams | Others |
|---|---|---|---|---|---|---|---|
| Effluent water from WWTPs | China | 419 (0.20~6770) | 285 (0.29~6840) | 518 (0.21~ 65400) | 148 (0.56~2210) | 463 (3.18~5000) | 137 (0.70~3050) |
| EU | 239 (13.0~930) | 168 (6.00~640) | 97.2 (7.00~ 950) | 22.8 | — | 46.0 (13.0~102) | |
| India | 55.4 (3.92~187) | 526552 (0.14×107~1.40×107) | 7468 (10.6~ 81100) | — | 29453 (0.22~59500) | 1072 (6.96~3800) | |
| Japan | 209 (0.25~836) | 145 (3.00~819) | 62.4 (0.06~ 470) | 58.6 (58.6~58.6) | — | — | |
| South Korea | 766 (0.20~9089) | — | 72.7 (0.10~ 483) | 575 (0.10~4517) | — | — | |
| Thailand | 15.5 (4.00~42.8) | 45.9 (9.28~ 89.0) | 108 (5.00~ 1499) | — | 34.5 (9.28~97.5) | 10 | |
| USA | 66.8 (1.00~219) | 142 (3.20~900) | 227 (1.00~ 4100) | 111 (15.4~231) | 66.7 (0.21~308) | 126 (4.50~598) | |
| Vietnam | 800 (200~ 2200) | 11414 (600~ 53300) | 3057 (38.0~ 20300) | — | 3800 (2600~5000) | 16711 (100~130400) | |
| Surface water | Australia | 12.8 (1.00~50.0) | 443 (10.0~1500) | 428 (3.00~ 2000) | 219 (3.00~600) | 2095 (90.0~4100) | 2.25 (1.00~4.00) |
| Bangladesh | 2.64 (0.10~16.7) | — | 2.27 (0.04~ 17.2) | — | — | 2.74 (0.05~13.5) | |
| China | 648 (0.01~447000) | 3339 (0.003~ 1793000) | 1071 (0.01~ 893000) | 1371 (0.03~218100) | 17.0 (0.06~300) | 25.6 (0.03~1042) | |
| EU | 48.3 (0.25~793) | 276 (1.50~4390) | 46.3 (0.25~ 544) | — | — | — | |
| India | 109 (0.10~991) | 141948 (0.16~ 6500000) | 383 (0.40~ 4000) | 14.9 | 14.6 (0.18~29.1) | 46.0 (0.02~130) | |
| Indonesia | 71.8 (1.00~399) | — | 88.7 (1.00~ 779) | 3.00 (1.00~8.00) | — | — | |
| Japan | 32.4 (0.002~560) | 52.1 (0.50~ 4068) | 12.1 (0.01~ 151) | — | — | — | |
| Korea | 98.3 (1.10~2190) | 87.6 (20.0~151) | 248 (0.70~ 14850) | 686 (11.3~2750) | — | 38.4 (27.1~53.8) | |
| Malaysia | 78.4 (0.60~166) | 193 (112~267) | 34.7 (1.20~ 102) | — | 2.00 (1.00~3.00) | 20.9 (16.6~23.1) | |
| Singapore | 494 (0.70~1949) | 3496 | 371 (2.60~ 1172) | 4040 (1233~6434) | 3746 | 20730 | |
| Thailand | 1881 (1.00~21442) | 1839 (9.00~ 45600) | 430 (0.76~ 4605) | 1422 (2.00~6290) | — | — | |
| USA | 0.5 (0.0003~15.0) | 75.7 (0.0006~ 1227) | 12.8 (0.004~ 520) | 171 (0.67~690) | 22.9 (2.71~43.1) | 4.94 (0.0021~68.0) | |
| Vietnam | 459 (0.10~55097) | 3947 (0.10~ 85190) | 1746 (0.012~ 252082) | 94.5 (0.90~900) | 556 (10.0~5051) | 25.0 (3.00~83.0) | |
| Groundwater and tap water | China | 63.3 (0.01~2910) | 15.2 (0.10~368) | 3.09 (0.02~120) | 10.9 (0.03~127) | — | 5.62 (0.13~36.7) |
| EU | 7.2 | 29.6 (1.00~ 77.2) | 6.1 | — | — | — | |
| India | 0.17 (0.11~0.24) | 726 (0.05~ 14000) | 14.7 (0.22~ 55.0) | 0.18 | — | 0.09 | |
| Japan | — | — | 12.1 (4.40~ 29.0) | — | — | — | |
| USA | — | 81.4 (1.09~ 1740) | 26.8 (2.48~ 178) | — | — | — |
Note:The data in the table represents "average (minimum - maximum)". |
2.3 内分泌干扰物的生产、使用与排放
2.3.1 EDCs的使用情况
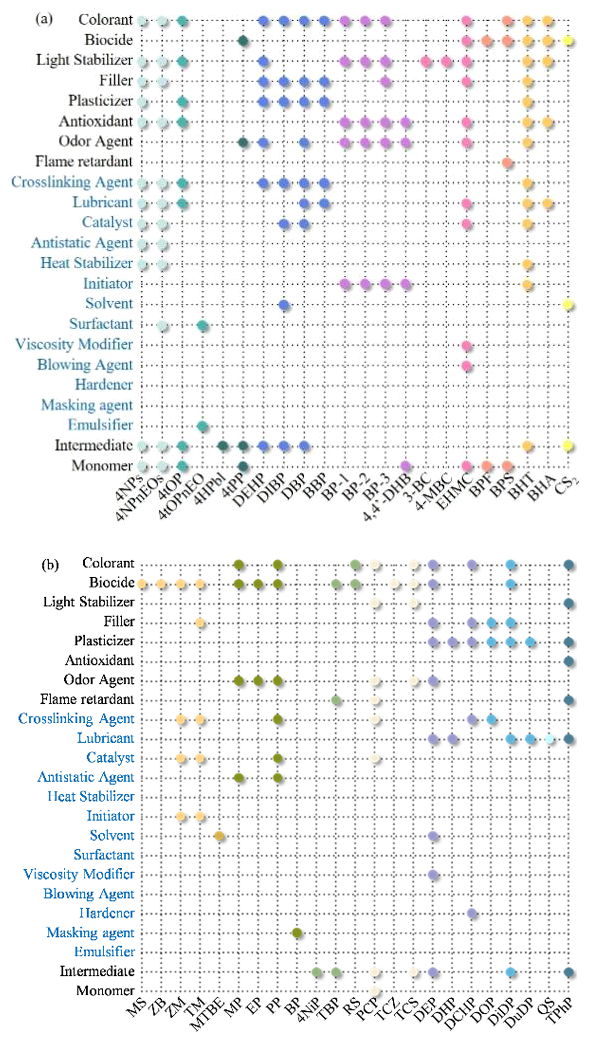
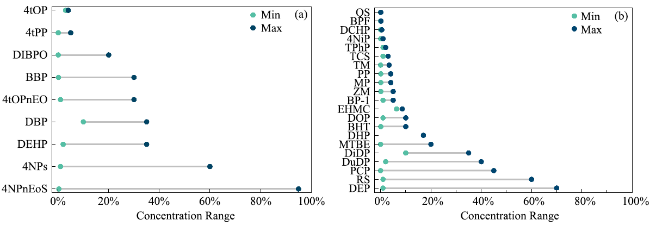
2.3.1.1 单体和中间体
2.3.1.2 加工助剂
2.3.1.3 添加剂
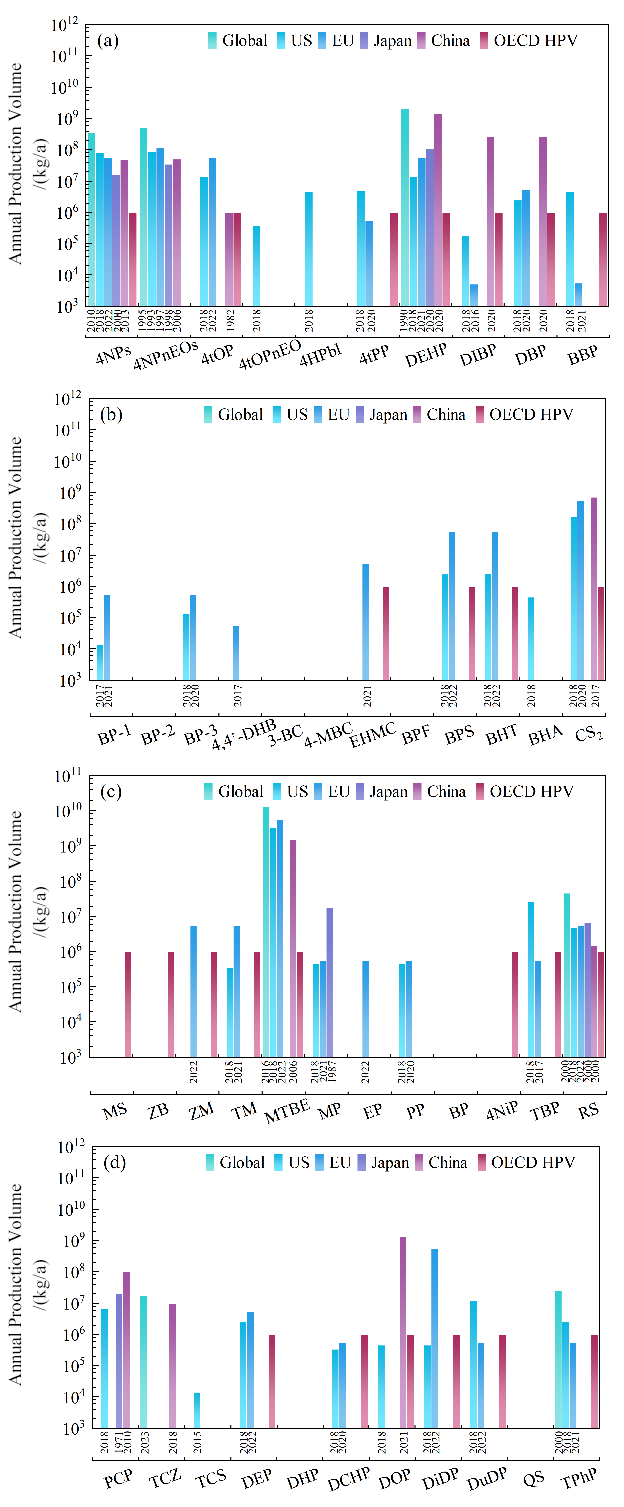
2.3.2 EDCs的生产情况
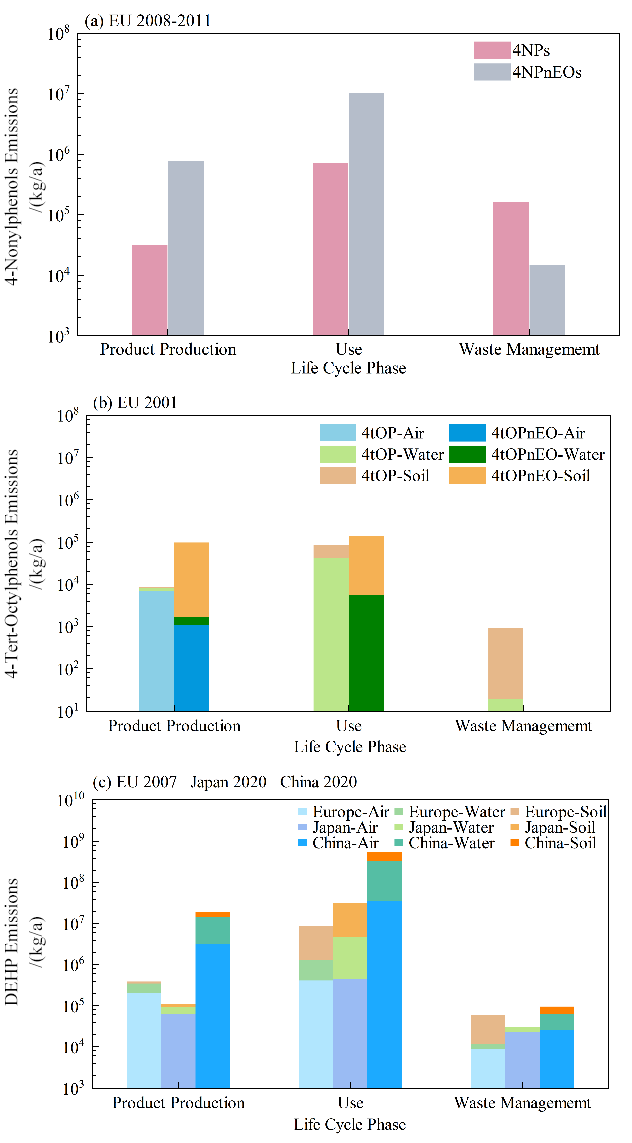
2.3.3 EDCs的释放情况
3 新污染物的识别与鉴定
3.1 新污染物识别与鉴定的非靶向分析技术
3.1.1 前处理技术
3.1.2 仪器分析技术
3.1.2.1 高分辨质谱
3.1.2.2 扫描方式
3.1.2.3 离子源:种类以及参数设置基本原则
3.2 新污染物识别与鉴定的数据解析技术
3.2.1 质谱数据处理
3.2.1.1 清单筛查策略
表4 常见的数据库清单信息Table 4 Available database and lists for emerging contaminant |
| database | quantity/types | website |
|---|---|---|
| NORMAN | 111769 | www.norman-network.com/?q=node/236 |
| REACH2017 | 68679 | zenodo.org/record/4248826 |
| US EPA Chemicals Dashboard | ~800 000(311 sub-lists) | comptox.epa.gov/dashboard/chemical_lists |
| IECSC | 45612 | www.mee.gov.cn/gkml/hbb/bgg/201301/t20130131_245810.htm |
| TSCA | 86718 | www.epa.gov/tsca-inventory/how-access-tsca-inventory |
| Tox21 | 7632 | ncats.nih.gov/tox21 |
| ToxCast | 5231 | comptox.epa.gov/dashboard/chemical_lists/CHEMIN |
表5 常见转化产物清单生成平台Table 5 Available software to generate transformation products |
| software | predicted transformation categories | website |
|---|---|---|
| EAWAG-PPS | microbial metabolism | eawag-bbd.ethz.ch/predict/ |
| enviPath | microbial metabolism | envipath.org/ |
| Biotransformer | microbial and mammalian metabolism | biotransformer.ca |
| Meteor Nexus | mammalian metabolism | www.lhasalimited.org/ |
| CTS | microbial metabolism,abiotic transformation | qed.epa.gov/cts/ |
| QSAR Toolbox | microbial and mammalian metabolism、abiotic transformation | qsartoolbox.org/ |
3.2.1.2 结构特征导向分析策略
3.2.1.3 知识导向分析策略
3.2.2 质谱数据的结构鉴定
3.2.2.1 结构鉴定置信水平
3.2.2.2 二级谱图库检索
3.2.2.3 结构预测软件
3.3 新污染物识别与鉴定技术应用
3.3.1 污染物新结构的发现
3.3.2 新污染物分子转化过程解析
3.3.3 基于效应导向分析的新污染物识别与诊断
3.4 展望
4 环境水平与分布特征
4.1 新污染物的区域分布特征
4.1.1 呈现明显的区域聚集性
4.1.2 与行业类型分布密切相关
4.2 新污染物的环境介质赋存特征
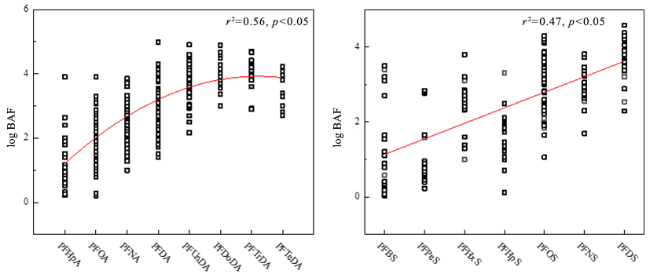
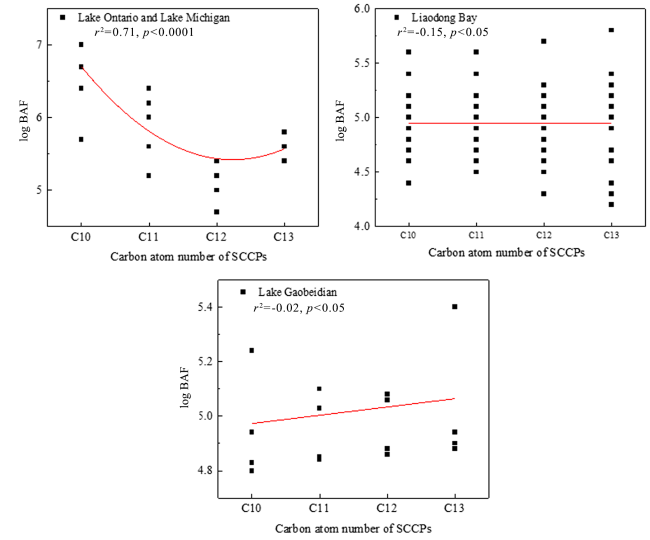
4.3 新污染物的生物富集和累积效应
表6 室内暴露实验测定的不同碳链全氟羧酸在鱼不同组织中的生物浓缩因子(log BCF)Table 6 Bioconcentration factors of PFCAs of different carbon chains in different tissues of fish as measured by indoor exposure experiments |
Compounds | Silver carp | Grass carp | Rainbow trout | Fathead minnow | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Muscle | Liver | Kidney | Blood | Bile | Muscle | Liver | Kidney | Blood | Bile | |||
| PFBA | 1.5 | 2.0 | 1.9 | 2.3 | 1.7 | 1.7 | 2.1 | 2.2 | 2.7 | 1.7 | ||
| PFPeA | 1.0 | 1.8 | 1.8 | 1.8 | 2.5 | 1.1 | 1.4 | 1.9 | 1.8 | 2.0 | -0.2 | |
| PFHxA | 1.7 | 2.6 | 2.8 | 2.5 | 2.5 | 1.4 | 2.7 | 2.9 | 2.6 | 2.5 | -0.2 | |
| PFHpA | 1.8 | 2.6 | 2.8 | 2.8 | 2.7 | 2.1 | 2.6 | 2.8 | 2.8 | 2.8 | -0.2 | |
| PFOA | 1.3 | 1.7 | 1.7 | 2.1 | 2.0 | 1.2 | 1.8 | 1.9 | 2.4 | 2.1 | 0.6 | 0.3 |
| PFNA | 2.8 | 3.5 | 3.5 | 3.9 | 3.6 | 2.5 | 3.5 | 3.6 | 4.1 | 3.7 | ||
| PFDA | 3.4 | 4.1 | 4.2 | 4.5 | 3.6 | 3.6 | 4.4 | 4.5 | 5.1 | 3.9 | 2.7 | |
| PFUnDA | 3.4 | |||||||||||
| PFDoDA | 3.8 | 5.1 | 5.2 | 5.5 | 4.2 | 4.1 | 5.3 | 5.5 | 6.0 | 4.4 | 4.3 | |
| PFTrDA | 4.1 | 5.3 | 5.5 | 5.7 | 4.4 | 4.2 | 5.4 | 5.6 | 6.1 | 4.6 | ||
| PFTeDA | 3.8 | 5.0 | 5.1 | 5.4 | 4.6 | 3.7 | 4.9 | 5.1 | 5.6 | 4.8 | 4.4 | |
5 新污染物的环境迁移转化、源汇机制
5.1 水环境中新污染物的多介质过程与归趋
5.1.1 水中新污染物的来源
5.1.2 水中新污染物的迁移与分配
5.1.2.1 水动力条件
5.1.2.2 吸附和分配
5.1.3 水中新污染物的生物与非生物转化
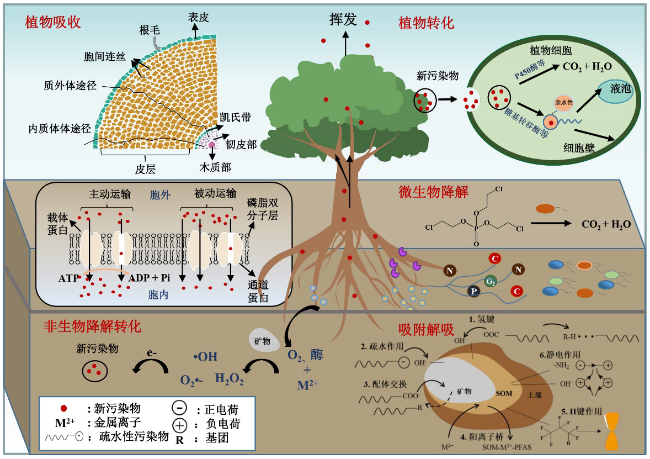
5.2 新污染物在土壤-植物系统中的迁移转化
5.2.1 新污染物在土壤-植物系统中的吸附与解吸
5.2.2 新污染物的植物吸收
5.2.3 新污染物的植物转化
5.2.4 新污染物的根际降解
5.2.5 植物介导新污染物的非生物降解转化
5.3 新污染物的大气环境过程
5.3.1 气-粒分配
5.3.2 大气转化
5.3.3 大气长距离迁移
5.3.4 干-湿沉降
5.4 新污染物区域环境归趋的数值模拟
5.4.1 多介质模型
表7 多介质模型汇总Table 7 Summary of multimedia models |
| 模型名称 | 稳态/ 动态 | 方法 | 尺度 | 已有研究应用 | 介质 | 文献来源 |
|---|---|---|---|---|---|---|
| QWASI | 动态 | 逸度 | 区域尺度(湖泊和河流系统) | 多环芳烃、抗生素、全氟和多氟烷基物质、微塑料 | 空气、水、土壤、沉积物 | 627⇓⇓⇓⇓⇓⇓~634 |
| MUM(SO-MUM) | 动态 | 逸度 | 区域尺度(城市系统) | 多氯联苯、多溴联苯醚、邻苯二甲酸酯、有机磷酸酯 | 空气、高空、土壤、植被、地表水、沉积物、有机膜 | 635⇓⇓⇓⇓~640 |
| MUM-Fate | 稳态 | 逸度 | 区域尺度(城市系统) | 多环芳烃 | 低层和高层空气、地表水、沉积物、土壤、植被和覆盖不渗透表面的有机膜 | 641 |
| BETR/BETR-Urban-Rural/BETR North America/BETR Global/Evn-BETR | 稳态/动态 | 逸度 | 全球、大陆、区域尺度 | 毒杀芬、γ-六氯环己烷(林丹)、多溴联苯醚、多环芳烃、六氯苯、十溴联苯醚、多氯联苯、多氟或全氟辛烷磺酸、十甲基环戊硅氧烷(D5) | 空气(高空、低空)、植被、土壤、淡水、淡水沉积物、海水、海水沉积物(BETR-UR城市土壤、农村土壤、城市空气、农村空气) | 642⇓⇓⇓⇓⇓⇓⇓⇓~651 |
| Globo-POP | 动态 | 逸度 | 全球尺度 | 毒杀芬、多氯联苯、多溴联苯醚、DDT、α-六氯环己烷 | 空气、水、土壤、沉积物 | 652⇓~654 |
| POPsME | 动态 | 逸度 | 区域尺度 | 多环芳烃、多氯二苯并对二口恶英/二苯并呋喃 | 空气、水、土壤、沉积物 | 655,656 |
| ChemRange | 稳态 | 逸度 | 全球尺度 | 多氯联苯 | 空气、土壤、水 | 657,658 |
| ChemCAN | 稳态 | 逸度 | 区域尺度 | 2,2',5,5'-四氯联苯(PCB 52)、四氯乙烯、多氯联苯、α-六氯环己烷、苯并[a]芘、六氯苯、莠去津 | 空气、水、土壤、沉积物 | 659 |
| CHEMFrance | 稳态 | 逸度 | 区域尺度 | γ-六氯环己烷(林丹)、莠去津 | 空气、地表水、土壤、底部沉积物、地下水、沿海水 | 660⇓⇓~663 |
| CliMoChem | 动态 | 逸度 | 全球尺度 | 多氯联苯、四氯化碳、α-六氯环己烷、灭蚁灵、莠去津 | 空气、水、土壤 | 657,664⇓ ~666 |
| ChimERA | 动态 | 逸度 | 通用模型 | 多氯联苯、多溴联苯醚 | 水、沉积物、大型植物、总悬浮颗粒物、溶解有机物 | 667,668 |
| EQC | 稳态 | 逸度 | 区域尺度 | 多氯联苯、六氯苯 | 空气、土壤、水、沉积物 | 669 |
| TaPL3 | 稳态 | 逸度 | 区域尺度 | 多氯联苯、六氯苯 | 空气、土壤、水、沉积物 | 670 |
| CoZMo-POP 2 | 动态 | 逸度 | 区域尺度 | POPs | 空气、森林冠层、森林土壤、土壤、水、沉积物 | 671,672 |
| NEM(基于CoZMo-POP 2和BETR-Global) | 动态 | 逸度 | 全球尺度 | 多氯联苯 | 空气、水、土壤、沉积物、植被 | 673 |
| G-CIEMS | 动态 | 逸度 | 大陆尺度 | 苯、二口恶英、1,3-丁二烯、除 草剂 | 空气、淡水、森林冠层、七种土地利用类型的土壤、海水、沉积物 | 674,675 |
| PeCHREM | 动态 | 逸度 | 大陆尺度 | 农药 | 空气、水、土壤 | 676,677 |
| DynAPlus | 动态 | 逸度 | 区域尺度 | 杀虫剂、杀菌剂 | 空气、垃圾、土壤、水 | 678,679 |
| CHEMGL | 稳态/ 动态 | 逸度 | 大陆、区域尺度 | 莠去津、苯并[ a ]芘、苯、六氯苯 | 平流层、对流层、空气边界层、地表水和沉积物、土壤、植被、地下水 | 680 |
| SoilFug | 动态 | 逸度 | 区域尺度 | 农药(异丙甲草胺、特丁基噻嗪、杀虫硫磷)、除草剂(阿特拉津、呋喃丹、乐果、异丙隆、γ-六氯环己烷(林丹)、司马津和氟乐灵) | 土壤和地表水 | 681⇓~683 |
| SoilPlus | 动态 | 逸度 | 通用模型 | 农药 | 空气、土壤、水 | 684,685 |
| RSEMM | 动态 | 逸度 | 区域尺度(京津地区河网系统) | 抗生素 | 空气、水、土壤、沉积物 | 686 |
| SMURF | 稳态 | 逸度 | 区域尺度(城市系统) | 多溴联苯醚、邻苯二甲酸酯 | 空气、水、土壤、沉积物、城市表面、室内空气、室内垂直表面加天花板、地板 | 687,688 |
| IMPACT North America/IMPACT 2002 | 稳态 | 逸度 | 大陆、区域尺度 | 五氯二苯并呋喃、多环芳烃、六氯苯 | 空气、水、土壤、沉积物、植被 | 689 |
| Pangea | 稳态 | 浓度 | 大陆尺度 | 三氯生、阴离子表面活性剂直链烷基苯磺酸盐、个人护理品防腐剂对羟基苯甲酸甲酯、润肤剂十甲基环五硅氧烷 | 空气、淡水沉积物、海水、淡水、自然土地和农田 | 690,691 |
| SimpleBox(更新至v4.0) | 稳态/ 动态 | 浓度 | 全球、大陆、区域尺度 | 多氯联苯、α-六氯环己烷、苯并[a]芘 | 空气、淡水和海水、淡水和海水沉积物、自然、农业和其他土壤 | 692⇓⇓~695 |
| SimpleBox4Nano/SimpleBox4Plastic(SB4P) | 动态 | 浓度 | 全球、大陆、区域尺度 | 纳米和微塑料 | 空气、地表水、沉积物、土壤 | 696 |
| ELPOS | 稳态 | 浓度 | 区域尺度 | 多溴联苯醚、多环芳烃、多氯联苯 | 空气、土壤、水、植被、沉积物 | 697 |
| SESAMe/SESAMe-Veg | 稳态 | 浓度 | 大陆、区域尺度 | PPCPs、有机磷酸酯、苯并[a]芘、苊、三氯生、二苯并呋喃 | 空气、淡水、沉积物、三种土壤、两种植被 | 698⇓⇓~701 |
| MAMI | 动态 | 活度 | 通用模型 | 农药(2,4-二氯苯氧基乙酸)、芳香胺苯胺、抗生素(甲氧苄啶(TMP)) | 空气、三种土壤、淡水、海水、淡水沉积物、海水沉积物 | 702 |
5.4.2 大气和海洋模式
5.4.3 水质和水文模式
5.4.4 机器学习模式
5.4.5 多圈层耦合模式
5.4.6 展望、局限和挑战
6 新污染物的生态毒理效应
6.1 全氟及多氟烷基化合物生态毒理
6.1.1 研究背景及意义
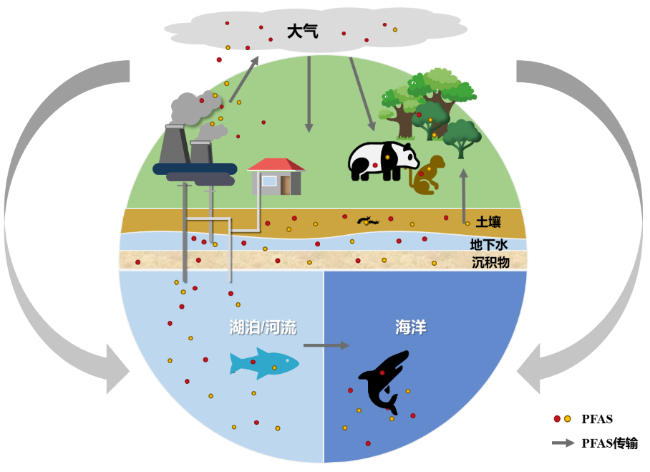
6.1.2 PFAS的环境分布
6.1.2.1 水体
6.1.2.2 大气
6.1.2.3 土壤及沉积物
6.1.2.4 植物
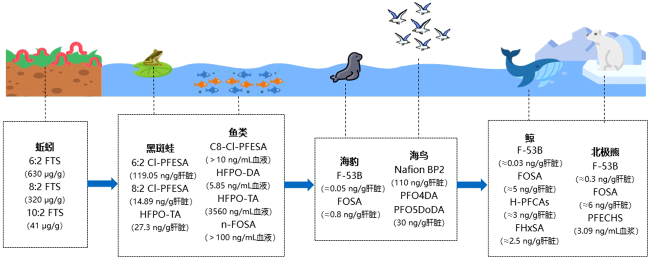
6.1.2.5 野生动物
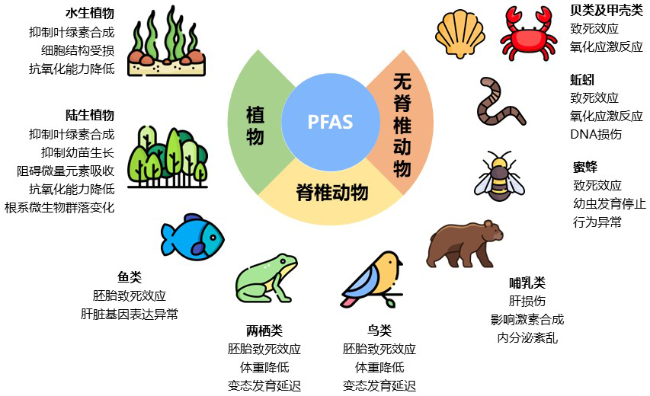
6.1.3 PFAS的生物毒性
6.1.3.1 植物
6.1.3.2 无脊椎动物
6.1.3.3 脊椎动物
6.1.4 结论与展望
6.2 有机磷酸酯生态毒理学
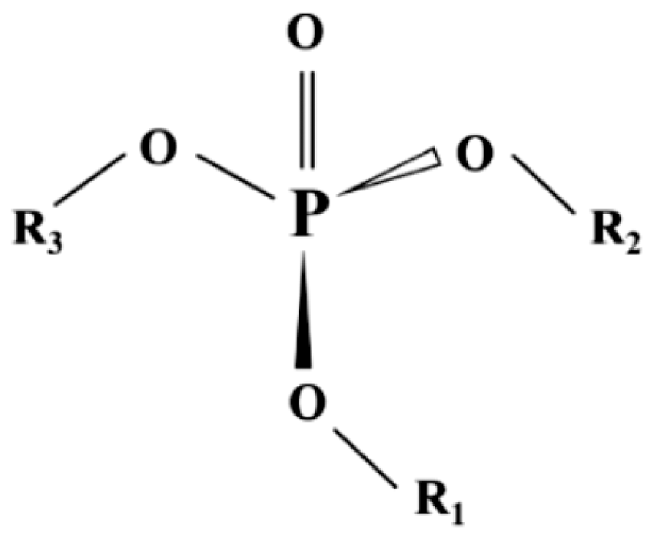
6.2.1 有机磷酸酯概述
表8 传统有机磷酸酯(T-OPEs)基本信息Table 8 Basic information of conventional OPEs(T-OPEs) |
| classification | English name | Chinese name | abbreviation | CAS | scheme |
|---|---|---|---|---|---|
| 烷烃类 OPES | Trimethyl phosphate | 磷酸三甲酯 | TMP | 512-56-1 | 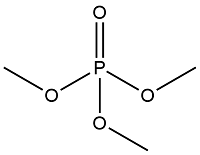 |
| Triethyl phosphate | 磷酸三乙酯 | TEP | 78-40-0 | 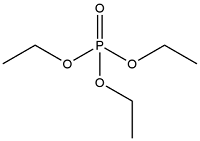 | |
| Tripropyl phosphate | 磷酸三丙酯 | TPrP | 513-08-6 | 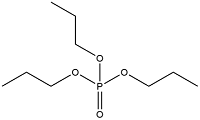 | |
| Triisopropyl Phosphate | 磷酸三异丙基酯 | TIPP | 513-02-0 | 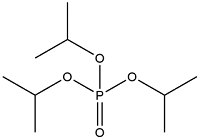 | |
| 烷烃类 OPES | Tributyl phosphate | 磷酸三丁酯 | TnBP | 126-73-8 | 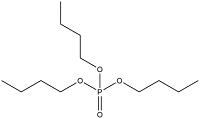 |
| Triisobutyl phosphate | 磷酸三异丁酯 | TIBP | 126-71-6 | 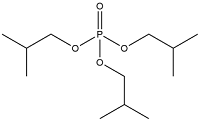 | |
| Tris(2-butoxyethyl) phosphate | 磷酸三(2-丁氧基乙基)酯 | TBOEP | 78-51-3 | 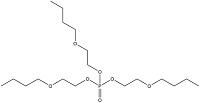 | |
| Tris(2-ethylhexyl) phosphate | 磷酸三(2-乙基己基)酯 | TEHP | 78-42-2 | 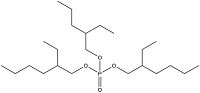 | |
| 氯代 OPEs | Tris(2-chloroethyl) phosphate | 磷酸三(2-氯乙基)酯 | TCEP | 115-96-8 | 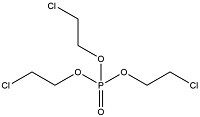 |
| Tris(2-chloroethyl) phosphate | 磷酸三(2-氯乙基)酯 | TCEP | 115-96-8 | 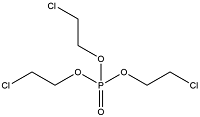 | |
| Tri(2-chloroisopropyl) phosphate | 三-(2-氯异丙基)磷酸酯 | TCIPP | 13674-84-5 | 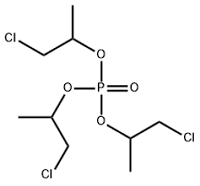 | |
| Tris(1,3-dichloro-2-propyl) phosphate | 磷酸三(1, 3-二氯-2-丙基)酯 | TDCIPP | 13674-87-8 | 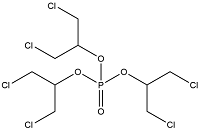 | |
| 芳香类 OPEs | Triphenyl phosphate | 磷酸三苯酯 | TPhP | 115-86-6 | 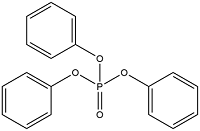 |
| Tritolyl phosphate | 磷酸三甲苯酯 | TCrP | 1330-78-5 | 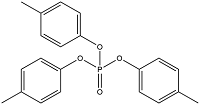 | |
| 2-Ethylhexyl diphenyl phosphate | 磷酸二苯基异辛酯 | EHDPP | 1241-94-7 | 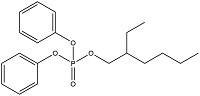 |
表9 新型有机磷酸酯(NOPEs)基本信息Table 9 Basic information of novel OPEs (NOPEs) |
| Classification | English name | Chinese name | abbreviation | CAS number | scheme |
|---|---|---|---|---|---|
| 2,2-Bis(chloromethyl)trimethylene bis(bis(2-chloroethyl) phosphate) | 2,2-二(氯甲基)-1,3-丙二醇双[双(2-氯乙基)磷酸酯 | V6 | 38051-10-4 | 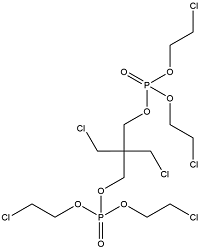 | |
| 卤代 OPEs | Tris(2,3-dibromopropyl) phosphate | 三-(2,3-二溴丙基)-磷酸酯 | TDBPP | 126-72-7 | 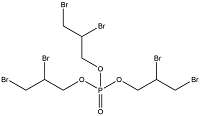 |
| Tris(tribromoneopenthyl)phosphate | 三(三溴新戊基)磷酸酯 | TTBP | 19186-97-1 | 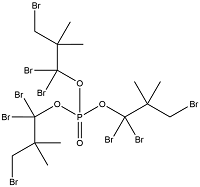 | |
| Cresyl diphenyl phosphate | 磷酸二苯甲苯酯 | CDP | 26444-49-5 | 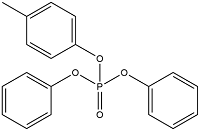 | |
| 芳香类OPEs | 2-Isopropylphenyl Diphenyl Phosphate | 2-异丙基苯基二苯基磷酸酯 | IPDP | 64532-94-1 | 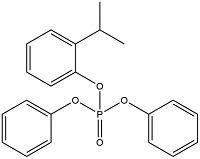 |
| Naphthalen-2-yl diphenyl phosphate | 磷酸-2-萘基二苯基酯 | NAPHP | 18872-49-6 | 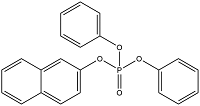 | |
| tert-butylphenyl diphenyl phosphate | 磷酸叔丁基苯二苯酯 | BPDP | 56803-37-3 | 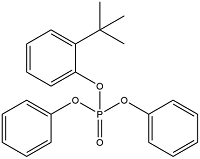 | |
| Isodecyl diphenyl phosphate | 磷酸异癸基二苯酯 | IDPP | 29761-21-5 | 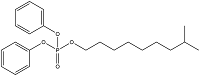 | |
| Bis(2-ethylhexyl) phenyl phosphate | 磷酸二(2-乙基己基)苯酯 | BEHPP | 16368-97-1 | 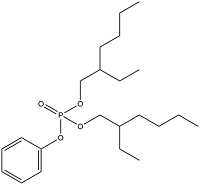 | |
| 2-Biphenylylphenyl phosphate | 磷酸-2-联苯基二苯基酯 | BPDPP | 132-29-6 | 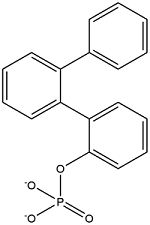 | |
| Bis(2-isopropylphenyl) Phenyl Phosphate | 二(2-异丙基苯基)苯基磷酸酯 | RBDPP | 69500-29-4 | 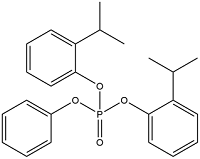 | |
| Bis(4-Tert-Butylphenyl) Phenyl Phosphate | 二(4-叔-丁基苯基)苯基磷酸酯 | B4TBPPP | 115-87-7 | 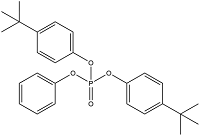 | |
| Tris(2-isopropylphenyl) phosphate | 三(2-异丙基苯)磷酸 | TIPPP | 64532-95-2 | 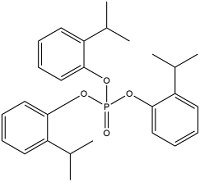 | |
| Tri-(4-Tert-Butylphenyl) Phosphate | 磷酸三(对-叔丁基苯)酯 | TBPP | 78-33-1 | 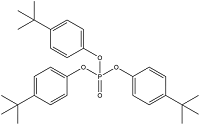 | |
| Resorcinol bis(diphenylphosphate) | 间苯二酚四苯基二磷酸酯 | RDP | 57583-54-7 | 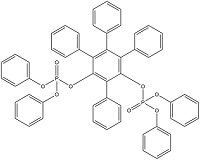 | |
| Tris(2,4-di-tert-butylphenyl) phosphate | 三(2,4 -二-叔丁基苯基)磷酸酯 | TDtBPP | 95906-11-9 | 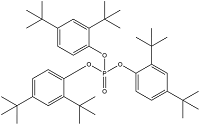 | |
| Bisphenol-A bis (diphenyl phosphate) | 双酚A双(二苯基磷酸酯) | BPA-BDPP | 5945-33-5 | 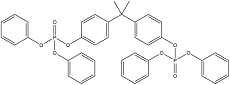 |
6.2.2 OPEs的环境污染现状
6.2.2.1 室内粉尘及大气
表10 2018—2023年有机磷酸酯在室内粉尘和大气环境中的分布情况Table 10 Distribution of OPEs in indoor dust and atmospheric environments, 2018—2023 |
| environmental medium | country or region | minimum value | maximum value | main OPEs | ref | |
|---|---|---|---|---|---|---|
| indoor dust | 中国 | 广州 | 3040 ng/g | 47240 ng/g | TDCIPP, TEHP, TCIPP, TPhP, EHDPP, BPA-BDPPa | 857 |
| 东北地区 | 700 ng/g | 9536 ng/g | TEP, TEHP, TCEP, TCIPP, TDCIPP, EHDPP | 858 | ||
| 华东地区 | 293 ng/g | 7150 ng/g | TEHP, TCEP, TCIPP, TDCIPP | |||
| 华北地区 | 958 ng/g | 7915 ng/g | TEHP, TCEP, TDCIPP, TCIPP | |||
| 华南及华中地区 | 702 ng/g | 8900 ng/g | TEHP, TCEP, TCIPP | |||
| 西北地区 | 364 ng/g | 5060 ng/g | TCEP, TCIPP, TDCIPP, TPhP | |||
| 西南地区 | 900 ng/g | 3700 ng/g | TCEP, TCIPP, TDCIPP | |||
| 希腊 | 2034 ng/g | 189962 ng/g | TDCIPP, TCIPP, TBOEP, TPhP | 859 | ||
| 英国 | 19911 ng/g | 1099519 ng/g | EHDPP, TCEP, TBOEP, TPhP, TCIPP, TDCIPP | 860 | ||
| 尼泊尔 | 153 ng/g | 12100 ng/g | TCIPP, TPhP, EHDPP | 861 | ||
| 全球 | 中国 | 149 ng/g | 4740 ng/g | TCEP, TPhP | 862 | |
| 哥伦比亚 | 54.6 ng/g | 8130 ng/g | TBOEP, TCIPP, TPhP | |||
| 希腊 | 1690 ng/g | 90200 ng/g | TnBP, TBOEP, TCEP, TCIPP, | |||
| 印度 | 52.5 ng/g | 9650 ng/g | TBOEP, TEHP, TDCIPP | |||
| 日本 | 7720 ng/g | 238000 ng/g | TBOEP, TCEP, TCIPP, TDCIPP, | |||
| 韩国 | 3090 ng/g | 249000 ng/g | TBOEP, TCEP, TCIPP, TPhP, IDDPa | |||
| 科威特 | 633 ng/g | 44400 ng/g | TBOEP, TCEP, TCIPP, TDCIPP, | |||
| 巴基斯坦 | 49.4 ng/g | 473 ng/g | TBOEP, TPhP | |||
| 罗马尼亚 | 775 ng/g | 54900 ng/g | TnBP,TBOEP, TCEP, TCIPP, TPhP | |||
| 沙特阿拉伯 | 791 ng/g | 35000 ng/g | TBOEP, TCEP, TCIPP, TDCIPP, TPhP | |||
| 美国 | 1930 ng/g | 101000 ng/g | TBOEP, TCEP, TCIPP, TDCIPP, TPhP | |||
| 越南 | 228 ng/g | 79600 ng/g | TBOEP, TCIPP, TPhP, RDPa | |||
| 美国 | 22690 ng/g | 736300 ng/g | TBOEP, TDCIPP, TCIPP, TPhP, BPDPPa | 857 | ||
| atmosphere | 中国 | 1228 ng/g | 612668 ng/g | TPhP, TCEP, TCIPP, TDBPP | 863 | |
| 东北地区 | 257 ng/g | 2630 ng/g | TCEP, TCIPP, TDCIPP | 858 | ||
| 华东地区 | 99.8 ng/g | 5960 ng/g | TCEP, TCIPP, TDCIPP, TPhP | |||
| 华北地区 | 140 ng/g | 4070 ng/g | TCEP, TCIPP | |||
| 华南及华中地区 | 154 ng/g | 5700 ng/g | TCEP, TCIPP, TDCIPP, TnBP | |||
| 西北地区 | 120 ng/g | 1030 ng/g | TCEP, TCIPP, TDCIPP | |||
| 西南地区 | 147 ng/g | 972 ng/g | TCEP, TCIPP, TEHP | |||
| 香港 | 1294 pg/m3 | 8481 pg/m3 | TCIPP, TDCIPP, TnBP, TBOEP | 864 | ||
| 广州 | 4.01 ng/m3 | 75.2 ng/m3 | TCIPP, TPhP | 865 | ||
| 太原 | 3.1 ng/m3 | 544 ng/m3 | TCEP, TCIPP, TBP | |||
| 广州 | 262 pg/m3 | 421914 pg/m3 | TCEP, TCIPP, TnBP, RDPa | 866 | ||
| 珠江三角洲 | 91 pg/m3 | 2055 pg/m3 | TCEP, TCIPP, TnBP,TDCIPP | 867 | ||
| 美国 | 五大湖 | 41.2 pg/m3 | 1320 pg/m3 | TCIPP, TnBP, TEHP, TCEP | 868 | |
| 美国 | 纽约 | 1320 pg/m3 | 20700 pg/m3 | TCEP, TCIPP, TDCIPP, TPhP, EHDPP | 869 | |
| 南极 | 164.82 pg/m3 | 3501.79 pg/m3 | TCIPP, TCEP | 870 | ||
| 北极 | 231.56 pg/m3 | 1884.25 pg/m3 | TCIPP, TCEP | 871 | ||
注:a为NOPEs |
6.2.2.2 水体及沉积物
6.2.2.3 野生生物
6.2.2.4 人体
表11 2018—2023年OPEs在水环境及生物体中的蓄积情况Table 11 Accumulation of OPEs in aquatic environment and organisms, 2018—2023 |
| medium | country or region | minimum concentration | maximum concentration | main OPEs | ref | ||
|---|---|---|---|---|---|---|---|
| 水环境 | |||||||
| 地表水 | 中国 | 602 ng/L | 9030 ng/L | TEP, TCIPP | 884 | ||
| 黄河中下游 | 97.66 ng/L | 2433 ng/L | TEP, TCEP, TCIPP, TDCIPP | 885 | |||
| 太湖 | 100 ng/L | 1700 ng/L | TEP | 886 | |||
| 南京 | 4.36 ng/L | 195269 ng/L | TDCIPP, TCEP, TDBPP | 887 | |||
| 香港 | 58.8 ng/L | 3090 ng/L | TCIPP, TBOEP | 888 | |||
| 长江流域 | 27.9 ng/L | 2531 ng/L | TEP, TCIPP, TCEP | 889 | |||
| 西藏 | 46.45 ng/L | 1744.73 ng/L | TCEP, TCIPP | 890 | |||
| 重庆 | 24.8 ng/L | 65 ng/L | TnBP, TCIPP, TCEP, TBOEP | 891 | |||
| 成都 | 19.1 ng/L | 533 ng/L | TCEP, TCIPP, TBOEP | 892 | |||
| 美国 | 35 ng/L | 290 ng/L | TDCIPP, TBOEP, TPhP | 880 | |||
| 北冰洋 | 6 pg/L | 440 pg/L | TCEP, TCIPP | 924 | |||
| 越南 | 46 ng/L | 3644 ng/L | TCIPP | 881 | |||
| 加拿大 | 2.9 ng/L | 67 ng/L | TEHP, TCIPP, TCEP | 883 | |||
| 地中海 | 9 ng/L | 1013 ng/L | TCIPP, TCEP | 882 | |||
| 沉积物 | 中国 | 太湖 | 12.8 ng/g(dw) | 9250 ng/g(dw) | TEHP, TDtBPPa, TCIPP | 894,895 | |
| 辽河 | 19.7 ng/g(dw) | 234 ng/g(dw) | TnBP, TBOEP | 896 | |||
| 黄河中下游 | 47.33 ng/g(dw) | 234 ng/g(dw) | TCEP, TCIPP, TEP | 885 | |||
| 珠江入海口 | 23.5 ng/g(dw) | 187 ng/g(dw) | TCEP, TCIPP, TPhP | 897 | |||
| 尼日利亚 | 13.1 ng/g(dw) | 2110 ng/g(dw) | TBOEP | 893 | |||
| 生物体 | |||||||
| 水生生 物 | 中国 | 南海 | 浮游生物 | 660 ng/g(dw) | 922 ng/g(dw) | TCIPP, TCEP, TBOEP | 898 |
| 太湖 | 浮游生物 | 9.4 ng/g(dw) | 10.8 ng/g(dw) | TEHP, TPhP, TCrPa | 899 | ||
| 莱州湾 | 底层鱼类 | 833 ng/g(dw) | 3150 ng/g(dw) | 烷烃类OPEs | 900 | ||
| 中上层鱼类 | 296 ng/g(dw) | 2120 ng/g(dw) | 烷烃类OPEs | ||||
| 珠江三角洲 | 虾 | 32.1 ng/g(dw) | 102 ng/g(dw) | TCIPP, TBOEP, TDCIPP | 902 | ||
| 蟹 | 30.3 ng/g(dw) | 88.4 ng/g(dw) | TCIPP, TBOEP, TDCIPP, EHDPP | ||||
| 鱼 | 8.35 ng/g(dw) | 40.9 ng/g(dw) | TCIPP, TBOEP, TDCIPP, TCP | ||||
| 浮游生物 | 660 ng/g(dw) | 922 ng/g(dw) | TCIPP, TCEP, TBOEP | ||||
| 太湖 | 草鱼 | 1.61 ng/g(ww) | 7.66 ng/g(ww) | TDtBPPa | 904 | ||
| 鲫 | 2.11 ng/g(ww) | 13.2 ng/g(ww) | TDtBPPa | ||||
| 鲤 | 0.833 ng/g(ww) | 6.95 ng/g(ww) | TDtBPPa | ||||
| 鳙 | 2.87 ng/g(ww) | 7.75 ng/g(ww) | TDtBPPa | ||||
| 鲢 | 3.7 ng/g(ww) | 32.3 ng/g(ww) | TDtBPPa, TBOEP | ||||
| 加拿大 | 五大湖 | 湖鳟 | 122 ng/g(ww) | 905 | |||
| 南极 | 鳕鱼 | 173 ng/g(lw) | TCEP, TDCIPP | 906 | |||
| 海豚 | 907 | ||||||
| 肌肉 | 69.5 ng/g(lw) | 2939 ng/g(lw) | TBOEP, IDPPa | ||||
| 肝 | 9.7 ng/g(lw) | 712 ng/g(lw) | TBOEP, EHDPP, IDPPa | ||||
| 西班牙 | 肾 | nd | 789 ng/g(lw) | TBOEP | |||
| 脂肪 | 27.2 ng/g(lw) | 2450 ng/g(lw) | TCIPP, TBOEP | ||||
| 脑 | nd | 24729 ng/g(lw) | TCIPP,TBOEP,TnBP,IDPPa,IPPPa | ||||
| 西印度洋 | 海豚 | 1630 ng/g(lw) | 31861 ng/g(lw) | TBOEP | 908 | ||
| 冰岛 | 长须鲸 | 31.9 ng/g(lw) | 10232 ng/g(lw) | IPPPa, TnBP, TPPO | 909 | ||
| 中国 | 珠江三角洲 | 鲮鱼 | 50 ng/g(lw) | 829 ng/g(lw) | TEHP, TCIPP, TCEP | 901 | |
| 罗非鱼 | 145 ng/g(lw) | 1086 ng/g(lw) | TEHP, TCIPP, TCEP | ||||
| 下口鲶 | 133 ng/g(lw) | 2321 ng/g(lw) | TEHP, TCIPP, TCEP | ||||
| 北运河 | 泥鳅 | 309 ng/g(lw) | 1973 ng/g(lw) | TCIPP, TCEP, TnBP | 903 | ||
| 鲫 | 274 ng/g(lw) | 1042 ng/g(lw) | TCIPP,TCEP,TnBP,TEHP,TPhP | ||||
| 麦穗鱼 | 265 ng/g(lw) | 1586 ng/g(lw) | TnBP, TCIPP, TEHP | ||||
| 陆生动 物 | 中国 | 长江中上游 | 鹭-鸟蛋 | 18 ng/g(ww) | 185 ng/g(ww) | TnBP, TIBPa, TCIPP | 912 |
| 美国 | 五大湖 | 白头海雕 | 913 | ||||
| 蛋 | 4.76 ng/g(ww) | 760 ng/g(ww) | TCIPP, TnBP, TPhP | ||||
| 血清 | 2.68 ng/g(ww) | 16.9 ng/g(ww) | TCIPP, TnBP | ||||
| 拉丁美洲及乌干达 | 灵长类-粪便 | 78 ng/g(lw) | 1200 ng/g(lw) | TBOEP, TCIPP | 914 | ||
| 人体 | 中国 | 杭州 | 孕妇血清 | 3.3 ng/mL | 51.4 ng/mL | TCEP, TCIPP, TPhP | 918 |
| 绵阳 | 1.66 ng/mL | 23.8 ng/mL | TnBP, TCEP, TPhP | ||||
| 湖北 | 孕妇血 | 1.06 ng/mL | 59.6 ng/mL | TCrP, TIBP, TnBP, TCIPP | 919 | ||
| 脐带血 | nd | 45.5 ng/mL | TCrP, TIBP, TnBP, TCIPP | ||||
| 济南 | 老年人血清 | 0.923 ng/mL | 26.55 ng/mL | TnBP, TPhP, TCIPP | 921 | ||
| 北京 | 母乳 | 14.2 ng/mL | 59.2 ng/mL | EHDPP, TPhP, V6a | 922 | ||
| 美国 | 0.67 ng/mL | 7.83 ng/mL | TIBPa, TnBP, TBOEP | 923 | |||
注:a为NOPEs |
6.2.3 OPEs的毒理学研究现状
6.2.3.1 生长发育毒性
6.2.3.2 内分泌干扰效应
6.2.3.3 肝毒性及脂代谢干扰效应
6.2.3.4 神经毒性
6.2.4 展望
6.3 蜜源作物中新型烟碱类农药的整合暴露评估
6.3.1 研究背景及意义
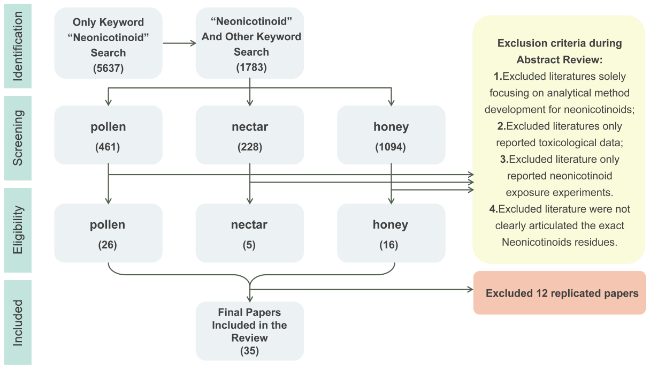
6.3.2 文献来源和数据提取流程
图29 2023年之前发表的纳入和排除研究的流程图。在Web of Science上用于搜索的关键词包括“花粉、花蜜或蜂蜜”和“新型烟碱类化合物”,研究数量显示在括号中Fig. 29 Flow diagram of included and excluded studies published prior to 2023.Keywords used to search in the Web of Science included“Pollen, Nectar, or Honey”and “Neonicotinoid”. The numbers of studies are shown in parentheses |
6.3.3 基于相对效能因子法(RPF)整合暴露评估
6.3.3.1 相对效能因子法(RPF)
表12 7种新型烟碱类化合物的CAS号、化学结构式、无可见有害作用水平(LOAEL)及相对应的相对效价因子(RPF)Table 12 CAS numbers, Chemical structures, No observed adverse effect levels (LOAELs) and Relative potency factors (RPF) of 7 neonicotinoid insecticides |
| CAS Number | Neonicotinoid | Chemical structure | LOAEL/[mg/(kg·d)] | RPF | |
|---|---|---|---|---|---|
| 135410-20-7 | Acetamiprid (ACE) | 啶虫脒 | 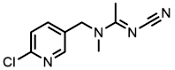 | 17.5 | 0.97 |
| 210880-92-5 | Clothianidin (CLO) | 噻虫胺 | 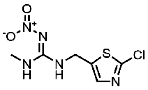 | 31.2 | 0.54 |
| 165252-70-0 | Dinotefuran (DIN) | 呋虫胺 | 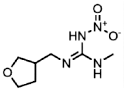 | 991 | 0.001 |
| 138261-41-3 | Imidacloprid (IMI) | 吡虫啉 | 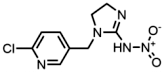 | 16.9 | 1.00 |
| 111988-49-9 | Thiacloprid (THIAC) | 噻虫啉 | 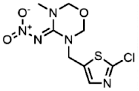 | 2.5 | 6.76 |
| 153719-23-4 | Thiamethoxam (THIAM) | 噻虫嗪 | 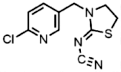 | 1.8 | 9.39 |
| 105843-36-5 | Imidaclothiz (IMID) | 氯噻啉 | 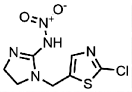 | — | 1.00 |
6.3.3.2 全球范围内花粉、花蜜及蜂蜜中新型烟碱类农药的残留研究
表13 在全球范围内研究中不同蜜源作物花粉中六种新型烟碱类农药残留概述及IMIRPF值Table 13 Overview of neonicotinoids in pollen reported in the peer-review literature and the calculated IMIRPF |
| Location | N sample7 | Compound (Mean or Range) | LOQ8/ (ng/g) | IMIRPF9/ (ng/g) | ref10 | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Continent | Country | IMI1 | THIAM2 | ACE3 | CLO4 | THIAC5 | DIN6 | |||||
| Asia | China | 22 | 20.12 | -11 | 4.36 | 3.93 | — | 9.41 | 0.6~1.5(LOD) | 26.48 | 1053 | |
| China | 483 | 20.3 | 39.6 | ND | ND | ND | ND | 0.47~2.13 | 392.14 | 1025 | ||
| China | 69 | ND~3.2 | ND~2.03 | ND~3.26 | ND~0.28 | ND~1.56 | ND~2.9 | 0.031~0.074 | 0~36.12 | 1016 | ||
| Thailand | 6 | 22 | — | — | — | — | — | 1 | 22.00 | 1054 | ||
| 3 | ND12 | — | — | — | — | — | (LOD) | 0.00 | ||||
| 11 | 3.9 | — | — | — | — | — | 3.90 | |||||
| Africa | Egypt | 33 | 6.15 | 12.35~15.50 | 13.63 | 4.53 | — | 7.61 | 0.1~2.1 | 137.79~167.37 | 1055 | |
| Europe | U.K. | 13 | ND | ≤0.1213 | — | ≤0.12 | 0.06±0.22 | — | 0.12~0.48 | 0.5814 | 1021 | |
| 13 | ND | ≤0.12 | — | 0.16±0.58 | 0.15±0.36 | — | 1.27 | |||||
| 19 | ≤0.16 | 0.58±1.64 | — | ≤0.10 | 1.47±4.41 | — | 15.42 | |||||
| 23 | ≤0.16 | 4.96±11.29 | — | ≤0.12 | 0.08±0.31 | — | 47.15 | |||||
| 7 | 0.31±0.82 | ≤0.12 | ≤0.04 | ND | 1.34±3.52 | — | 9.54 | |||||
| 13 | ND | ≤0.12 | ND | ND | ND | — | 0.17 | |||||
| 11 | ND | ND | ≤0.04 | ND | ≤0.04 | — | 0.05 | |||||
| 11 | 1.13±3.34 | ≤0.12 | 0.14±0.42 | ND | ≤0.04 | — | 1.48 | |||||
| 22 | ≤0.16 | ≤0.12 | ≤0.04 | ND | ≤0.04 | — | 0.24 | |||||
| U.K. | 11 | <0.36 | 5.7 | <0.02 | 3.8 | 19 | — | 0.07~2.2 | 184.07 | 1023 | ||
| 8 | <0.36~<1.1 | 2.8 | <0.02 | <0.72 | 0.6 | — | 30.46~30.57 | |||||
| 10 | <0.36 | 0.13 | <0.02 | 0.5 | 0.3 | — | 3.58 | |||||
| 25 | 0.2 | 0.15 | <0.02~<0.07 | <0.72~<2.2 | 0.9 | — | 7.75~7.88 | |||||
| 19 | <0.36~<1.1 | <0.12~<0.36 | <0.02 | <0.72 | <0.07 | — | 0.36~0.80 | |||||
| U.K. | 18 | 6.9±16 | 11.0±16 | 0.45±0.23 | 11.0±9.3 | 0.78±1.1 | — | 0.14~5.9 | 121.84 | 1056 | ||
| Greece | 10 | 72 | ND | ND | 6.1~69.04 | ND | — | 0.2~0.6 | 75.29~109.28 | 1057 | ||
| 4 | 73.9 | 14.4 | ND | 308.3~1273 | <0.4 | — | 376.00~896.94 | |||||
| Germany | 16 | ND | — | ND | ND | 2 | — | 0.1~2.0 | 13.52 | 1058 | ||
| 39 | ND | — | 3.42 | ND | 42.37 | — | 289.74 | |||||
| 24 | ND | — | 2.08 | 0.425 | 99.8 | — | 676.90 | |||||
| 22 | ND | — | ND | ND | 18.13 | — | 122.56 | |||||
| 30 | ND | — | ND | ND | 43.18 | — | 291.90 | |||||
| 20 | 0.11 | — | ND | ND | 57.4 | — | 388.13 | |||||
| 9 | ND | — | ND | ND | 3.24 | — | 21.90 | |||||
| 20 | ND | — | 1.76 | ND | 24.94 | — | 170.30 | |||||
| 12 | 0.17 | — | ND | 0.24 | 55.18 | — | 373.32 | |||||
| 19 | ND | — | ND | ND | 21.94 | — | 148.31 | |||||
| 27 | ND | — | ND | ND | 26.68 | — | 180.36 | |||||
| 16 | ND | — | 0.13 | ND | ND | — | 0.13 | |||||
| 27 | ND | — | ND | ND | 17.7 | — | 119.65 | |||||
| Ireland | 12 | — | — | — | <0.13 | ND | — | 0.07~0.29 | 0.02 | 1033 | ||
| 8 | — | — | — | ND | 4.43±0.06 | — | 29.95 | |||||
| Italian | 238 | 2 | 2 | — | — | — | — | 0.25 | 20.78 | 999 | ||
| 152 | 2 | 1 | — | — | — | — | 11.39 | |||||
| 164 | 2 | 1 | — | — | — | — | 11.39 | |||||
| Italy | <67 | 17.9~32 | ND | 10.5~33.1 | ND | 6±2 | — | 5.69~6.12 | 104.67~64.11 | 1059 | ||
| Luxembourg | 154 | 0.44~0.79 | 0.36~0.84 | — | 0.39~1.40 | 0.57~133.05 | — | 0.28~0.42 | 7.88~908.85 | 1060 | ||
| Poland | 53 | 3.1 | ND | — | — | 61.3 | — | 0.8~8.9 | 417.49 | 1061 | ||
| N. Am15 | Canada | 6 | 4.96 | — | — | — | — | — | 0.02~0.063 | 4.96 | 1062 | |
| 6 | 18.4 | — | — | — | — | — | (LOD) | 18.40 | ||||
| Canada | 86 | 6.0±7.2 | 6.5±2.0 | 9.9±9.2 | — | 1.4 | — | ND | 86.10 | 1063 | ||
| USA | 219 | <0.1~43.1 | <0.1~2.5 | <0.1~4.36 | <0.1~8.09 | <0.1~40.8 | <0.1~4.94 | 0.1 | 0.28~350.99 | 1021 | ||
| USA | 38 | 2.5 | 53.9 | ND | 17.3 | — | — | 2 | 517.96 | 1064 | ||
| 35 | 3.9 | ND | ND | ND | — | — | (LOD) | 3.90 | ||||
| 31 | 2.9 | 3.9 | 1.6 | 4.4 | — | — | 43.45 | |||||
| USA | 170 | 0.41±0.05 | 3.65±0.36 | — | 0.80±0.05 | — | — | 0.33 | 35.12 | 1065 | ||
| 144 | 1.37±0.17 | 2.30±0.13 | — | 1.24±0.08 | — | — | 23.64 | |||||
| USA | 13 | 0.2~2.2 | ND | ND | ND | 0.1~0.3 | ND | 0.1 | 0.88~4.23 | 1032 | ||
| USA | 25 | 1.2 | 2.1 | 14.3 | — | — | ND | 0.2~0.5 | 34.79 | 1066 | ||
| 24 | 1.1 | 2.6 | 2.1 | — | — | 0.4 | 27.55 | |||||
| USA | 32 | ND | ND | 27 | ND | ND | — | 0.5~20 | 26.19 | 1067 | ||
| USA | 275 | 1.66 | — | 1.09 | — | 0.52 | — | 1~2 | 6.23 | 1068 | ||
| 273 | 8.6 | — | ND | — | ND | — | 1 | 8.60 | ||||
| 190 | 5.79 | — | ND | — | 1.1 | — | 13.23 | |||||
| 124 | 2.8 | — | ND | — | ND | — | 2.80 | |||||
| USA | 7 | 0.4~2.3 | ND | ND | ND | ND | ND | 0.1~0.5 | 0.40~2.30 | 1069 | ||
| Oceania | New Zealand | 6 | 0.2~1.2 | ND | ND | 0.2~2.6 | 0.1~3.3 | ND | 0.1~0.5 | 0.98~24.91 | 1069 | |
Note:1.Imidacloprid; 2. Thiamethoxam; 3. Acetamiprid; 4. Clothianidin; 5. Thiacloprid; 6. Dinotefuran; 7. Number of samples; 8. Limit of Quantitation; 9. Imidacloprid equivalent relative potency factor(ng/g); 10. Reference; 11. Not mentioned in the references cited; 12. No detected; 13. Less than limit of quantitation (LOQ); 14. Calculated using 1/2LOD for data less than LOQ; 15. North America. |
表14 在全球范围内文献中报道的花蜜中六种新型烟碱类农药残留概述及IMIRPF值Table 14 Overview of neonicotinoids in nectar reported in the peer-review literature and the calculated IMIRPF. |
| Location | N sample | Compound (Mean or Range) | LOQ/ (ng/g) | IMIRPF/(ng/g) | ref | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Continent | Country | IMI | THIAM | ACE | CLO | THIAC | DIN | ||||
| Asia | China | 34 | 2.40 | ND | 7.81 | 2.16 | ND | 2.83 | 0.6~1.5 | 11.14 | 1053 |
| China | 391 | 30.3 | 31.2 | 16.9 | — | — | — | 0.80~2.37 | 339.66 | 1025 | |
| Europe | U.K. | 8 | ND | ≤0.10 | ND | ND | ND | — | 0.08~0.4 | 0.14 | 1021 |
| 7 | ND | 0.26±0.68 | ND | ND | ND | — | 2.44 | ||||
| 14 | ≤0.14 | ≤0.10 | ND | ND | ND | — | 0.17 | ||||
| 13 | ND | 0.2±0.51 | ND | ND | ND | — | 1.88 | ||||
| 5 | ≤0.10 | 0.76±1.52 | ND | ND | ND | — | 7.15 | ||||
| 13 | ND | ≤0.10 | ND | ND | ND | — | 0.14 | ||||
| 10 | ND | ≤0.10 | ND | ND | ND | — | 0.14 | ||||
| 12 | ND | ND | ≤0.14 | ND | 0.05±0.13 | — | 0.36 | ||||
| 19 | ND | ≤0.10 | ≤0.14 | ND | 0.09±0.15 | — | 0.77 | ||||
| Europe | Ireland | 12 | — | — | — | < 0.09~0.95 | ND | — | 0.09 | 0.01~0.51 | 1033 |
| 8 | — | — | — | < 0.09 | ND | — | 0.01 | ||||
| N. Am | USA | 224 | 0.85 | 1 | 1.08 | ND | 0.52 | — | 1~2 | 14.80 | 1068 |
| 264 | 0.53 | ND | ND | ND | ND | — | (LOD) | 0.53 | |||
| 193 | 0.62 | ND | ND | ND | ND | — | 0.62 | ||||
| 87 | ND | ND | ND | ND | ND | — | 0.00 | ||||
表15 在全球范围内文献中报道的蜂蜜中6种新型烟碱类农药残留概述及IMIRPF值Table 15 Overview of neonicotinoids in honey reported in the peer-review literature and the calculated IMIRPF |
| Location | N sample | Compound (Mean or Range) | LOQ/ (ng/g) | IMIRPF/ (ng/g) | ref | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Continent | Country | IMI | THIAM | ACE | CLO | THIAC | DIN | ||||||
| Asia | Azerbaijan | 1 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | 1000 | ||
| Burma | 2 | 0.021~0.135 | <0.02~0.092 | <0.008~0.084 | <0.03~0.044 | <0.002 | — | 0.008~0.03 | 0.05~1.11 | ||||
| China | 3 | <0.03~0.151 | <0.02~0.298 | <0.008~0.89 | <0.03 | <0.002~0.094 | — | 0.008~0.03 | 0.04~4.45 | ||||
| China | 639 | 5.01 | 1.75 | 4.78 | 4.36 | 0.896 | — | 0.1~0.15 | 34.49 | 1040 | |||
| China | 483 | 1.8~21.5 | 2.0~55.9 | 2.0~64.2 | ND | ND | — | 0.67~2.22 | 22.52~608.68 | 1025 | |||
| China | 10 | ND~2.59 | ND~0.63 | ND | ND~0.14 | ND | ND~1.71 | 0.031~0.074 | 8.58 | 1016 | |||
| India | 3 | <0.03~0.171 | <0.02~0.044 | <0.008~0.109 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04~0.69 | 1000 | |||
| Indonesia | 6 | <0.03~0.037 | <0.02~0.046 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04~0.47 | ||||
| Iran | 2 | 0.081~0.089 | <0.02 | <0.008~0.057 | <0.03 | <0.002 | — | 0.008~0.03 | 0.11~0.18 | ||||
| Israel | 2 | 2.516~2.652 | <0.02 | 0.011~0.443 | <0.03 | 0.064~0.375 | — | 0.008~0.03 | 2.99~5.65 | ||||
| Israel | 2 | 0.7~0.8 | ND | 0.2 | ND | ND | ND | 0.1~0.5 | 0.89~0.99 | 1069 | |||
| Japan | 3 | 0.030~2.198 | <0.02~1.195 | 0.125~21.786 | 0.018~1.829 | <0.002~0.002 | — | 0.008~0.03 | 0.19~35.55 | 1000 | |||
| Lebanon | 2 | 0.037~0.041 | <0.02~0.020 | 0.019~0.231 | <0.03 | <0.002 | — | 0.008~0.03 | 0.09~0.46 | ||||
| Malaysia | 1 | 0.095 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.13 | ||||
| Nepal | 2 | 0.047~0.635 | 0.026~0.095 | <0.008~0.524 | <0.03 | <0.002 | — | 0.008~0.03 | 0.30~2.04 | ||||
| Philippines | 1 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | ||||
| Saudi Arabia | 2 | 0.086~0.148 | <0.02~0.061 | 0.045~0.405 | <0.03 | <0.002 | — | 0.008~0.03 | 0.16~1.12 | ||||
| Sri Lanka | 1 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | ||||
| Thailand | 2 | 0.182~0.383 | <0.02~0.117 | 0.049~0.501 | <0.03 | <0.002 | — | 0.008~0.03 | 0.26~1.97 | ||||
| Turkey | 2 | <0.03~0.124 | <0.02 | 0.080~0.788 | <0.03 | <0.002~0.660 | — | 0.008~0.03 | 0.11~5.38 | ||||
| Vietnam | 1 | 0.079 | 0.111 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 1.13 | ||||
| Yemen | 2 | <0.03 | <0.02~0.099 | <0.008~0.041 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04~0.98 | ||||
| Africa | Burkina Faso | 1 | <0.03 | <0.02 | <0.008 | 0.099 | 0.003 | — | 0.008~0.03 | 0.11 | |||
| Cameroon | 2 | <0.03 | 0.067~0.598 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.64~5.63 | ||||
| Central African Republic | 1 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | ||||
| Egypt | 2 | <0.03~0.159 | <0.02 | <0.008~0.102 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04~0.29 | ||||
| Egypt | 45 | 0.5~1.7 | ND~18.8 | 1.7~4.9 | ND | ND | — | 0.1~2 | 178.68~192.38 | 1070 | |||
| Egypt | 37 | 0.87 | 18.84 | 4.5 | ND | — | 0.57 | 0.1~2.1 | 182.14 | 1055 | |||
| Eritrea | 1 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | 1000 | |||
| Ethiopia | 1 | <0.03 | 0.046 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.44 | ||||
| Ghana | 2 | <0.03~0.029 | <0.02~0.027 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04~0.29 | ||||
| Ivory Coast | 1 | <0.03 | 0.097 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.92 | ||||
| Kenya | 3 | <0.03 | <0.02~0.080 | <0.008 | <0.03 | <0.002~0.003 | — | 0.008~0.03 | 0.04~0.78 | ||||
| Madagascar | 3 | <0.03 | <0.02~0.033 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04~0.32 | ||||
| Morocco | 3 | <0.03~0.104 | <0.02 | <0.008~0.066 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04~0.20 | ||||
| Mozambique | 2 | <0.03~0.096 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04~0.13 | ||||
| Nigeria | 1 | <0.03 | 0.211 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 1.99 | ||||
| Guinea | 1 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | ||||
| Malawi | 1 | 0.328 | 0.142 | <0.008 | 0.091 | <0.002 | — | 0.008~0.03 | 1.71 | ||||
| Senegal | 2 | <0.03 | 0.136~0.411 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 1.29~3.87 | ||||
| South Africa | 2 | 2.388~2.445 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 2.42~2.48 | ||||
| Tanzania | 2 | <0.03~0.166 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04~0.20 | ||||
| Tunisia | 1 | 0.072 | <0.02 | 0.139 | <0.03 | 0.5 | — | 0.008~0.03 | 3.62 | ||||
| Uganda | 1 | <0.03 | 0.047 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.45 | ||||
| Europe | Austria | 32 | ND | <0.6 | 2.2~15.2 | ND | 5.0~27.4 | ND | 0.6~2.0 | 36.78~200.81 | 1071 | ||
| 9 | ND | ND | ND | ND | <0.6~2.1 | ND | 0.6~2.0 | 0.61~14.20 | |||||
| Belgium | 1 | 0.280 | 0.266 | 2.898 | 0.134 | 15.458 | — | 0.008~0.03 | 110.16 | 1000 | |||
| Bulgaria | 2 | <0.03 | <0.02~0.033 | <0.008~0.128 | <0.03 | <0.002~0.259 | — | 0.008~0.03 | 0.04~2.19 | ||||
| Croatia | 1 | 0.075 | 0.03 | 0.015 | <0.03 | 0.194 | — | 0.008~0.03 | 1.69 | ||||
| Cyprus | 1 | <0.03 | <0.02 | 0.056 | <0.03 | 0.087 | — | 0.008~0.03 | 0.68 | ||||
| Czech Republic | 2 | 0.054~0.055 | 0.083~0.252 | 0.864~1.126 | 0.029~0.037 | 1.307~5.874 | — | 0.008~0.03 | 10.52~43.24 | ||||
| England | 2 | <0.03~0.0168 | <0.02~0.350 | <0.008~0.512 | <0.03~0.216 | <0.002 | — | 0.008~0.03 | 0.04~3.92 | ||||
| Finland | 1 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | ||||
| France | 12 | <0.03~0.301 | <0.02~0.038 | <0.008~0.445 | <0.03 | <0.002~0.770 | — | 0.008~0.03 | 0.04~6.30 | ||||
| Georgia | 1 | 0.021~0.135 | <0.02 | 0.013 | <0.03 | 0.012 | — | 0.008~0.03 | 0.15~0.26 | ||||
| Germany | 2 | <0.03 | <0.02 | <0.008~4.579 | 0.197~0.951 | 0.647~46.767 | — | 0.008~0.03 | 4.51~321.13 | ||||
| Greece | 3 | <0.03~0.029 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04~0.06 | ||||
| Greece | 5 | ND | ND | ND | ND | ND | — | 0.4~1.1 | 0.00 | 1057 | |||
| 1 | ND | ND | ND | ND | ND | — | 0.00 | ||||||
| Hungary | 1 | <0.03 | <0.02 | 0.688 | 0.051 | 3.378 | — | 0.008~0.03 | 23.56 | 1000 | |||
| Irish | 30 | 11 | ND | ND | <3 | <3 | ND | 3 | 14.29 | 1041 | |||
| Italy | 4 | <0.03~1.199 | ND~0.021 | <0.008~0.080 | <0.03 | <0.002~1.677 | — | 0.008~0.03 | 0.01~12.81 | 1000 | |||
| Latvia | 1 | <0.03 | 0.136 | <0.008 | 0.421 | 0.142 | — | 0.008~0.03 | 2.47 | ||||
| Liechstenstein | 1 | <0.03 | 0.035 | <0.008 | 0.421 | <0.002 | — | 0.008~0.03 | 0.56 | ||||
| Lithuania | 1 | <0.03 | 0.291 | <0.008 | 0.197 | 0.019 | — | 0.008~0.03 | 2.97 | ||||
| Norway | 1 | 0.074 | <0.02 | <0.008 | <0.03 | 0.647 | — | 0.008~0.03 | 4.48 | ||||
| Poland | 2 | 0.05~0.153 | 0.087~1.420 | 1.583~29.312 | <0.03~0.128 | 0.704~25.340 | — | 0.008~0.03 | 7.16~213.29 | ||||
| Portugal | 3 | <0.03~0.149 | ND~<0.02 | <0.008 | <0.03 | <0.002~0.012 | — | 0.008~0.03 | 0.01~0.26 | ||||
| Macedonia | 1 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | ||||
| Romania | 2 | 0.081~0.104 | <0.02~0.030 | 0.380~0.442 | <0.03 | 0.001~0.066 | — | 0.008~0.03 | 0.49~0.82 | ||||
| Russia | 6 | <0.030.108 | <0.02~0.048 | <0.008~0.087 | <0.03 | <0.002~0.006 | — | 0.008~0.03 | 0.04~0.69 | ||||
| Slovakia | 2 | <0.03 | <0.02~0.390 | <0.008 | <0.03~0.106 | 0.157~8.263 | — | 0.008~0.03 | 1.1~59.58 | ||||
| Slovenia | 1 | <0.03 | <0.02 | <0.008 | <0.03 | 0.010 | — | 0.008~0.03 | 0.10 | ||||
| Slovenia | 60 | — | ND | ND | — | <0.005~0.018 | — | 0.005 | 0.01~0.12 | 1072 | |||
| Slovenia | 51 | ND | ND | <0.008~2.0 | ND | <0.06~9.6 | — | 0.19~2.84 | 0.06~66.84 | 1073 | |||
| Spain | 7 | <0.03~0.529 | ND~0.065 | <0.008~0.255 | <0.03 | <0.002~0.026 | — | 0.008~0.03 | 0.01~1.56 | 1000 | |||
| Switzerland | 3 | <0.03 | <0.02~0.123 | <0.008~0.008 | <0.03~0.327 | <0.002 | — | 0.008~0.03 | 0.04~1.35 | ||||
| U.K. | 21 | 0.05 | 0.1 | — | 0.28 | — | — | 0.10~0.38 | 1.14 | 1074 | |||
| 109 | 0.03 | 0.04 | — | 0.11 | — | — | 0.06~0.17 | 0.47 | |||||
| U.K. | 22 | <0.1 | ND | <0.01~0.70 | <0.02~0.74 | ND | ND | 0.01~0.1 | 0.02~1.09 | 1075 | |||
| Ukraine | 1 | 0.036 | <0.02 | <0.008 | <0.03 | 0.997 | — | 0.008~0.03 | 6.81 | 1000 | |||
| N. Am | Canada | 7 | <0.03~0.043 | 0.125~1.280 | <0.008~0.061 | 0.069~0.932 | <0.002~0.060 | — | 0.008~0.03 | 1.22~13.03 | |||
| Curaçao | 1 | 0.035 | <0.02 | 0.016 | <0.03 | <0.002 | — | 0.008~0.03 | 0.08 | ||||
| Mexico | 3 | <0.03~0.610 | <0.02~0.040 | <0.008~0.021 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04~1.01 | ||||
| United States | 15 | <0.03~6.325 | <0.02~2.674 | <0.008~0.034 | <0.03~0.917 | <0.002 | — | 0.008~0.03 | 0.04~31.96 | ||||
| USA | 8 | 0.1~1.3 | 0.4 | ND | 0.1~0.5 | ND | ND | 0.1~0.5 | 3.91~10.73 | 1069 | |||
| USA | 53 | <0.1~14.7 | <0.1~0.5 | <0.1~0.3 | <0.1 | <0.1~0.1 | <0.1~14.5 | 0.1 | 0.28~20.38 | 1017 | |||
| Oceania | Australia | 7 | <0.03~0.091 | <0.02~0.045 | <0.008 | <0.03 | <0.002~0.190 | — | 0.008~0.03 | 0.04~1.80 | 1000 | ||
| Fiji | 1 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | ||||
| France (New Caledonia) | 1 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | ||||
| New Zealand | 4 | <0.03~0.071 | <0.02~0.344 | <0.008~0.034 | <0.03 | <0.002~0.018 | — | 0.008~0.03 | 0.04~3.46 | ||||
| Niue | 1 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | ||||
| S. Am | Peru | 3 | <0.03~1.618 | <0.02~0.103 | <0.008~2.573 | <0.03 | <0.002~0.003 | — | 0.008~0.03 | 0.04~5.10 | |||
| Uruguay | 1 | 0.076 | 0.091 | 0.009 | <0.03 | 0.023 | — | 0.008~0.03 | 1.10 | ||||
| Argentina | 4 | <0.03~0.398 | <0.02~0.077 | <0.008~0.016 | <0.03~0.032 | <0.002~0.200 | — | 0.008~0.03 | 0.04~2.51 | ||||
| Brazil | 8 | <0.03~1.114 | <0.02~0.282 | <0.008 | <0.03~0.048 | <0.002 | — | 0.008~0.03 | 0.04~3.79 | ||||
| Chile | 2 | <0.03 | <0.02~0.271 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04~2.55 | ||||
| Colombia | 1 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | ||||
| Costa Rica | 2 | <0.03 | <0.02 | <0.008 | <0.03 | <0.002 | — | 0.008~0.03 | 0.04 | ||||
| Peru | 3 | <0.03~1.618 | <0.02~0.103 | <0.008~2.573 | <0.03 | <0.002~0.003 | — | 0.008~0.03 | 0.04~5.10 | ||||
| Uruguay | 1 | 0.076 | 0.091 | 0.009 | <0.03 | 0.023 | — | 0.008~0.03 | 1.10 | ||||
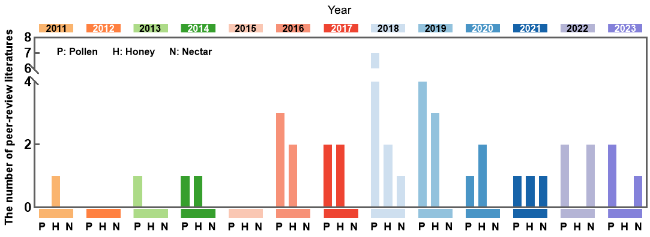
图30 2023年之前出版的纳入本综述数据分析的论文在每个出版年份中的数量分布图。图中,P表示花粉,H表示蜂蜜,N表示花蜜Fig. 30 The distribution of the number of the number of peer-review literatures published before 2023 that were included in the data analysis of this review is shown. In the figure, P means pollen, H means honey, and N means nectar. |
6.3.3.3 新型烟碱类农药的整合暴露浓度(IMIRPF)及其分布
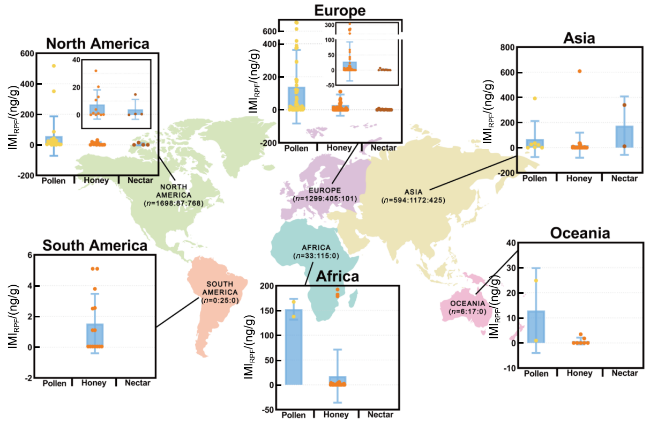
图31 在世界范围内所研究的花粉、蜂蜜和花蜜中新型烟碱类化合物的总分布。图中括号内数字分别表示各洲花粉、蜂蜜和花蜜的样本量。参考文献及数据在表13~15中。地图审批号:GS(2014)2081,引用时仅进行颜色的改动未对洲边界线进行改动Fig. 31 Distributions of total neonicotinoid insecticides in pollen, honey, and nectar reported in studies conducted worldwide. Which (n=a:b:c) means (n=number of pollen samples: number of honey samples: number of nectar samples).References were included in Tables 13~15 |
6.3.4 未来新型烟碱类农药对蜜蜂及其他生物的研究前景
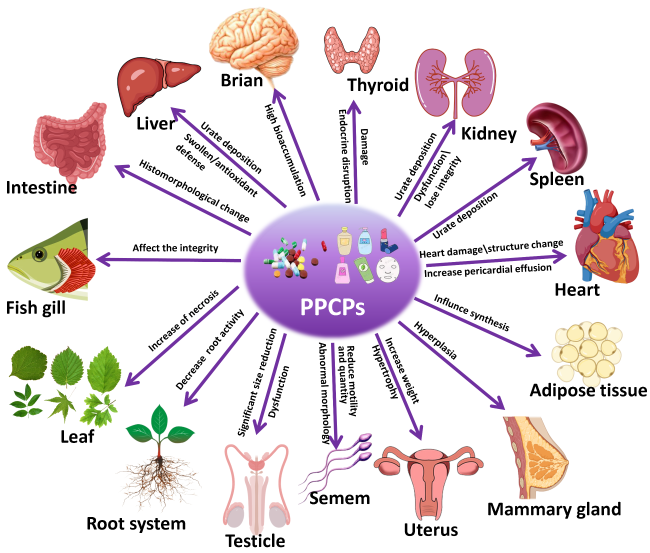
6.4 PPCP类污染物的生态毒理
6.4.1 分子水平
表16 PPCPs 在分子水平的毒理效应Table 16 Toxicity effect of PPCPs in molecular level |
| Classification | Species | PPCPs chemicals and effective concentration | Toxicity effect | ref |
|---|---|---|---|---|
| Enzyme effect | Clams | Caffeine (50 μg/L) | AChE acetylcholinesterase activity decreased by 56% | 1076 |
| Carbamazepine (0. 1 μg/L) | AChE acetylcholinesterase activity decreased by 56% | |||
| Clams | Fluoxetine (1 μg/L & 5 μg/L) | Acetylcholinesterase (AChE) activity decreased significantly | 1077 | |
| Groundwater microorganism | Tetracycline (10 μg/L) | Decreased denitrifying enzyme activities at the protein level | 1078 | |
| Daphnia magna | Indomethacin (1 mg/L); Ibuprofen (1 mg/L) | Reduced feeding rate and modulated activities of key enzymes like Alkalineand acid phosphatases, lipase, peptidase, β-galactosidase, and glutathione Stransferase | 1079 | |
| Chlorella vulgaris, Desmodesmus armatus. | Bisoprolol (100 mg/L), Ketoprofen (100 mg/L) | Regulation of antioxidant enzyme activity and chlorophyll content | 1080 | |
| Male rabbits | Codeine (4 mg/kg) | Elevated testicular enzymes inhibit testosterone levels and circulation in the testicles | 1083 | |
| Rat | Tramadol (40mg /kg); Codeine (80 mg/kg) | Induces malondialdehyde/nitrite production and superoxide dismutase (SOD) deficiency | 1082 | |
| Vigna radiata | Levofloxacin (≥50 mg/L) | The activity of nitrate reductase decreased significantly, and the activity of antioxidant oxidase increased | 1084 | |
| Mytilus galloprovincialis | Propranolol (11 μg/L); Acetaminophen (23 & 403 μg/L) | Modulates antioxidant enzyme activity | 1081 | |
| Protein synthesis induction | Vallisneria natans | Sulfadiazine (-) | Alternation of α- and β-D-glucopyranose polysaccharides and the increased content of autoinducer peptides and N-acylated homoserine lactones | 1102 |
| Human ovarian granulosa cells | Triclosan (0~10 μmol/L) | TCS increased estradiol and progesterone levels with upregulated steroidogenesis gene expression | 1087 | |
| Groundwater microorganism | Tetracycline (10 μg/L) | Decreased the concentration of electron donors (nicotinamide adenine dinucleotide, NADH), electron transport system activity, at the protein level | 1078 | |
| Rat | Oxytetracycline (200 mg/kg) | Erum urea and creatinine increased significantly, and creatinine clearance decreased | 1103 | |
| Chlorococcum sp | Triclosan (100 μmol/L) | Affect algae primarily by inhibiting fatty acid synthesis and causing protein aggregation | 1088 | |
| Medaka (Oryzias latipes) | Methylparaben (630 μg/L & 10 μg/L) | Induction of significant vitellogenin in male medaka at 630 μg/L, the expression levels of genes encoding proteins such as choriogenin and vitellogenin increased in concentrations (10 μg/L) | 1085 | |
| Danio rerio | Galaxolide (HHCB) (0.005 mmol/L) | Cause an increase in total triiodothyronine (TT3) and a significant decrease in total tetraiodothyronine (TT4) | 1086 | |
| DNA damage | Danio rerio | Ethylparaben (20 mg/L) | Inhibition of gene expression related to myocardial contraction | 1095 |
| Oxidative stress and antioxidation | Human | Sulfamethoxazole (40 μmol/L) | Significantly reduced the low level of TAthione, resulting in decreased immunity | 1096 |
| Rat | Triclocarban (300 nmol/L) | Non-protein mercaptan (glutathione) was significantly reduced | 1097 | |
| Amino acid | Tonalid (500 μmol/L) | Acts as a photosensitizer to significantly increase photo-induced oxidative damage to amino acids. | 1100 | |
| Rat hepatocytes | Acetaminophen (10 mmol/L 24 h) | Decreased the levels of both intracellular ATP and GSH, and GSH-conjugated APAP (APAP-GSH) were formed. | 1098 | |
| Mytilus galloprovincialis | Propranolol (11 μL); Acetaminophen (23 & 403 μg/L) | Induces oxidative stress | 1081 | |
| Brachionus rotundiformis | Acetaminophen, oxytetracycline | Production of reactive oxygen species (ROS) and increased glutathione S-transferase activity trigger oxidative stress | 1099 | |
| Danio rerio | Fluoxetine (5、16 and 40 ng/L) | Resulted in elevated levels of protein carbonyl content (PCC) and hydrogen peroxide (HPO) in various organs of Danio rerio, including the liver, gut, brain, and gills, following oxidize proteins and alter their functionality by forming new low molecular weight aggregates through oxidative stress. | 1101 | |
| Others | Rat | Benzophenone-2 (100 mg/kg) | Significant reduction in testosterone levels and an increase in 17β-estradiol levels in the blood | 1089 |
| Rat | Benzophenone-2 | Reduces circulation of triiodothyronine (T3) and thyroxine (T4) | 1090 | |
| Gobiocypris rarus | Alprazolam (10 ng/L) | Interfering effect of GPC, CHOP, Met and other neurosubstances | 1092 | |
| Lorazepam (100 ng/L) | Interfering effect of Cho, 5-HT, Trp, 5-HIAA and other neurosubstances | |||
| Oryzias latipes | Fluoxetine (100~500 μg/L 28 d exposure) | Affects estradiol concentrations in fish. | 1091 | |
| Chlorella pyrenoidosa | Diclofenac (>100 mg/L) | Alteration of chlorophyll a, lipid accumulation, and antioxidant enzyme function, thereby affecting growth | 1094 | |
| Mytilus galloprovincialis | Ibuprofen (250 ng/L) | Affects the arachidonic pathway | 1093 |
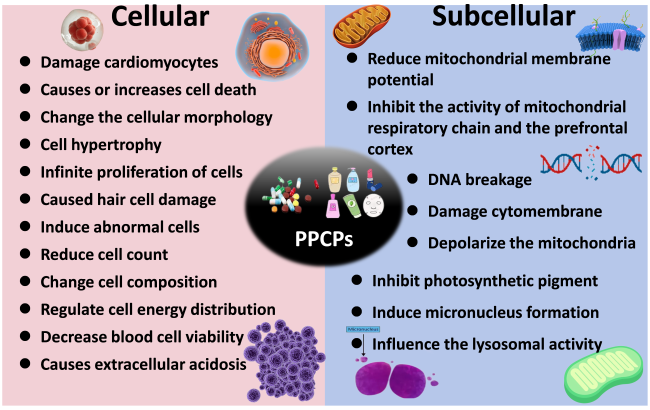
6.4.2 细胞及亚细胞水平
表17 PPCPs 在细胞和亚细胞水平的毒理效应Table 17 Toxicity effect of PPCPs in cellular and subceullar level |
| Classification | Organism | Species | PPCPs chemicals and Effective concentration | Toxicity effect | ref |
|---|---|---|---|---|---|
| Cellular level | Mammal | Human | Catecholamines | Damage heart muscle cells and increase the risk of heart attack | 1104 |
| Aminophenylsulfone (0.5 mmol/L) | Cause epidermal keratinocyte death | 1096 | |||
| Caffeine (1 mmol/L) | Abrogates the cell cycle arrest and increases cell death | 1105 | |||
| Musk xylene (10, 100, and 1000 μg/L) | Cause some irregular fusiform, protuberances and multinucleated cells, indefinite cell proliferation, ability of anchorage-independent proliferation and increase of migration and invision | 1106 | |||
| Rat | 17β-Estradiol (10~50 mg/kg) | Central lobular hepatocyte hypertrophy | 1107 | ||
| Fish | Danio rerio | Caffeine (25 μmol/L) | Induced significant hair cell damage during gestation period | 1108 | |
| Enrofloxacin (10 μg/L, 100 μg/L) | Significant reductions in macrophage and neutrophil populations and biomarkers of immunosuppressive effects | 1109 | |||
| Tetracycline (100 μg/L) | Neutrophil counts were significantly reduced in offspring zebrafish | 1110 | |||
| Grass carp | Enrofloxacin (50, 100 and 200 μg/mL) | Increased the lactic dehydrogenase release and malondialdehyde concentration, induced cell apoptosis, reduced the mitochondrial membrane potential | 1120 | ||
| Algae | Chlorella vulgaris, Desmodesmus | Chlorella vulgaris, desmodesmus (100 mg/L) | Regulation of cell morphology | 1080 | |
| Raphidocelis subcapitata | Sulfamethoxazole (8.3 μmol/L) | Inhibited growth by causing a decrease in cellular energy allocation (CEA) | 1112 | ||
| Microalgae | PPCPs | Cause the stress in microalgal cells, thereby altering cellular composition | 1111 | ||
| Invertebrate | Clam | Amoxicillin (400 μg/L) | Cause extracellular acidosis | 1113 | |
| Corbicula fluminea | Sulfamethoxazole (1, 10 and 100 μg/L) | Enhance cell apoptosis | 1114 | ||
| Manila Clam | Caffeine (15 μg/L); Ibuprofen (10 μg/L); Carbamazepine (1 μg/L); Neomycin (1 μg/L) | Decrease in blood cell viability | 1115 | ||
| Subcellular level | Mammal | Male rabbits | Codeine (4 mg/kg) | Testicular DNA breakage and caspase-dependent apoptosis | 1083 |
| Rat | Tramadol (40 mg /kg); Codeine (80 mg/kg) | The activity of mitochondrial respiratory chain complex I was inhibited in the prefrontal cortex and midbrain of mice | 1082 | ||
| Human | Homosalate (1000 μmol/L) | Induced micronucleus formation and cleavage inducing to cells | 1116 | ||
| Triclosan (1~10 μg/mL) | Depolarizes the mitochondria and increases the rate of glucose consumption in the cells, inducing metabolic acidosis | 1117 | |||
| Plant | Duckweed | Diclofenac (1, 10, 100 and 1000 μmol/L) | Induced oxidative stress in isolated duckweed chloroplasts | 1121 | |
| Algae | Chlorella spp | Triclosan (≥0.2 mg/L) | Inhibiting the increase of photosynthetic pigment content in Chlorella cells | 1118 | |
| Invertebrate | Tetrahymena thermophilus | Triclosan (1000 μg/L) | Damaged cell membrane and affected the lysosomal activity | 1121 |
6.4.3 组织器官水平
表18 PPCPs 在组织器官水平的毒理效应Table 18 Toxicity effect of PPCPs in tissue and organ level |
| Organism | Species | PPCPs chemicals and effective concentration | Toxicity effect | ref |
|---|---|---|---|---|
| Mammal | Human | 4-octylphenol (1000 μg/L) | After 1~22 days of exposure, the average testicular size decreased slightly but significantly. | 1122 |
| Rat | Benzophenone 2 (BP-2) (1000 mg/kg) | Increased uterine weight | 1123 | |
| 17β-Estradiol (10~50 mg/kg) | Diffuse Pituitary hyperplasia; breast hyperplasia: increased number of cystic follicles in the ovaries; endometrial andendometrial glandular hypertrophy | 1107 | ||
| 17β-Estradiol (-) | Uterine response: increased uterine weight due to water retention and cell proliferation | 1124 | ||
| Triclosan (30~250 mg/kg) | Decreased fatty acid synthase activity in liver and adipose tissue, inhibited fatty acid synthesis, and lowered triglyceride of serum, liver and adipose tissue | 1125 | ||
| Propranolol and atenolol (5, 10, and 20 μg/mL) | Induction of reactive oxygen species and mitochondrial damage to cardiac tissue | 1128 | ||
| Tetracycline (28.6 mg/kg) | Causing testicular dysfunction and spermatogenesis disorders in animals and humans | 1149 | ||
| Mesalazine (25, 50 and 100 μmol/L) | Triggers overproduction of mitochondrial ROS, releases cytochrome c, and causes cardiotoxic effects | 1129 | ||
| Galaxolide fragrance (HHCB) (150 mg/kg) | The liver became swollen | 1126 | ||
| Toxalide fragrance (AHTN) (100 mg/kg) | Increased liver weight and liver injury was formed | 1127 | ||
| Birds | Domestic fowl | Diclofenac (9.8 mg/kg) | Showed signs of gout with deposits of urates in the kidney, liver, heart and spleen | 1130 |
| Fish | Danio rerio | Triclosan (40~400 μg/L) | Increased pericardial effusion and changes in heart structure in fish | 60 |
| PPCPs (10 μg/L) | The similar histomorphological changes in the gut tissues of male and female fish in terms of considerably reduced VL length and size | 1139 | ||
| PPCPs (acetaminophen, carbamazepine, gemfibrozil and venlafaxine) (0.5 μg/L and 10 μg/L) | Significant decrease in embryo yield, increased oocyte atresia in female ovaries, and histological changes in kidneys | 1138 | ||
| Astemizole (1, 4, 10 and 20 μmol/L) | Occurred blood cell accumulation, pericardial edema and no blood flow in the whole body | 1136 | ||
| PPCPs (1 and 10 μg/L) | Ibuprofen and erythromycin exhibited the highest bioaccumulation in the brain tissues of female fish | 1137 | ||
| Erythromycin (0.1, 1, 10 and 100 μg/L) | Thyroid disruption | 1140 | ||
| Sulfamethoxazole (5.6 μg/L) | Thyroid endocrine disruption | 1141 | ||
| Thifluzamide (0.019, 0.19 and 1.90 mg/L) | Decreased cholesterol and triglyceride levels, induced hepatotoxicity | 1134 | ||
| Rhamdia quelen | Diclofenac (0.2, 2 and 20 μg/L) | Hepatic & gonadal antioxidant defenses | 1131 | |
| Salmo trutta | Diclofenac (0.1~100 μg/L) | Hematopoietic toxicity | 1132 | |
| Salmo trutta | Diclofenac (5~50 μg/L) | Affect the integrity of kidneys and gills. | 1133 | |
| Gasterosteus aculeatus | Naproxen (299 and 1232 μg/L) | Increased renal hematopoietic hyperplasia | 1143 | |
| Oncorhynchus mykiss | Toxalide fragrance (AHTN) (854 and 8699 μg/kg) | Lipid peroxidation in caudal kidney tissue | 1144 | |
| Cyprinodon variegatus | Triclosan (20, 50 and 100 μg/L) | Thyroid disruption | 1142 | |
| Plant | Cucumber | PPCPs (acetaminophen, caffeine, Mirton, atenolol, trimethoprim, carbamazepine, diazepam, gemfibrozil, primidone, sulfamethoxazole, phenytoin sodium, diclofenac, naproxen, ibuprofen and atorvastatin, triclosan and triclocarban) (50 μg/L; 5 μg/L and 50 μg/L) | Increase of leaf necrosis; Root activity decreased by 15.4% and 28.2% | 1145 |
| Wheat | Oxytetracycline (0.01~0.08 mmol/L) | The fresh weights of wheat roots decreased. | 1146 | |
| barley | Tetracycline (10, 100, and 200 mg/L) | Down-regulated genes related to homologous recombination in the root meristem zone and inhibited the mitosis index | 1147 | |
| Corn | Sulfadiazine (10 mg/kg) | Promoted abnormal root apical orientation in maize | 1148 | |
| Willows | Sulfadiazine (200 mg/kg) | A large increase in the number of lateral roots |
6.4.4 个体水平
表19 PPCPs在个体水平的毒理效应Table 19 Toxicity effect of PPCPs in individual level |
| Effects | Toxicity | Organism | Species | PPCP chemicals and effective concentration | Toxicity effect | ref |
|---|---|---|---|---|---|---|
| Sublethal effect | Acute toxicity | Algae | Pseudokirchneriella subcapitata | Methyl-paraben (80000 μg/L 72 h); Ethyl-paraben (52000 μg/L 72 h); n-propyl-paraben (36000 μg/L 72 h); i-propyl-paraben (48000 μg/L 72 h); n-butyl-paraben (9500 μg/L 73 h); i-butyl-paraben (4000 μg/L 73 h); Benzyl-paraben (1200 μg/L 74 h) | EC50 in growth inhibition | 1085⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓⇓~ 1150 |
| Chlorella vulgaris | Acetophenone (1000 μg/L); Benzophenone (6.855 mg/L 96 h); Diethyltoluamide (270.72 mg/L 96 h) | EC50 in growth inhibition/EC50 | 1152,1153 | |||
| Anabaena sp. | Erythromycin (0.022 mg/L 72 h); Ciprofloxacin (0.01 mg/L) | EC50 | 1154,1155 | |||
| P. subcapitata | Ciprofloxacin (2.97 mg/L 72 h) | EC50 | 1156 | |||
| Erythromycin (0.35 mg/L 72 h) | EC50 | 1154 | ||||
| Dunaliella tertiolecta | Carbamazepine (53.2 mg/L) | EC50 in growth inhibition | 1157 | |||
| Phaeodactylum tricornutum | Nano-TiO2 (167.71 mg/L) | EC50 in growth inhibition | 1158 | |||
| Ulva pertusa | Isobutylparaben (15650 μg/L 96 h) | EC50 in sporulation inhibition | 1151 | |||
| Synechococcus sp. | Erythromycin (0.23 mg/L 144 h) | EC50 | 1159 | |||
| Invertebrate | Daphnia magna | Methyl-paraben (34000 μg/L 48 h); Ethyl-paraben (7400 μg/L 48 h); n-propyl-paraben (2000 μg/L 48 h); i-propyl-paraben (3500 μg/L 48 h); n-butyl-paraben (1900 μg/L 48 h); i-butyl-paraben (3300 μg/L 48 h); Benzyl-paraben (2100 μg/L 48 h) | EC50 in the number of immobilized bodies | 1085, 1150 | ||
| Tetracycline (617.2 mg/L 48 h); Diclofenac (68.0 mg/L); Ibuprofen (101.2 mg/L); Naproxen (166.3 mg/L); Erythromycin (0.94 mg/L 48 h) | EC50 | 1160⇓~ 1162 | ||||
| Ceriodaphnia dubia | Erythromycin (0.22 mg/L 7 d); Propranolol (1.51 mg/L) | EC50 | 1163,1164 | |||
| Brachionus calyciflorus | Propranolol (2.59 mg/L) | EC50 | 1164 | |||
| Fish | Danio rerio | Ciprofloxacin (100 mg/L) | EC50 | 1165 | ||
| Pimephales promelas | Ciprofloxacin (>100 mg/L) | EC50 | ||||
| Floating plant | Lemna gibba | Chlortetracycline (114 μg/L); Lomefloxacin (38 μg/L); Sulfamethoxazole (37 μg/L) | EC25 in growth inhibition | 1166 | ||
| Reproductive toxicity | Fish | Juvenile | Estradiol (0.05~0.5 mg/kg) | Affects spawning | 1167 | |
| Diclofenac (10 mg/L) | Reduced egg hatchability | 1168 | ||||
| Ibuprofen (0.0001 mg/L) | Reduced hatchability, yolk proteins content | 1169 | ||||
| Pimephales promelas | Fluoxetine (1 μg/L) | Impacted mating behavior in male fish, specifically nest building and defending | 1171 | |||
| Fadrozole (2 μg/L 21 d exposure) | Decline in reproduction rate | 1172 | ||||
| Dicentrarchus | Estradiol (10 mg/kg) | Affect reproduction | 1170 | |||
| Invertebrate | Daphnia magna | Propranolol (0.128 mg/L) | Reduce the fecundity and reproductive rate | 1173 | ||
| Chironomus riparius | Carbamazepine (0.625 mg/kg 28 d exposure) | Inhibit pupa to be formed | 1174 | |||
| Developmental toxicity | Plant | Lactuca sativa | Erythromycin (0.1~300 mg/kg) | Inhibition of bud development | 1175 | |
| Solanum lycopersicum | Sulfadiazine (0.1~300 mg/kg) | Inhibition of bud development | ||||
| Brassica rapa chinensis | Chlortetracycline (2.5~20 mg/kg) | Inhibition of bud development | 1176 | |||
| Oenanthe javanica | Oxytetracycline (0.5~10 mg/kg) | Inhibition of plant height | 1177 | |||
| Fish | Danio rerio | Musk xylene (33 μg/L) | Significant impact in early life stages | 1178 | ||
| Muscone (33 μg/L) | Reduced fish mass and length of females and reduced fecundity | 1179 | ||||
| Amitriptyline (0.001~1000 μg/L) | Inhibition of growth and development; alteration of ACTH concentration level | 1180 | ||||
| Pimephales promelas | Propranolol (3.4 mg/L) | Reduced body weight and egg hatchability | 1181 | |||
| Algae | Scenedesmus obliquus | Ibuprofen (107.91 mg/L); aspirin (103.05 mg/L); ketoprofen (4.03 mg/L) | Inhibition of algal growth | 1182 | ||
| Amphibian species | Bufo americanus. | Acetaminophen (100 μg/L 28 d exposure) | Survival rates are affected | 1183 | ||
| Endocrine disruption | Invertebrate | Mytilus spp. | Gemfibrozil (1000 μg/L) | Endocrine disruption | 1184 | |
| Fish | Danio rerio | Galaxolide(-) | Endocrine disruption | 1086 | ||
| Neurotoxicity | Fish | Oryzias latipes | Acetaminophen (30 + 30 mg/kg, 4 h apart) | Decline in memory, learning ability and cognitive flexibility | 1186 | |
| Gambusia affinis | Fluoxetine (0.05~5 μg/L) | Sleeping time expanded | 1187 | |||
| Mammal | mice | Triclosan (1000 mg/kg, 2000 mg/kg, 4000 mg/kg) | Cause certain behavioral disorders in mice | 1185 | ||
| Amphibian species | Rana pipiens | Acetaminophen (1 μg/L 14 d of exposure) | Behavior affected | 1183 | ||
| Cardiovascular toxicity | Mammal | Human | Caffeine (-) | Correlation with cardiovascular disease (CVD) | 1188 | |
| Beagle dogs | Sibutramine (30 mg/kg) | Increasing Heart Rate and Blood Pressure in Beagles | 1189 | |||
| Lethal effect | Fish | Medaka (Oryzias latipes) | Methyl-paraben (63000 μg/L 96 h); Ethyl-paraben (14000 μg/L 96 h); n-propyl-paraben (4900 μg/L 96 h); i-propyl-paraben (4500 μg/L 96 h); n-butyl-paraben (3100 μg/L 96 h); i-butyl-paraben (4600 μg/L 96 h); Benzyl-paraben (730 μg/L 96 h) | LC50 in lethality | 1085, 1150 | |
| Danio rerio | Galaxolide (0.037 mmol/L 96 hpf); Tetracycline (406.0 mg/L 96 h); Diethyltoluamide (109.67 mg/L 96 h); Benzophenone (14.73 mg/L 96 h) | LC50 in lethality | 1086, 1153, 1160 | |||
| Carassius auratus | Ttetracycline (322.8 mg/L 96 h) | LC50 in lethality | 1160 | |||
| Invertebrate | Daphnia magna | Diethyltoluamide (40.74 mg/L 24 h); Cefoperazone (141.11 mg/L); Amoxicillin (129.3 mg/L); Aztreonam (29.3 mg/L); Benzophenone (7.63 mg/L 24 h) | LC50 in lethality | 1190 | ||
| Lumbriculus variegatus | Benzylidene-camphor (44.2 μmol/L) | Substantial reduction in fertility and significant increase in mortality | 1191 |
6.4.4.1 亚致死效应
6.4.4.2 致死效应
6.4.5 种群、群落及生态系统水平
表20 PPCPs 在种群、群落和生态系统水平的毒理效应Table 20 Toxicity effect of PPCPs in population, community and ecosystem level |
| Classification | Species or community | PPCPs chemicals and effective concentration | Toxicity effect | ref |
|---|---|---|---|---|
| Population | Gammarus fasciatus,Psephenus herricki | Cimetidine(0.07~70 μg/L) | Reduced growth and biomass of G. fasciatus, low survivorship of P.herricki when exposed to high concentrations | 1192 |
| Millepora complanata,Stylophora pistillata,Acropora sp. | Sunscreen UV filter (10~100 μg/L 2~48 h) | Induction of coral bleaching | 1193 | |
| Algal | Triclosan(400 and 200 ng/L) | Algal growth toxicity | 1194 | |
| Crustacean | Triclosan(600 and 340 ng/L) | Crustacean reproduction toxicity | 1195 | |
| Fish,alge,daphnid | Caffeine(232 μg/L ) | RQ value of caffeine against algae was calculated to be very high, i.e., 5800, whereas against fish and daphnid, it was 25.4 and 8.2, respectively | 1196 | |
| Physa pomilia | 17α-ethynylestradiol (1.0 μg/L or 100 μg/L); Fluoxetine (1.0 μg/L or 100 μg/L) | Lower population growth rate | 1198 | |
| Perca fluviatilis) | Oxazepam (1.8 μg/L) | Alters behavior and feeding rate of wild Perca fluviatilis at concentrations encountered in effluent-influenced surface waters | 1199 | |
| Perca fluviatilis,Coenagrion hastulatum | Oxazepam (2 μg/L) | Increased predator activity of perch, no behavioral effects on mayflies (direct) | 1200 | |
| Danio rerio | Triadimefon(0.25 μg/mL,0.5 μg/mL) | Triazolone at 0.25 μg/mL had an inhibitory effect on zebrafish population and growth;The zebrafish population appeared to be androgynous after treatment at a concentration of 0.5 μg/mL | 1201 | |
| Community | Stream benthic communities | Amphetamine(1 μg/L) | Suppression of gross primary production on autotrophic biofilms, compositional shift of bacterial and biofilm communities, increased dipteran (stream insect) emergence | 1202 |
| Triclosan(0.1~10 μg/L) | Increase in abundance of triclosan resistant bacteria and stimulation of periphyton growth | 1203 | ||
| Benthic bacterial communities | Triclosan(17.3 μg/g) | Triclosan Exposure Increases Triclosan Resistance and Influences Taxonomic Composition of Benthic Bacterial Communities | 1204 | |
| Algal and invertebrate benthic communities | Fluoxetine(20 μg/L); Citalopram(20 μg/L) | Suppression of primary productivity and community respiration on biofilms (algae). Increased stream insect emergence | 1205 | |
| Algae | Caffeine(5 μg/L); Acetaminophen(5 μg/L); Diclofenac(5 μg/L) | Decreased biofilm (algal) biomass (indirect) | 1206 | |
| Helisoma trivolvis,Elimia livescens | Carbamazepine(2000 ng/L) | Change biomass | 1207 | |
| Ammonia-oxidizing Archaea | Enrofloxacin(1 μg/L) | Reducing the abundance of ammonia-oxidizing archaea in a lake system | 1208 | |
| Sediment bacterial community | Ciprofloxacin(200 μg/L) | Altering the composition of sediment bacterial communities and reducing the ability to metabolize pyrene | 1209 | |
| Chlorella vulgaris,Microcystis | Ser-HCL(25~200 μg/L) | Altered the composition of photosynthetic community | 1224 | |
| Algae | Nano-TiO2 | Decrease the abundance of Acutodesmus dimorphus, Gomphonema clavatum, and Gomphonema lagenula, and increase the abundance of Oscillatoria and Chaetophora sp. | 1210 | |
| Phytoplankton | Norfloxacin | Norfloxacin can inhibit community formation and thus reduce phytoplankton abundance. These changes can disrupt trophic relationships between zooplankton and plants | 1211 | |
| Soil microbial community | Sulfamethoxazole | When 100 mg/kg sulfamethoxazole was added for 7 d, the soil microbial population density decreased significantly (p<0.05), and the utilisation rate of sugars decreased by 20.4% | 1212 | |
| Sulfamethazine; Sulfamethoxazole;Chlortetracycline;Tetracycline;Tylosin | The maximum inhibition of soil microbial respiration by sulfadiazine, sulfamethoxazole, chlortetracycline, tetracycline, tylosin, and methicillin reached 34.3%, 34.4%, 2.71%, 3.08%, 7.13%, and 38.1% | 1213 | ||
| Difloxacin | Soil denitrification rates were inhibited by 10 mg/kg of difloxacin, and this inhibition lasted for more than 30 days, suggesting that the presence of difloxacin altered the function of the soil microbial community | 1214 | ||
| Oxytetracycline | 5 μmol/L oxytetracycline or 20 μmol/LCu alone can reduce the diversity of soil microbial populations by about 25% and 15%, respectively | 1215 | ||
| Ecosystem | Amphetamine;Methamphetamine; Ketamine;Ephedrine; Cocaine;Benzoylecgonine; Methadone;Morphine; Heroin;Codeine; Methcathinone, etc | 11 drugs and their metabolites were detected in the water samples, with RQs ranging from 0 to 0.047 | 1217 | |
| Enoxacin;Chloramphenicol; Lincomycin, etc | RQ value of enrofloxacin was >1, which was at high ecological risk, while the RQ values of chloramphenicol and lincomycin were >0.1 | 1218 | ||
| Enoxacin;Ciprofloxacin; Sulfamethoxazole, etc | RQ values of enrofloxacin, ciprofloxacin, and sulfamethoxazole were >1, which showed high ecological risks to aquatic organisms | 1219 | ||
| Gale Musk,;Tuna Musk | Relevant studies have shown that the biodegradation coefficients of Galle musk and Tuna musk are 0.071 and 0.023, respectively | 1220 | ||
| Xylene Musk;Ketone Musk | The bioconcentration factors (BCF) for xylene musk, ketone musk and galax musk were 3800, 760 and 1584, respectively | 1221 | ||
| Germicides;Disinfectants | Germicides and disinfectants are widely added to all types of household cleaning products and can enter the food chain from the environment and accumulate in plants, animals and humans | 1225 | ||
| Sulfadimethoxine(50 μg/kg) | 50 μg/kg sulfadimethoxine reduces soil nitrification | 1222 | ||
| Caffeine;Carbamazepine; Ibuprofen | Three pharmaceuticals posed risk to aquatic organisms, with PI values of 10.3, 1.3, and 0.3, respectively. The maximum RQ value for caffeine was 10.3, RQ values of carbamazepine and ibuprofen ranged from 0.63~1.86, 0.25~1.48, respectively | 1223 |
6.4.6 总结与展望
7 新污染物的人体暴露与健康风险
7.1 基于人体健康风险导向的环境污染物筛查
7.1.1 暴露评估
7.1.1.1 典型高通量外暴露评估模型
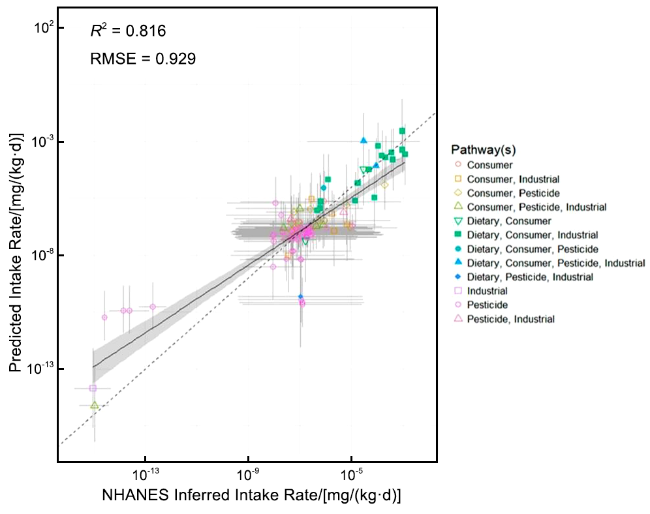
图34 SEEM模型预测能力。注:NHANES生物监测数据推断的摄入率与SEEM元模型预测之间的相关性;虚线表示同一性(完美预测变量),而实线表示中位数的最小二乘回归(灰色阴影区域表示标准误差)Fig.34 SEEM model predictive capacity. Note: This figure illustrates the correlation between intake rates inferred from NHANES biomonitoring data and predictions made by the SEEM meta-model. The dashed line represents identity (perfect prediction variable), while the solid line denotes the median least squares regression (with the gray shaded area indicating standard error) |
7.1.1.2 基于大数据和毒代动力学的人体内暴露特征预测评估
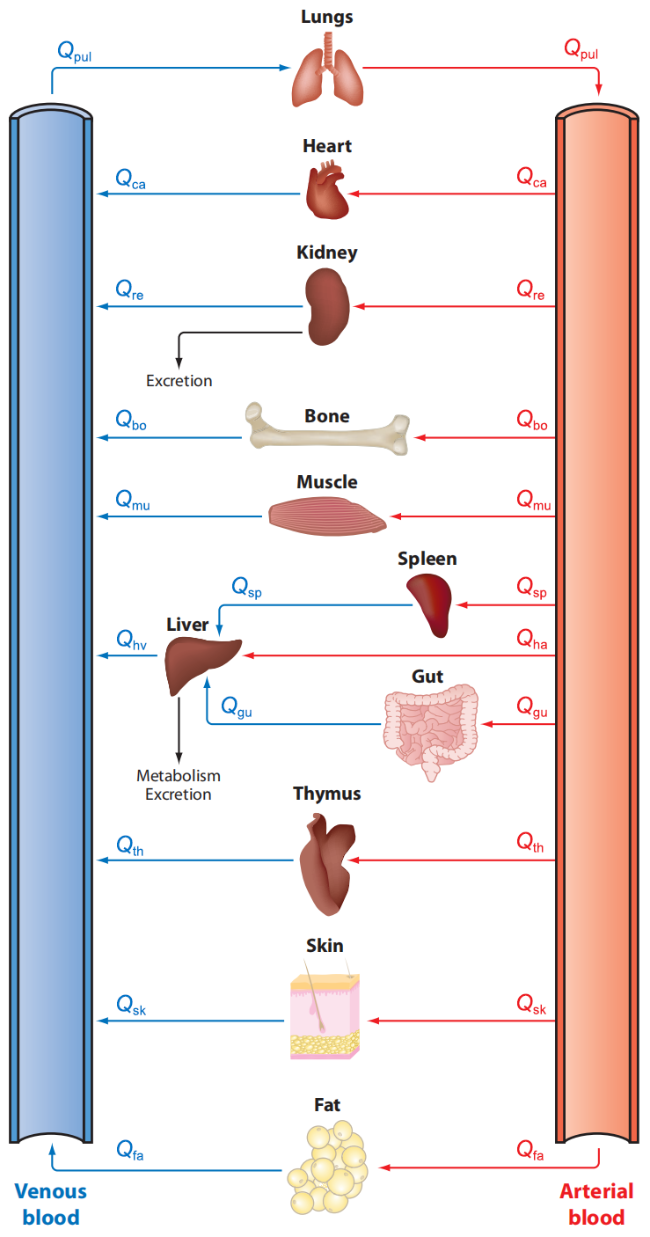
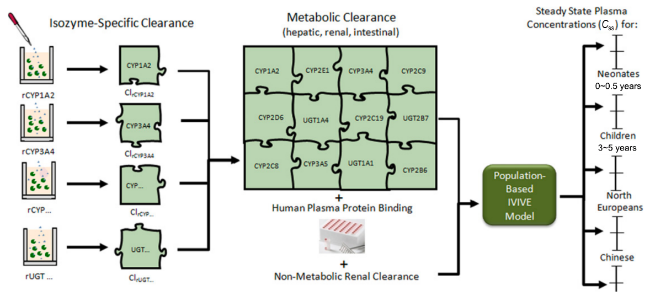
图35 基于生理的全身药代动力学模型。注:Qpul、Qca、Qre、Qbo、Qmu、Qsp、Qha、Qhv、Qgu、Qth、Qsk、Qfa分别代表流向肺、心脏、肾脏、骨骼、肌肉、脾脏、肝脏、肝静脉、肠道、胸腺、皮肤和脂肪的血流量。输入部位可以是身体的任何部位。此模型只展示了肝脏和肾脏的清除过程,而某些药物或污染物也可以在其他部位发生清除[1229]。Fig.35 Physiologically-based whole-body pharmacokinetic model. This model illustrates blood flow to various organs including the lungs (Qpul), heart (Qca), kidneys (Qre), bones (Qbo), muscles (Qmu), spleen (Qsp), liver (Qha), hepatic vein (Qhv), intestines (Qgu), thymus (Qth), skin (Qsk), and fat (Qfa). The site of entry can be any part of the body. The model exclusively shows clearance processes in the liver and kidneys, though clearance of certain drugs or pollutants may also occur at other sites[1229]. |
| Item | Mouse | Rat | Monkey | Human |
|---|---|---|---|---|
| Ventilation | ||||
| Alveolar/[L/(h·kg)] | 29.0 | 15.0 | 15.0 | 15.0 |
| Blood flows | ||||
| Total/[L/(h·kg)] | 16.5 | 15.0 | 15.0 | 15.0 |
| Muscle/unitless, the same below | 0.18 | 0.18 | 0.18 | 0.18 |
| Skin | 0.07 | 0.08 | 0.06 | 0.06 |
| Fat | 0.03 | 0.06 | 0.05 | 0.05 |
| Liver (arterial) | 0.035 | 0.03 | 0.065 | 0.07 |
| Gut (portal) | 0.165 | 0.18 | 0.185 | 0.19 |
| Other organs | 0.52 | 0.47 | 0.46 | 0.45 |
| Tissue volumes | ||||
| Body weight/kg | 0.02 | 0.3 | 4.0 | 80.0 |
| Body water/unitless, the same below | 0.65 | 0.65 | 0.65 | 0.65 |
| Plasma | 0.04 | 0.04 | 0.04 | 0.04 |
| RBCs | 0.03 | 0.03 | 0.03 | 0.03 |
| Muscle | 0.34 | 0.36 | 0.048 | 0.33 |
| Skin | 0.17 | 0.195 | 0.11 | 0.11 |
| Fat | 0.10 | 0.07 | 0.05 | 0.21 |
| Liver | 0.046 | 0.037 | 0.027 | 0.023 |
| Gut tissue | 0.031 | 0.033 | 0.045 | 0.045 |
| Other organs | 0.049 | 0.031 | 0.039 | 0.039 |
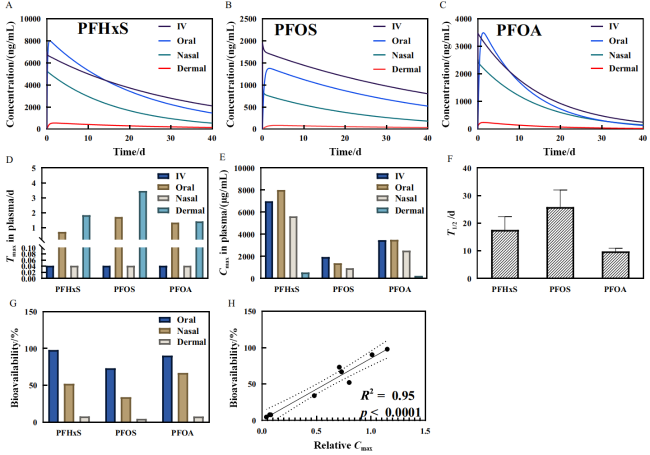
图36 PFAS的动力学曲线与动力学参数。通过模型模拟的小鼠1 mg/kg单次暴露后的PFHxS(A)、PFOS(B)和PFOA(C)在小鼠血浆中的浓度-时间曲线,以及PFAS达到峰值的时间(Tmax)(D)、最大浓度(Cmax)(E)、消除半衰期(T1/2)(F)和生物有效性(G)。相对Cmax(经口或经皮或经鼻Cmax与静脉注射Cmax的比值)与生物有效性(H)之间的线性拟合,虚线表示95%置信区间[1246]Fig.36 Kinetic Curves and Parameters for PFAS. Concentration-time curves for PFHxS (A), PFOS (B), and PFOA (C) in mouse plasma following a single 1 mg/kg exposure, modeled to show the time to peak concentration (Tmax) (D), maximum concentration (Cmax) (E), elimination half-life (T1/2) (F), and bioavailability (G). A linear fit between relative Cmax (the ratio of oral, dermal, or nasal Cmax to intravenous Cmax) and bioavailability (H) is shown, with dashed lines representing the 95% confidence interval[1246] |
图38 人体内暴露浓度预测模型(HExpPredict)的构建Fig. 38 Construction of the human exposure prediction model (HExpPredict) |
图39 人体内暴露浓度预测模型(HExpPredict)的预测能力Fig. 39 Predictive capacity of the human exposure prediction model (HExpPredict) |
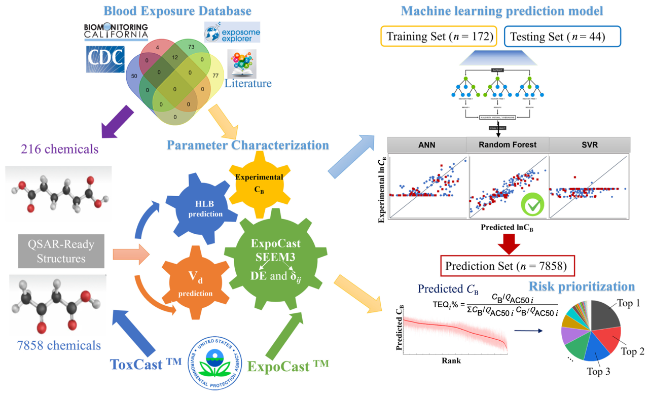
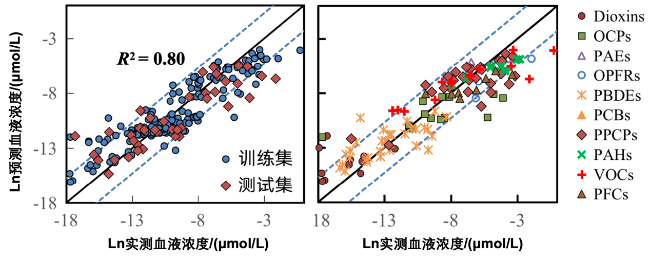
表22 机器学习模型的预测能力Table 22 Predictive capacity of machine learning models |
| Model Types | Training Set (n = 172) | Test Set (n = 44) | ||||||
|---|---|---|---|---|---|---|---|---|
| RMSE | MAE | MAPE | R2 | RMSE | MAE | MAPE | R2 | |
| Random Forest | 1.66 | 1.28 | 0.29 | 0.80 | 2.07 | 1.56 | 0.23 | 0.72 |
| Artificial Neural Networks | 2.83 | 2.13 | 0.39 | 0.41 | 3.07 | 2.56 | 0.35 | 0.39 |
| Support Vector Machine | 3.52 | 2.81 | 0.69 | 0.08 | 3.79 | 3.22 | 0.47 | 0.06 |
表23 随机森林模型对不同种污染物的预测能力Table 23 Predictive capacity of the random forest model for different pollutants |
| Classtimes | N | RMSE | Mean RMSE |
|---|---|---|---|
| PCBs | 86 | 0.64 | 0.91 |
| PAHs | 10 | 0.70 | |
| PAEs | 5 | 0.71 | |
| Dioxins | 11 | 0.73 | |
| PFCs | 8 | 0.83 | |
| OPFRs | 7 | 0.85 | |
| VOCs | 15 | 0.86 | |
| PBDEs | 31 | 0.94 | |
| PPCPs | 29 | 1.18 | |
| OCPs | 14 | 1.68 |
7.1.2 毒性评估
7.1.2.1 QSAR
7.1.2.2 机器学习预测污染物毒性
表24 公共毒理学数据库及毒性终点的最佳表现机器学习模型Table 24 Best performing machine learning models for public toxicology databases and toxicity endpoints |
| Toxicity Endpoints | Database Name | Machine Learning Model Ref |
|---|---|---|
| Cardiac Toxicity (hERG Binding) | PubChem bioassay, CHEMBL bioactivity | 1255⇓⇓⇓~1259 |
| Acute Oral Toxicity (LD50) | Li et al. set, admetSAR, MDL Toxicity, EPA Toxicity Estimation Software Tool, SuperToxic | 1260,1261 |
| Hepatotoxicity (DILI) | Liver Toxicity Knowledge Base (LTKB), LiverTox, Hepatox | 1262,1263 |
| Nuclear Receptor and Stress Response | Tox21 | 1264⇓⇓~1267 |
| Mutagenicity | Ames data collection | 1268⇓~1270 |
| Carcinogenicity | Carcinogenic Potency Database (CPDB) | 1271 |
| General Toxicity | TOXNET, Toxin and Toxin Target Database (T3DB), SIDER | 1260, 1272,1273 |
7.1.3 新污染物的高通量毒性筛选:ToxCast体外高通量筛选和ToxPI分数
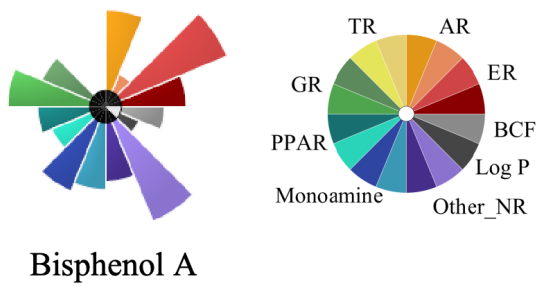
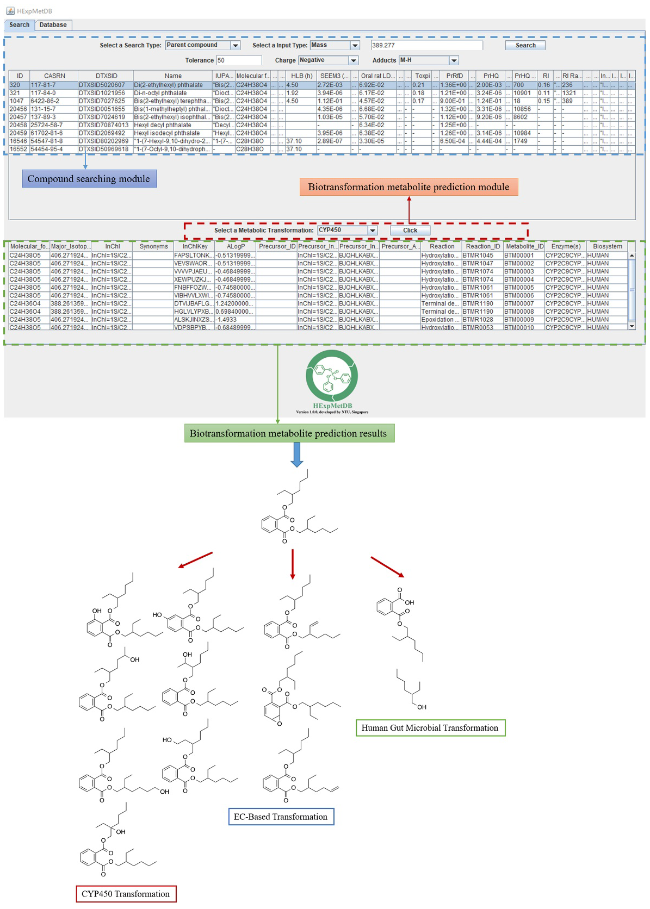
7.1.4 高通量暴露组学数据库(HExpMetDB)
7.1.5 基于风险评估的新污染物筛查策略
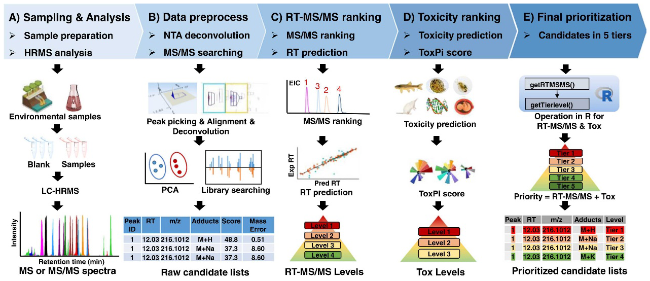
7.1.5.1 非靶向分析中快速自动表征化合物毒性的优先级框架
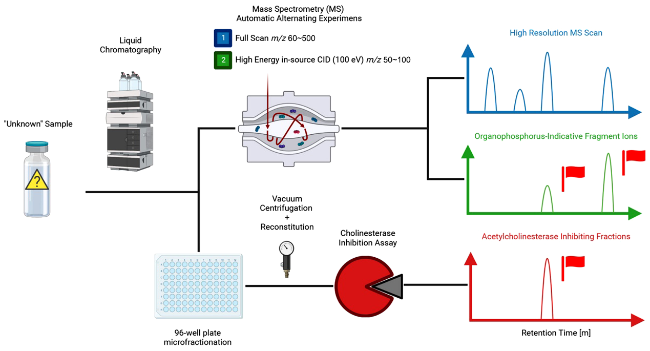
7.1.5.2 结合效应导向分析和特征指示碎片的有毒污染物筛查
7.1.5.3 基于MS/MS谱的分子描述符预测模型
7.1.5.4 基于机器学习的风险驱动下特征碎片优先的非靶向筛查应用
7.2 新污染物在人体内的ADME过程与构效关系
7.2.1 新污染物在人体内的ADME过程
7.2.2 新污染物的化学结构对ADME过程的影响
图48 (A)多溴联苯醚及其羟基化代谢物对雌激素相关受体γ(ERRγ)的结构依赖性活性研究,(B)分子对接得到的化合物与ERRγ结合口袋中配体的结合构象[1352]Fig. 48 (A) Structure-dependent activity of polybrominated diphenyl ethers and their hydroxylated metabolites on estrogen-related receptor γ (ERRγ), (B) Binding conformations of the compounds with ligands in the ERRγ binding pocket obtained by molecular docking[1352] |