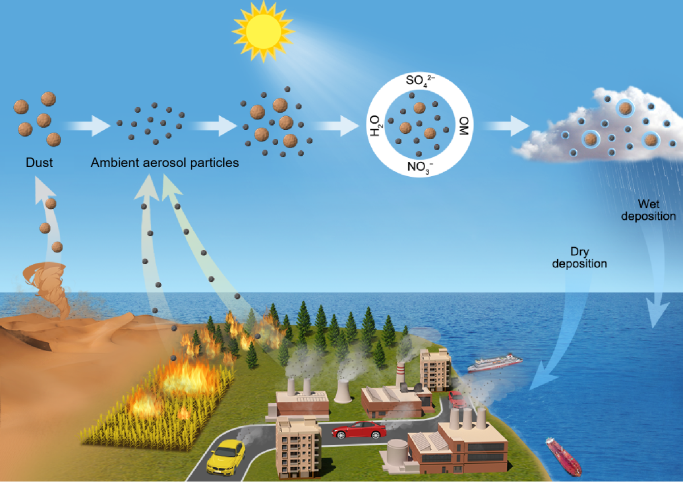
1 引言
2 前处理方法
2.1 过滤
2.2 海水中可溶性铝的分离富集
表1 海水中可溶性铝的分离富集方法Table 1 Separation and preconcentration method for dissolved aluminum in seawaters |
| Methods | Advantages | Drawbacks |
|---|---|---|
| SPE | High level of automation. Low risk of contamination. | High technical experience when combined with FIA |
| LLE | Easy to operate. | Long extraction time Small extraction efficiency Labor intensive |
| DLLME | Short extraction time. Extractant is easy to collect. | Not robust enough to be completely automated. |
| CPE | Less laboratory wastes. | Mostly off-line Labor intensive |
| HPLC | High sensitivity. Suitable for Al species separated. | Mostly off-line High instrument requirements |
2.2.1 固相萃取
2.2.2 液相萃取
2.2.3 液相色谱
2.3 土壤和气溶胶中可溶性铝的提取
3 分析检测方法
3.1 紫外可见光分光光度法
表2 紫外可见光分光光度法在环境中的应用实例Table 2 Method for determination of dissolved aluminum based on UV-Visible Spectrophotometry |
| Colour-forming system | Detection limit/nmol/L | Linear range/µmol/L | Sample matrix | Ref |
|---|---|---|---|---|
| Al-Aluminon | 480 | 29.63~137.04 | well and pond water | 55 |
| Al-CAS | 0.8 | 0.001~0.25 | seawater | 54 |
| Al-ECR | 5.19 | 0.15~14.81 | waste and tap water | 56 |
| Al-ECR | 74 | 2.78~23.15 | surface, drinking water, and tap water | 57 |
| Al-ECR | 11.11 | - | soil extracts and ground waters | 58 |
| Al-Quercetin | 50 | 0.1 ~ 80 | river and stream water | 59 |
| Al-Quercetin | 260 | 0.74~18.52 | tap water | 60 |
| Al-Morin | 160 | 0.1~0.8 | - | 61 |
| Al-Morin | - | 0.37~185.19 | natural water(e.g. river, pond and seawater) | 62 |
3.2 荧光光度法
3.3 原子光谱法
3.4 电感耦合等离子体质谱法
4 气溶胶铝可溶性的研究进展
表3 全球部分区域气溶胶中铝可溶性的观测结果Table 3 Distribution of Al solubility in atmospheric aerosols in global distinct regions |
| Location | Leaching solution | Leaching technique | Contact time | Detection method | Sample | Al solubility |
|---|---|---|---|---|---|---|
| Pacific Ocean (Hawaii) [53] | Seawater | Batch (shaking) | 5 min | FIA | TSP | 0.087%~14.3% |
| Pacific Ocean[88] | Deionized water | Flow-through | Instant | HR-ICP-MS | TSP | 0.2%~15.9% |
| North Atlantic Ocean[89] | Deionized water | Flow-through | Instant | HR-ICP-MS | TSP | 4%~50% |
| North Atlantic Ocean[75] | Deionized water | Flow-through | Instant | ICP-MS | TSP | 0.34%~28% |
| Acetic acid | Batch (soaking) | 10 min | 4.1%~100% | |||
| North East Atlantic Ocean[49] | Ammonium acetate | Batch (shaking) | 60~120 min | ICP-OES and ICP-MS | dp>1.09 μm | 0.43%~2.03% |
| dp<1.09 μm | 4.53%~10.31% | |||||
| South East Atlantic Ocean[71] | Ammonium acetate | Batch (shaking) | 60 min | ICP-OES | TSP | 3%~78% |
| PM1 | 7%~79% | |||||
| East China Sea (Huaniao Island) [82] | Deionized water | Batch (sonication) | 40 min | ICP-OES | TSP | 0.1%~23% |
| East China Sea[81] | Deionized water | Batch (shaking) | 60 min | ICP-OES | TSP | 5.1% ± 2.8% (non-dust period) |
| 1.1 %± 1.8% (dust period) | ||||||
| Qingdao, China[90] | Deionized water | Batch (shaking) | 30 min | ICP-MS | TSP | 2.8% ± 3.9% |
| Hiroshima, Japan[50] | Deionized water | Batch (shaking) | 30 min | ICP-MS | TSP | 1.46%~7.39% |
| dp>1.3 μm | 3.25% ± 3.41% | |||||
| dp<1.3 μm | 8.82% ± 6.48% |