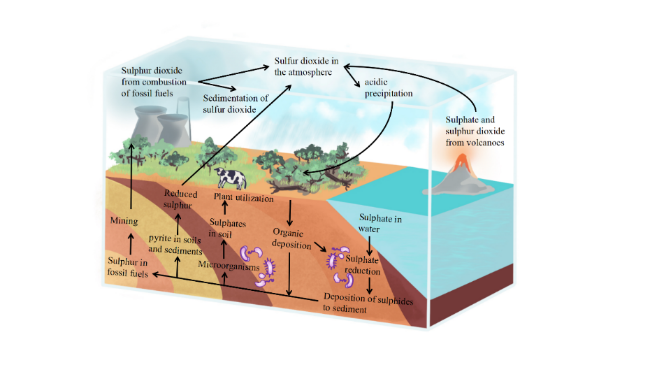
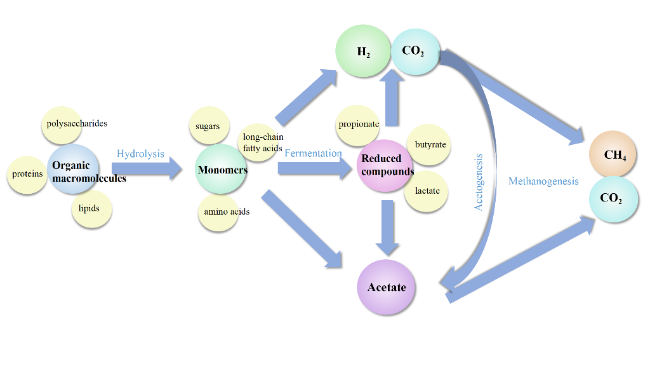
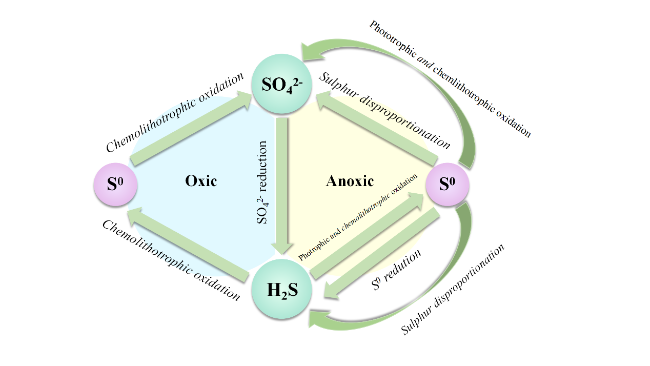
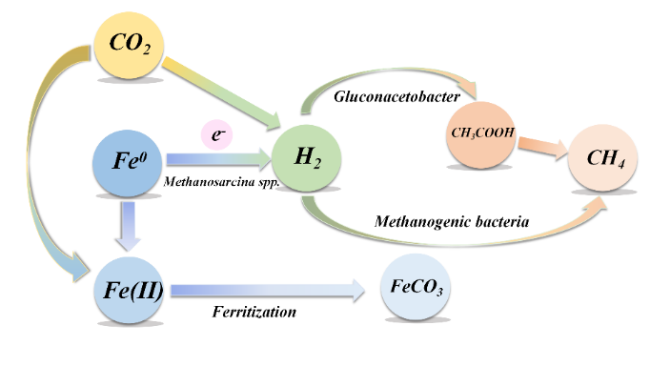
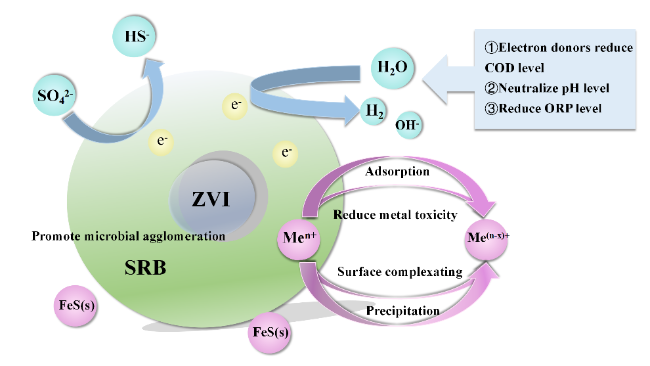
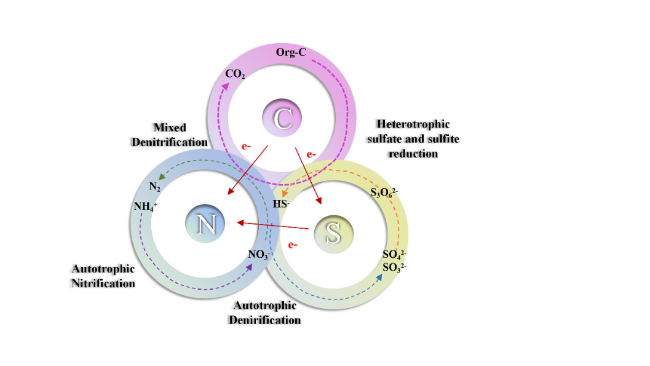
1 引言
2 硫酸盐还原菌在水环境中的菌群关系
2.1 共生关系
2.2 竞争关系
2.3 不同环境下硫酸盐还原菌的竞争对象
表1 不同含硫酸盐废水处理过程实例Table 1 Examples of treatment processes for wastewater with different sulfate content |
| The role of SRB in different water treatment processes | Sulfate concentration in the system (mg/L) |
|---|---|
| Using BES to treat high-strength sulfate wastewater (1000 mg/L) without external electron donors and recover elemental sulfur[16]. | The concentration of sulfate in wastewater is 1000 mg/L. |
| The integrated system composed of anaerobic SRBR and SOFC is applied to treat high concentration sulfate/sulfide (1300 mg/L) organic wastewater. The sulfides produced by SRB during sulfate reduction process not only act as endogenous electron media, but also act as electron donors to oxidize sulfides into non-toxic sulfur, which can be recovered through precipitation[17]. | The concentration of sulfate in wastewater is 1300 mg/L. |
| In the UASB reactor, NH4+oxidation is driven by SO42- reduction, where anaerobic ammonia oxidizing bacteria dominate denitrification, SRB and SOB participate in sulfur cycling, and receive the electrons required by anaerobic ammonia oxidizing bacteria through direct interspecies electron transfer (DIET) pathway[18]. | NH4+/SO42-:0.8 (NH4+-N:70 mg/L, SO42-S: 80 mg/L) |
| During the anaerobic digestion process of slaughterhouse wastewater sludge at medium temperature, the high pH value of the initial sulfur-containing sludge (with a sulfate content of 500 mg/L) inhibits sulfate reducing bacteria, which is beneficial for the growth of methane producing bacteria[19]. | The concentration of sulfate solution in sulfur-containing sludge digestion is 500 mg/L. |
| During the 330 day operation of UASB in treating sulfate rich wastewater, methane production gradually decreased and sulfate reduction efficiency continued to improve. Only after complete reduction of sulfate can MPA convert the remaining COD into methane[20]. | The sulfate content in wastewater is 3000 mg/L. |
| The two-phase anaerobic process was used to start at low load for 33 days. At COD/SO42-~3 (sulfate content of mg/L), the sulfate removal rate in the effluent decreased with the decrease of HRT[10]. | The first stage operation dosage is 500 mg/L, and the second stage is 1000 mg/L. |
| Anaerobic co digestion was carried out on kitchen waste (FW) and waste activated sludge (WAS). When the sulfate concentration is 50, 100, and 400 mg S/L, the co digested methane production is not affected, but significantly decreases at 200 and 300 mg S/L. The presence of sulfates can stimulate sulfate reducing bacteria to convert propionic acid into acetic acid, providing another metabolic pathway for methane production[9]. | The best processing efficiency is achieved when the concentration is greater than 50 mg/L but less than 200 mg/L. 50 mg/L ≤ Sulfate concentration ≤ 200 mg/L |
表2 硫酸盐还原、产甲烷和产乙酸反应Table 2 Sulfate reduction, methane production, and acetic acid production reactions |
| Equation | ∆Gº (kJ/reaction) |
|---|---|
| Methanogenic reactions | |
| 4H2+HCO3-+H+→CH4+3H2O | -135.6 |
| Acetate-+H2O→CH4+HCO3- | -31 |
| Acetogenic reactions | |
| Propionate-+3H2O →Acetate-+HCO3-+H++3H2 | +76.1 |
| Butyrate-+2H2O→2Acetate-+H++2H2 | +48.3 |
| Lactate-+2H2O →Acetate-+HCO3-+H++2H2 | -4.2 |
| Sulphate-reducing reactions | |
| 4H2+SO42-+H+→HS-+4H2O | -151.9 |
| Acetate-+SO42-→2HCO3-+HS- | -47.6 |
| Propionate-+0.75SO42- →Acetate-+HCO3-+0.75HS-+0.25H+ | -37.7 |
| Butyrate-+0.5SO42- →2Acetate-+0.5HS-+0.5H+ | -27.8 |
| Lactate-+0.7SO42- →Acetate-+HCO3-+0.5HS- | -80.2 |
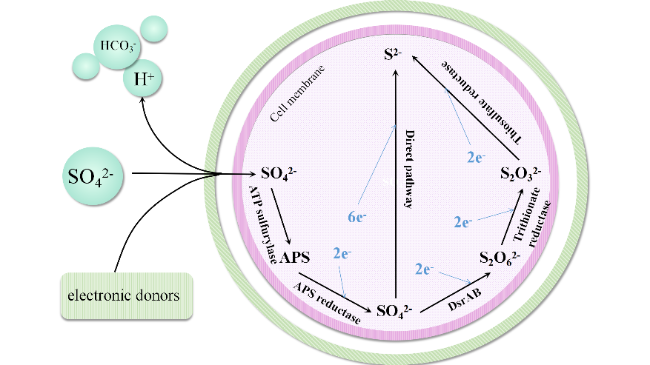
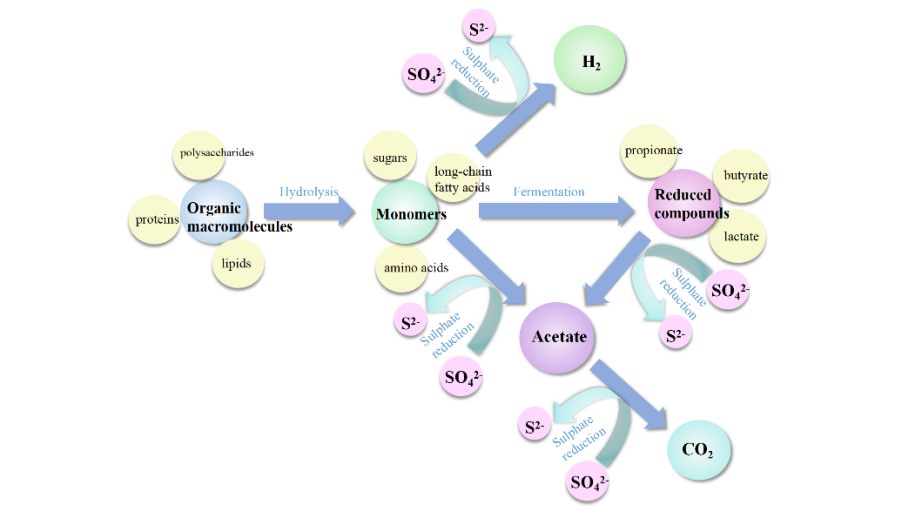
3 硫酸盐还原菌的电子供体利用途径
3.1 热力学上SRB的电子供体利用
表3 硫酸盐和硝酸盐在不同电子供体下的反应[30⇓~32]Table 3 Reaction of sulfates and nitrates with different electron donors[30⇓~32] |
| Reactions | ∆Gº ((kJ/reaction) |
|---|---|
| Sulfidogenic reactions | |
| 0.125CH3COO-+0.187H++0.125SO42- →0.125CO2+0.125HCO3-+0.0625H2S+0.0625HS- +0.125H2O | -6.18 |
| 0.125SO42-+0.5H2+0.187H+ →0.0625H2S+0.0625HS-+0.5H2O | -19.4 |
| 0.0625C6H12O6+0.126SO42-+0.187H+ →0.25CO2+0.0625H2S+0.0625HS-+0.25H2O | -20.84 |
| 0.083CH3CH(OH)COO-+0.125SO42-+0.187H+ →0.166CO2+0.0625H2S+0.0625HS-+0.25H2O | -11.83 |
| 0.25SO42-+H2+0.25H+→0.25HS-+0.5H2O | -10.68 |
| CH4+SO42-→HCO3-+HS-+H2O | -49.49 |
| Nitrate-reduction reations | -2720 |
| NO3-+3H2+0.23CO2+H+ →0.48N2+0.046C5H7O2N+3.4H2O SO42-+4.2H2+0.015NO3-+0.075CO2+1.515H+ →0.5H2S+0.5HS-+4.17H2O+0.015C5H7O2N 0.0416C6H12O6+0.2NO3-+0.2H+ →0.25CO2+0.35H2O+0.1N2 |
3.2 电介导对SRB菌群的影响
| Non biological conductive materials | characteristic |
|---|---|
| Iron oxide | Different types of iron oxide particles have different conductivity. The conductivity of iron oxide can determine the methane production rate of microbial communities. (Semi) conductive iron oxide can promote methane production of acetate and ethanol, and improve lag time and yield. |
| Biocarbon and activated carbon | Biochar provide substrate for microbial adhesion and attachment, and reduce inhibition by absorbing possible inhibitors in Anaerobic digestion. Biochar mediated DIET promoted the degradation of organic acids. Different particle sizes of GAC and powdered activated carbon (PAC) have an impact on the enhancement of methane generation |
| Carbon fibre | The carbon cloth and felt have good conductivity, and the biofilm is easy to form on the surface of the carbon fiber, which helps to increase the residence time of biomass in the reactor, thus improving the AD performance. The carbon cloth can alleviate the acid shock and high hydrogen partial pressure in the Anaerobic digestion. |
| Graphene | It has unique physical and chemical properties, such as extremely high conductivity, large surface area, and high mechanical strength. After adding Graphene, the activity of the main coenzyme F420 in the process of methane production was significantly increased. A smaller amount of Graphene is required for DIET stimulation. |
| Carbon nanotubes | Carbon nanotubes can promote symbiotic co cultivation and methane generation in complex environmental matrices, but their economic costs are high. |
3.3 SRB节能产氢途径
4 硫酸盐还原菌的调节控制因素
4.1 外加电场的影响
4.2 导电介质
4.3 碳源(类型及碳硫比)对SRB 的影响
表5 硫酸盐还原反应中不同电子供体的热力学[90]Table 5 Thermodynamics of different electron donors in sulfate reduction reaction[90] |
| Electron donors | Product | ∆Gº (kJ/reaction) |
|---|---|---|
| 4H2+SO42-+H+ | HS-+4H2O | -151.9 |
| 4Formate-+SO42-+H+ | HS-+4HCO3- | -146.7 |
| Acetate-+SO42- | HS-+2HCO3- | -47.3 |
| Propionate- +SO42-+H2 | HS-+HCO3-+Acetate-+H2O | -75.8 |
| Propinate- +2SO42-+H2 | 2HS-+3HCO3-+H2O | -122.7 |
| Butyrate- +3SO42-+2H2 | 3HS-+4HCO3-+5H2O | -198.4 |
| Butyrate- +SO42-+2H2+6H2O | HS-+2Acetate- | -103.8 |
| 4Methanol+3SO42- | 3HS-+4HCO3-+4H2O+H+ | -361.7 |
| 2Methanol+SO42- | HS-+2Formate-+H++2H2O | -108.3 |
| 2Ethanol+SO42- | 2Acetate-+ HS-+2H2O+H+ | -132.7 |
| Glucose+SO42- | HS-+2Acetate-+2HCO3-+3H+ | -358.2 |
| Glucose+3SO42- | 3HS-+HCO3-+3H+ | -452.5 |
| 2Lactate-+SO42- | HS-+2Acetate-+2HCO3-+H+ | -159.6 |
4.4 OLR和HRT
4.5 pH值
4.6 温度
表6 对水环境中SRB的调节因素Table 6 Regulating factors of SRB in water environment |
| Influence factor | Influence | Adjustment method |
|---|---|---|
| External electric field | The application of an electric field not only changes the type of microbial community but also alters the redox potential. | Select the appropriate electric field strength by adjusting the voltage or current magnitude. |
| Conductive medium | It affects the electronic transfer pathway and its physical and chemical properties can also have an impact on the system. It may also have an impact on parameters such as current density, potential range, and pH value required for wastewater treatment systems. | Choosing appropriate conductive particles and adding methods can affect the efficiency of conductive particles in wastewater treatment by adjusting the redox potential. |
| Carbon source | The conversion pathways of different carbon sources affect the reduction process of sulfates, while the metabolic process of carbon sources causes changes in the pH and OPR of the environment. | Different microbial communities have different advantageous carbon sources, which should be selected based on the type of pollutant and the required production capacity. Adjust microbial behavior by adjusting the carbon sulfur ratio. |
| OLR and HRT | It affects the balance between microorganisms and organic pollutants. | Select based on reactor type and inlet characteristics. |
| pH | It affects the metabolic types of substrates and determines the forms of sulfides in the environment. | The optimal pH value suitable for the growth of dominant bacterial communities varies depending on the substrate and digestion technique |
| Temperature | The competitive effect of microbial communities varies at different temperatures. Higher temperatures can also increase the dissolution of hydrogen sulfide in water. | Adjust the temperature according to the type of dominant microbial community. |