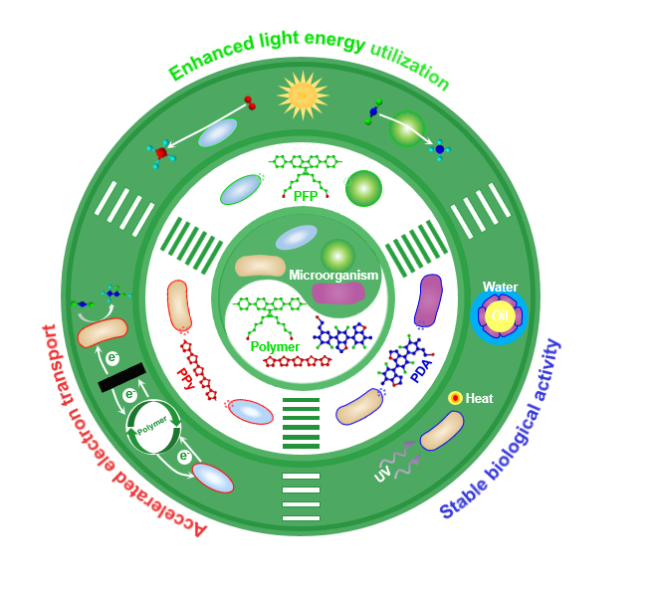
1 引言
2 聚合物-微生物杂合体的构建
2.1 共轭聚合物
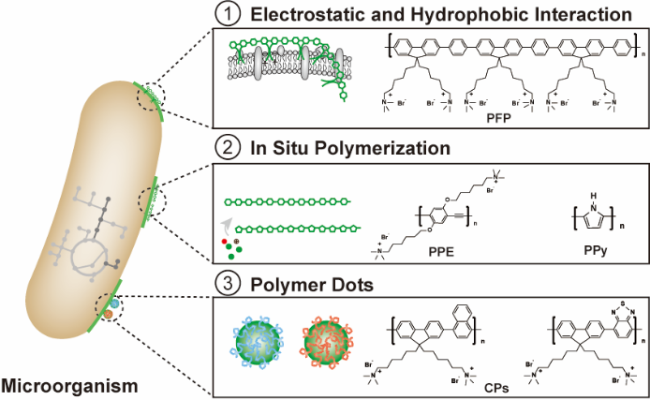
图2 共轭聚合物与微生物结合用于构建生物杂合体:(1)共轭聚合物通过静电相互作用和疏水相互作用结合在微生物表面;(2)共轭聚合物通过原位聚合结合在微生物表面;(3)聚合物量子点等纳米结构的共轭聚合物结合在微生物表面Fig. 2 The construction of biohybrids through the combination of the conjugated polymer (CP) with the microorganism. (1) The combination of the CP with the microorganism through electrostatic interaction and hydrophobic interaction. (2) The combination of the CP with the microorganism through in situ polymerization. (3) The combination of the CP nanoparticles such as polymer dots with the microorganism |
2.2 聚电解质和多酚类聚合物
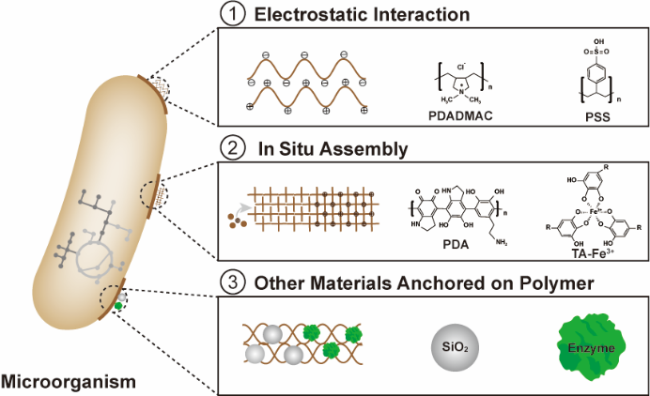
图3 聚电解质和多酚类聚合物与微生物结合用于构建生物杂合体:(1)聚电解质通过静电相互作用结合在微生物表面;(2)多酚类聚合物通过原位聚合和配位作用组装在微生物表面;(3)聚合物在细胞表面集成其他功能材料如无机纳米颗粒或生物酶Fig. 3 The construction of biohybrids through the combination of the polyelectrolytes and polyphenols with the microorganism. (1) The combination of polyelectrolytes with the microorganism through electrostatic interaction. (2) The assembly of polyphenols on the microorganism through in situ polymerization or coordination. (3) The integration of other functional materials such as inorganic nanoparticles or biological enzymes on the microorganism |
3 聚合物-微生物杂合体强化生物催化
3.1 提升光能利用强化微生物光合作用
图4 光活性聚合物增强微生物光能利用:(a)PBF-小球藻杂合体显示增强的光反应活性[55];(b)PDI/PFP-热醋穆尔氏菌杂合体进行光驱动CO2还原产乙酸[47];(c)PFP集成的多生物共生体利用CO2和N2进行光驱动γ-PGA生物合成[26]Fig. 4 Photoactive polymers for enhanced microbial utilization of light. (a) PBF-Chlorella pyrenoidosa biohybrid with enhanced activity in light reaction of photosynthesis[55]; Copyright 2020, Science. (b) PDI/PFP-Moorella thermoacetica biohybrid for solar-driven CO2 reduction to acetic acid[47]; Copyright 2020, Wiley-VCH. (c) PFP-integrated multi-organism symbiont for solar-powered γ-PGA biosynthesis by utilizing CO2 and N2[26]. Copyright 2020, Science |
3.2 加速电子传递强化微生物电合成
图5 导电聚合物加速电子传递强化微生物电合成:(a)PFP包裹的希瓦氏菌MR-1促进电子摄入强化微生物电合成[62];(b)杂合体中聚合物设计策略强化双向EET[50]Fig. 5 Conductive polymers for accelerated electron transfer and enhanced microbial electrosynthesis. (a) PFP-coated Shewanella oneidensis MR-1 with enhanced microbial electrosynthesis through inward electron uptake[62]; Copyright 2023, Elsevier. (b) Polymer design strategy in biohybrids to enhance bidirectional EET[50]. Copyright 2023, Wiley-VCH |
3.3 稳定细胞活性强化微生物化学转化
图6 聚合物稳定细胞活性强化微生物化学转化:(a)PDA包裹的黏红酵母显示出高的催化循环稳定性[35];(b)PDA包裹的大肠杆菌显示出高的乳液界面生物催化性能[52];(c)PDADMAC/SiO2纳米颗粒包裹的大肠杆菌在不同温度下显示出随着涂层厚度变化而变化的生物催化性能[34]Fig. 6 Polymer-stabilized cells with enhanced biocatalytic chemical transformation. (a) PDA-coated Rhodotorula glutinis with high cycle catalytic stability[35]; Copyright 2017, RSC. (b) PDA-coated Escherichia coli with high biocatalytic performance at the emulsion interface[52]; Copyright 2022, Springer Nature. (c) PDADMAC/SiO2 coated Escherichia coli with enhanced biocatalytic performance that varied with coating thickness at different temperatures[34]. Copyright 2019, Springer Nature |