

钠离子电池层状氧化物正极材料的耐高电压性能
 |
雷文 副教授,湖北省“楚天学子”,澳门青年学者。主要研究方向为先进功能材料和新能源器件,主持国家自然科学基金、湖北省自然科学基金等项目。以第一作者或通讯作者在Energy Environmental Science, Materials Today, Advanced Energy Materials, Advanced Functional Materials等期刊发表论文40余篇,被引次数4000余次。 |
 |
张海军 博士研究生导师,楚天学者特聘教授。主要研究方向为多孔陶瓷、耐火材料、纳米催化剂、材料计算和新能源器件。在Nature Materials及Advanced Materials等国内外知名刊物及学术会议上发表学术论文540余篇,被引6000余次。 |
收稿日期: 2023-10-30
修回日期: 2024-02-17
网络出版日期: 2024-03-13
基金资助
国家自然科学基金项目(52072274)
国家自然科学基金项目(52272021)
国家自然科学基金项目(52232002)
武汉市知识创新专项项目(2023020201010131)
Study on the High-Voltage Resistance of Layered Oxide Cathode Materials for Sodium-Ion Batteries
Received date: 2023-10-30
Revised date: 2024-02-17
Online published: 2024-03-13
Supported by
National Natural Science Foundation of China(52072274)
National Natural Science Foundation of China(52272021)
National Natural Science Foundation of China(52232002)
Knowledge Innovation Project of Wuhan, China(2023020201010131)
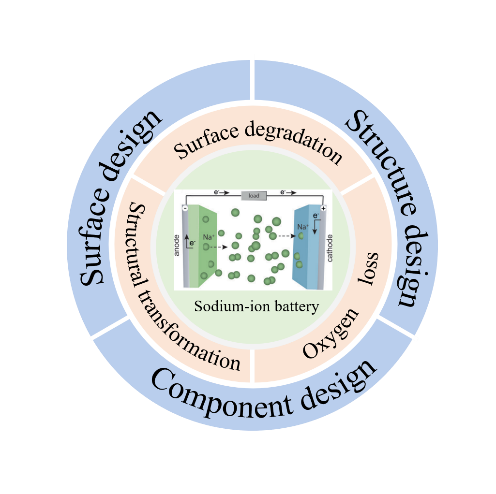
钠离子电池具有资源和成本的优势而在大规模储能和低速电动车领域展现出极大的应用前景。其中,层状氧化物正极材料由于其理论容量高且易于合成等受到了广泛研究。然而,层状氧化物正极材料在循环过程中,尤其是高电压情况下容易出现结构不稳定和表面退化等现象,造成电池性能衰退,阻碍了其商业应用。基于此,本文综述了层状氧化物正极材料在高电压下的结构转变、表面退化以及氧损失等机制,分析和探讨了提高层状氧化物正极材料耐高电压性能的策略,以期为具有耐高电压性能的钠离子电池层状氧化物正极材料的设计开发提供参考;最后总结了钠离子电池层状氧化物正极材料在改性方面存在的不足及未来的研究方向。
丁丽香 , 李旭柯 , 刘雪枫 , 刘镒民 , 雷文 , 张海军 . 钠离子电池层状氧化物正极材料的耐高电压性能[J]. 化学进展, 2024 , 36(7) : 987 -997 . DOI: 10.7536/PC231023
Sodium-ion batteries have shown great application prospects in the field of large-scale energy storage and low-speed electric vehicles due to their resource and cost advantages. Among various cathodes reported, layered oxide cathode materials have been widely investigated owing to their high theoretical capacity and simple synthesis method. However, many adverse reactions and phenomena such as structural instability and surface degeneration are prone to occur during its cycling process, especially at high voltage, which hinders its application in commerce. This article briefly reviews the mechanism of structural transformation, surface degradation, and oxygen loss of layered oxide cathode at high-voltage, focuses on the strategies to improve the high-voltage resistance of layered oxide cathode, and aims to provide reasonable insights for improving the high-voltage stabilization of layered oxide cathode materials and designing sodium-ion layered oxide cathode materials with high performance. Finally, the shortcomings of sodium-ion battery layered oxide cathode materials in modification and future research directions are also summarized.
1 Introduction
2 The degradation mechanism of layered oxide cathode materials at high voltage
3 Component design to improve the high-voltage resistance of layered oxide cathode
3.1 Cationic doping
3.2 Anionic doping
3.3 Cation and anion doping
4 Surface design to improve the high-voltage resistance of layered oxide cathode
5 Structural design to improve the high-voltage resistance of layered oxide cathode
5.1 Composite phase
5.2 Microstructure design
6 Conclusion and outlook

| [1] |
|
| [2] |
|
| [3] |
|
| [4] |
|
| [5] |
|
| [6] |
|
| [7] |
|
| [8] |
|
| [9] |
|
| [10] |
|
| [11] |
|
| [12] |
|
| [13] |
|
| [14] |
|
| [15] |
|
| [16] |
|
| [17] |
|
| [18] |
|
| [19] |
|
| [20] |
|
| [21] |
|
| [22] |
|
| [23] |
|
| [24] |
|
| [25] |
|
| [26] |
|
| [27] |
|
| [28] |
|
| [29] |
|
| [30] |
|
| [31] |
|
| [32] |
|
| [33] |
|
| [34] |
|
| [35] |
|
| [36] |
|
| [37] |
|
| [38] |
|
| [39] |
|
| [40] |
|
| [41] |
|
| [42] |
|
| [43] |
|
| [44] |
|
| [45] |
|
| [46] |
|
| [47] |
|
| [48] |
|
| [49] |
|
| [50] |
|
| [51] |
|
| [52] |
|
| [53] |
|
| [54] |
|
| [55] |
|
| [56] |
|
| [57] |
|
| [58] |
|
| [59] |
|
| [60] |
|
| [61] |
|
| [62] |
|
| [63] |
|
| [64] |
|
| [65] |
|
| [66] |
|
| [67] |
|
| [68] |
|
| [69] |
|
| [70] |
|
| [71] |
|
| [72] |
|
| [73] |
|
| [74] |
|
| [75] |
|
| [76] |
|
| [77] |
|
| [78] |
|
| [79] |
|
| [80] |
|
| [81] |
|
| [82] |
|
/
| 〈 |
|
〉 |