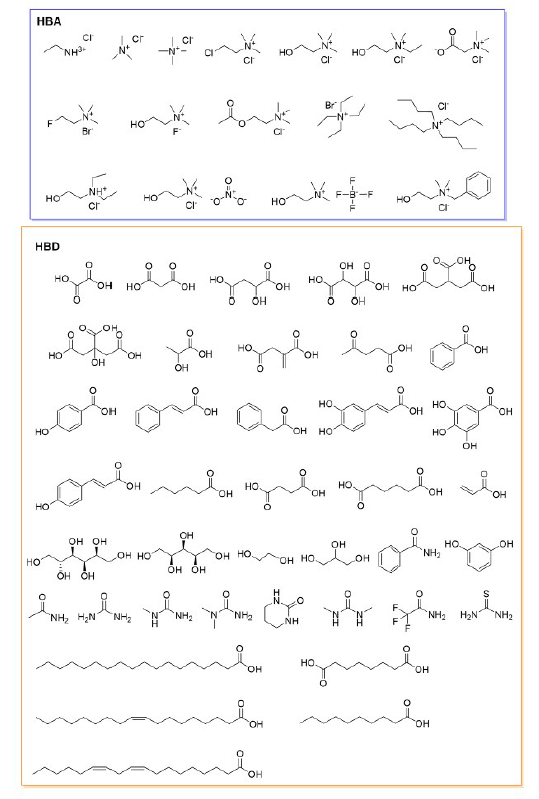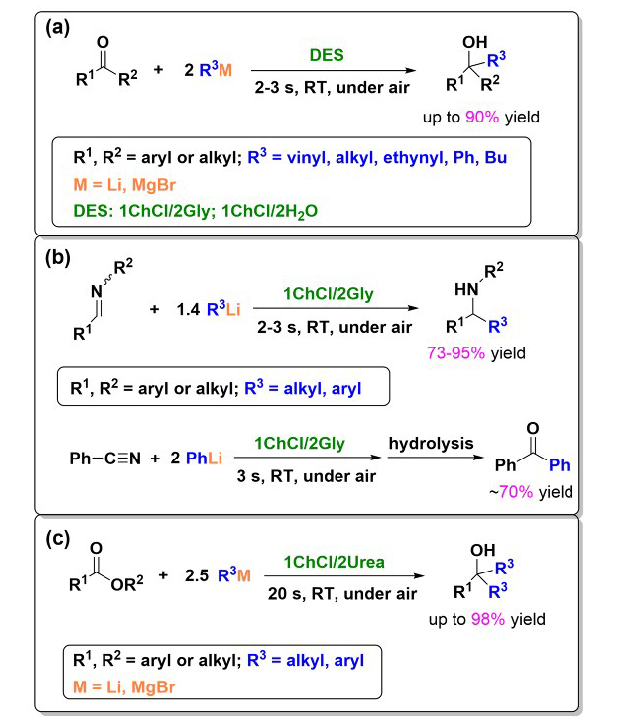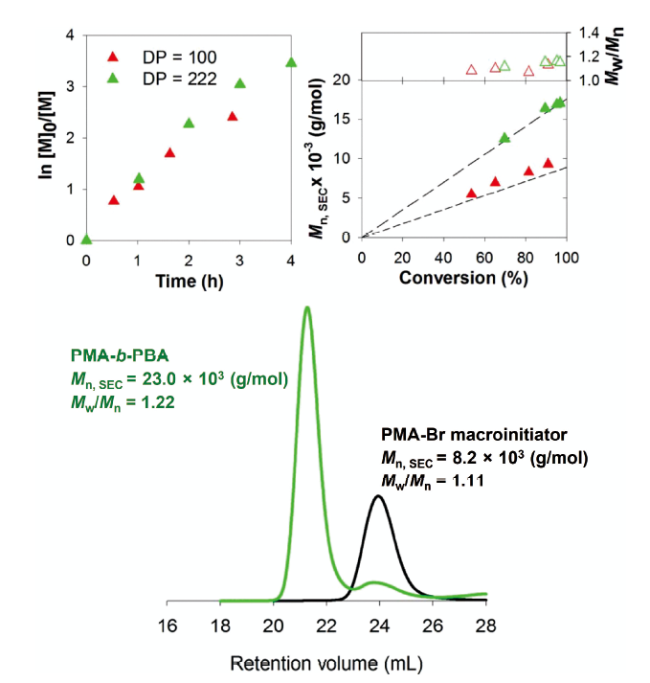
Contents
1 引言
2 低共熔溶剂简介
表1 DES的分类及其通式Table 1 General formula for the classification of DES |
| Type | General Formula | Terms |
|---|---|---|
| Ⅰ | Cat+X-zMClx | M=Zn, Sn, Fe, Al, Ga, In |
| Ⅱ | Cat+X-zMClx yH2O | M=Cr, Co, Cu, Ni, Fe |
| Ⅲ | Cat+X-zRZ | Z=CONH2, COOH, OH |
| Ⅳ | MClx+RZ=MC · RZ+MC | M=Al, Zn and Z=CONH2, OH |
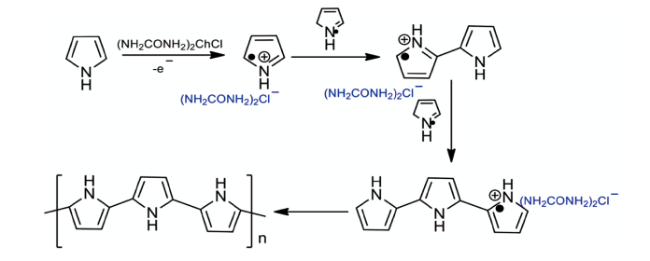
3 DES在有机合成中的应用简介
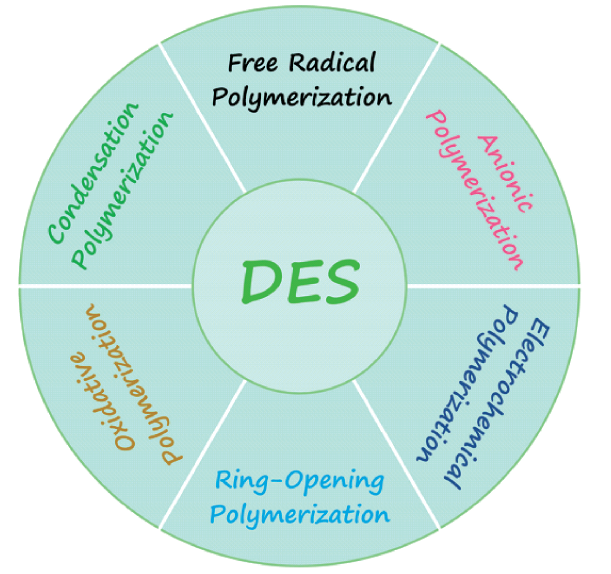
4 DES在高分子合成中的应用
4.1 缩合聚合
图3 DES辅助合成生物可降解型抗菌性聚(辛二醇-co-柠檬酸酯)[57]: (a) 四种DES的制备路线; (b) 抗菌性聚酯弹性体的合成示意图; (c) POC的合成示意图Fig. 3 DES-assisted synthesis of biodegradable antibacterial poly(octanediol-co-citrate)[57]. (a) Preparation of the different DES; (b) DES-assisted synthesis of POC elastomers containing antibacterial compounds; (c) diagram of the synthesis of POC. Copyright 2013, American Chemical Society |
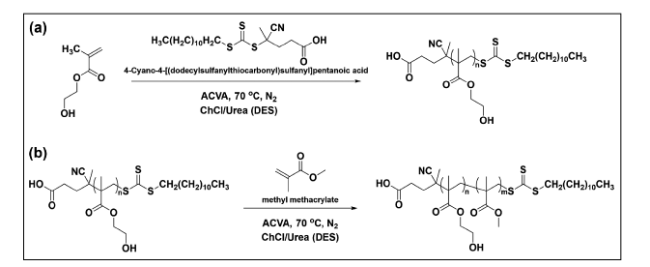
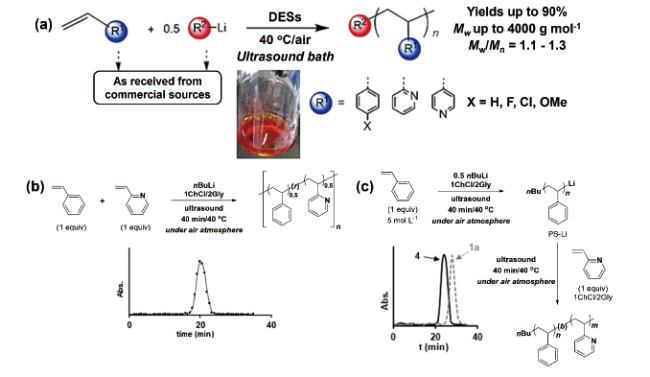
4.2 自由基聚合
4.2.1 热引发
4.2.2 光引发
图4 光聚合ChCl/AA型PDES的合成及用于构建导电高分子材料: (a) PDES的紫外光聚合示意图及用于制备导电弹性体[70]; (b) 海星状触觉感应材料[70]; (c) 导电纸[71]; (d) 图案化光电器件[72]; (e) 导电纤维[73]Fig. 4 Synthesis and application of photopolymerizable ChCl/AA-type DES. (a) One-step synthesis and its rapid, in-situ polymerization as a transparent, stretchable and conductive elastomer and (b) starfish-shaped tactile sensor[70]. Copyright 2017, The Royal Society of Chemistry. (c) Conductive paper[71]. Copyright 2018, The Royal Society of Chemistry. (d) Patterned optoelectronic devices using transparent piezoresistive balls[72]. Copyright 2020, The Royal Society of Chemistry. (e) Conductive fibers[73]. Copyright 2021, American Chemical Society |
图5 利用光聚合PDES体系构筑高透明度、可拉伸的自修复导电弹性体[74]: (a) 弹性体的化学结构、实物照片及动态键示意图; (b) 弹性体具有良好低温自修复性能示意图Fig. 5 All-in-one molecular networks design concept for autonomously self-healable transparent, stretchable, and conducive elastomers[74]. (a) Chemical structure and optical image of the poly(AAm/ChCl-co-MA/ChCl) elastomers; (b) demonstration of the healing process below zero temperature. Copyright 2020, American Chemical Society |
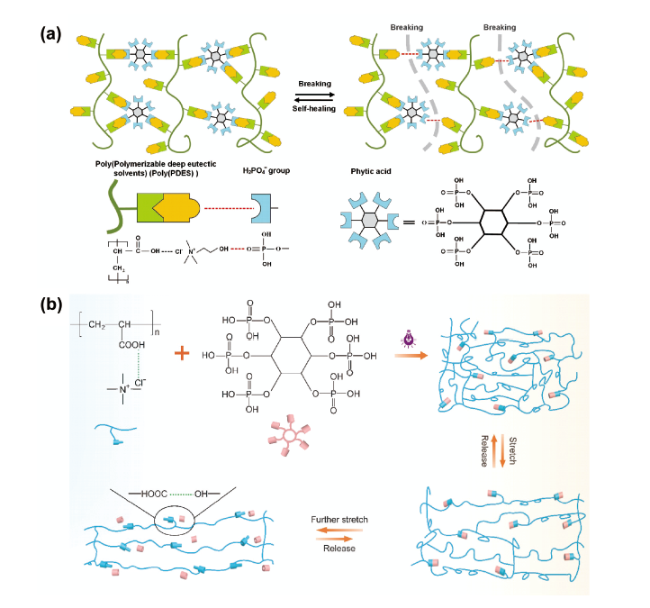
图6 将高氢键密度的植酸引入光聚合PDES体系用于构筑具有高透明度、优异拉伸性能的自修复导电弹性体: (a) ChCl/AA/PA型PDES基弹性体的设计理念[75]; (b) TMAC/AA/PA型PDES基弹性体的设计理念[76]Fig. 6 Fabrication of highly transparent, stretchable, self-healable, and conducive elastomers by the introduction of phytic acid as the hydrogen bonding crosslinker into PDES systems. (a) Design concept for ChCl/AA/PA-type PDES[75]. Copyright 2020, Elsevier. (b) Design concept for TMAC/AA/PA-type PDES[76]. Copyright 2021, The Royal Society of Chemistry |