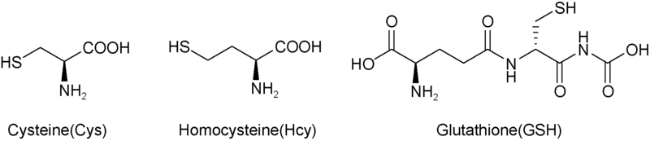
1 引言
2 检测Cys的有机小分子荧光探针
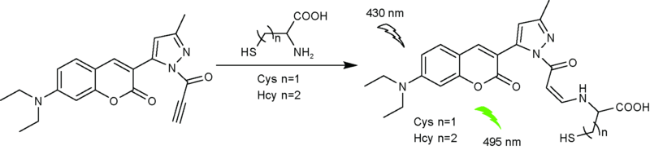
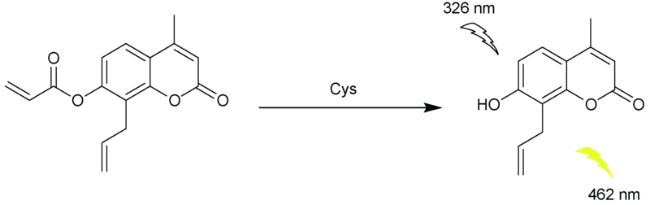
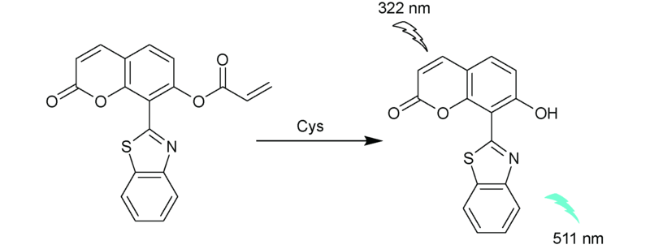
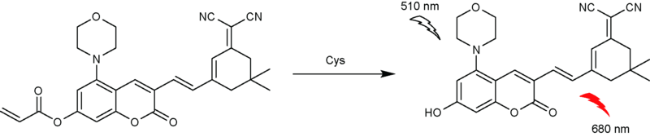
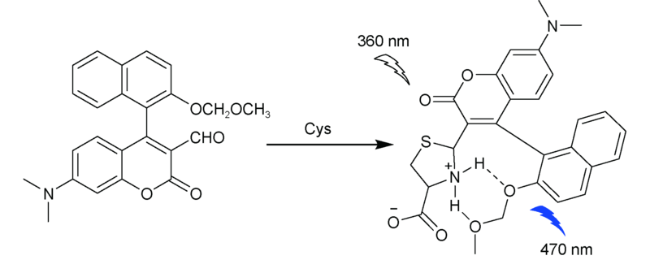
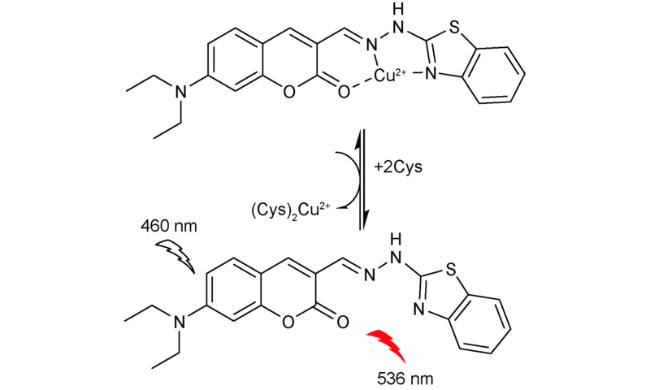
2.1 基于香豆素的Cys荧光探针
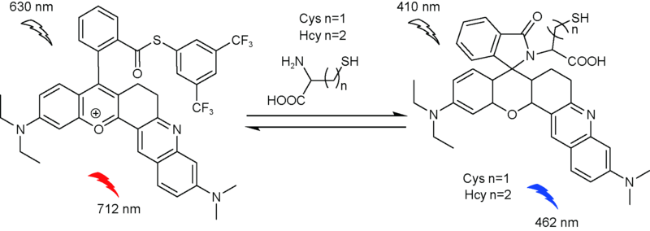
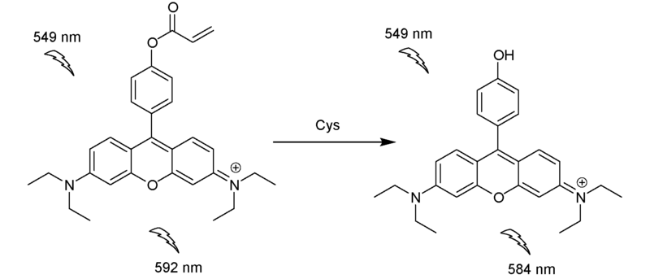
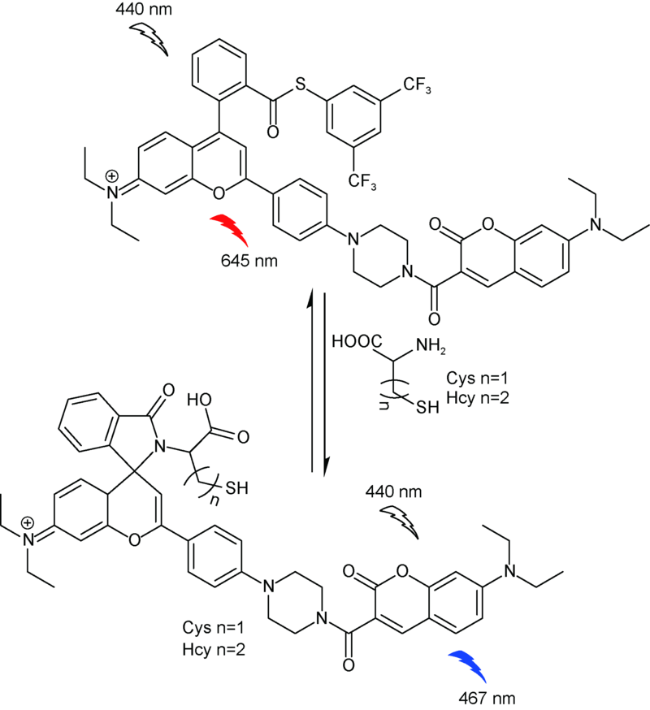
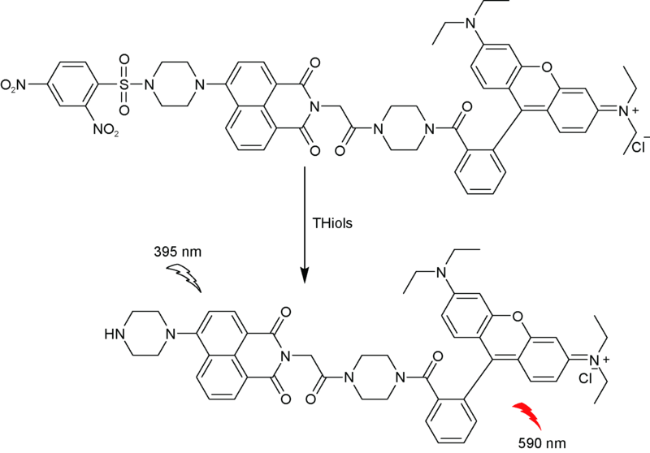
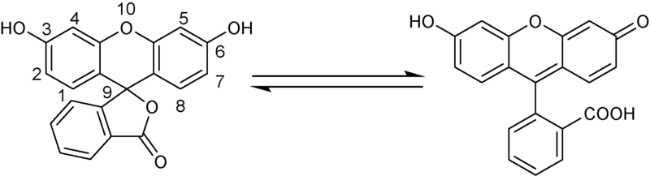
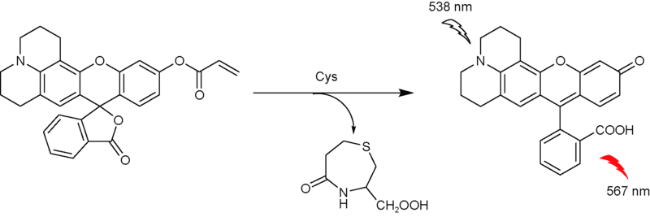
2.2 基于罗丹明的Cys荧光探针
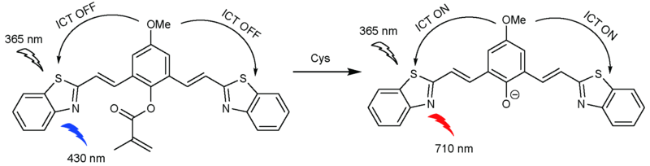
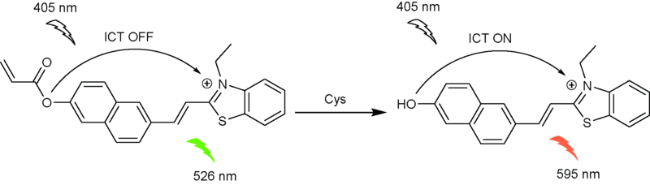
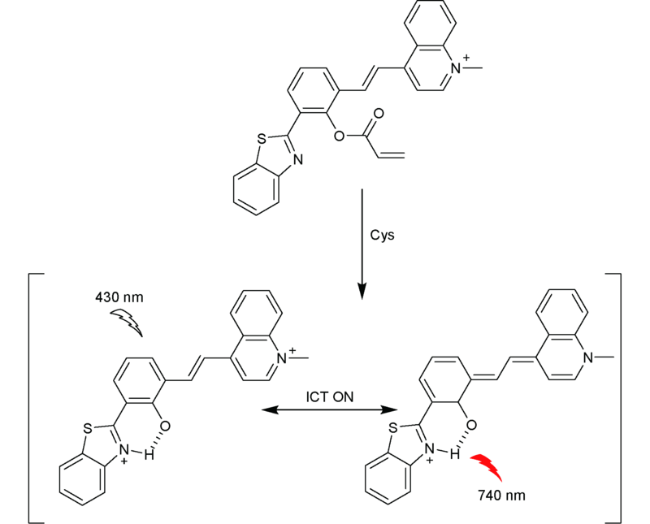
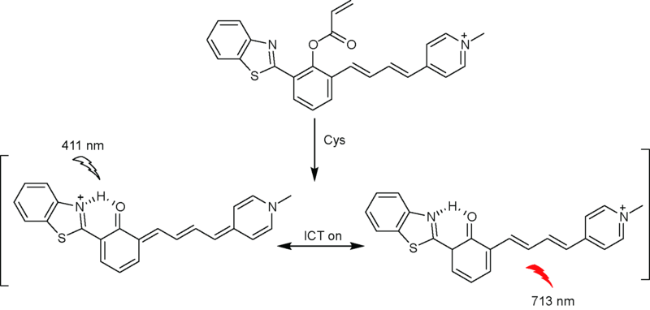
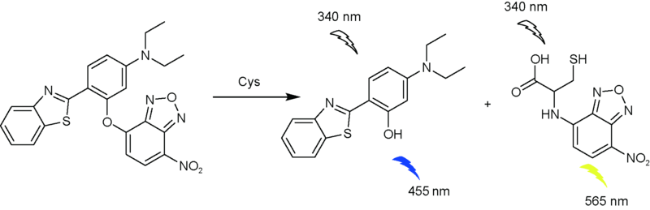
2.3 基于苯并噻唑的Cys荧光探针
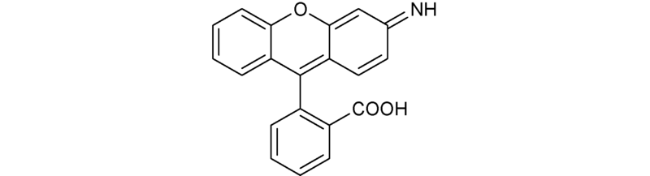
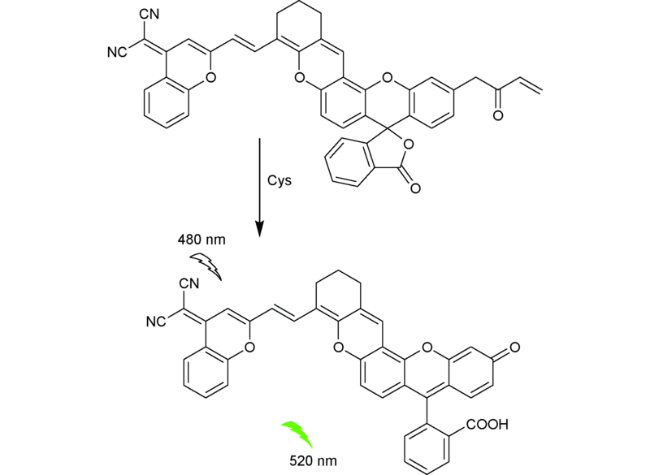
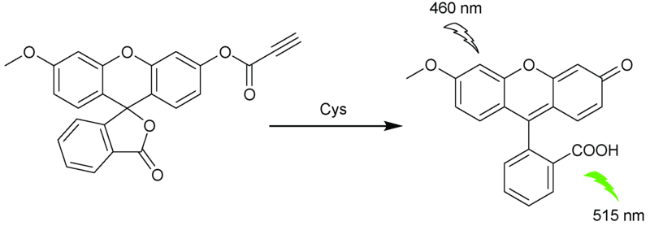
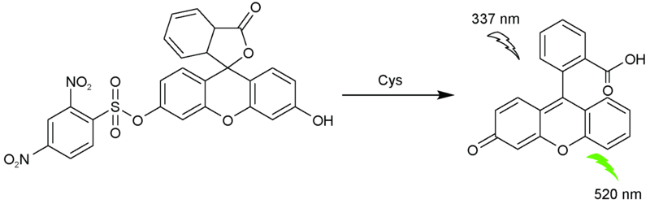
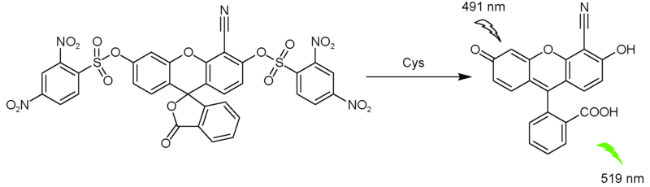
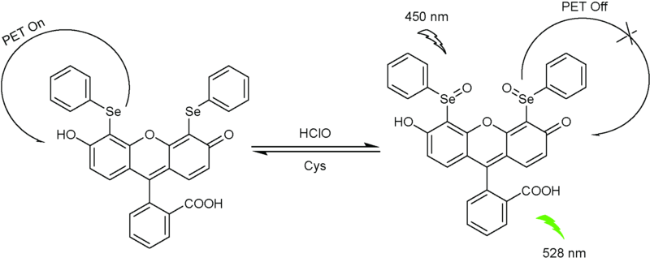
2.4 基于荧光素的Cys荧光探针
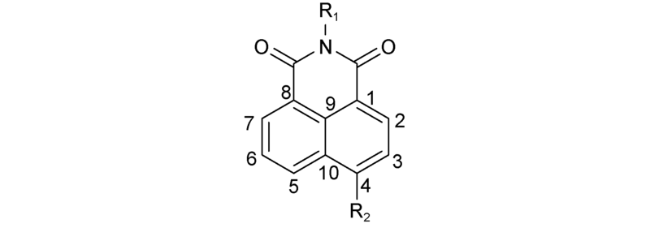
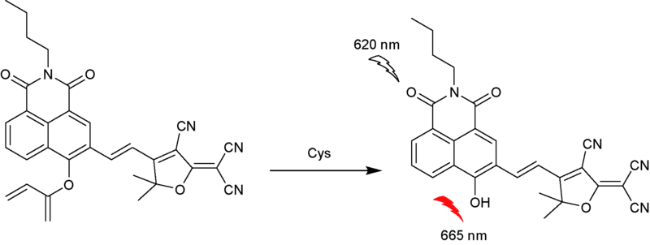
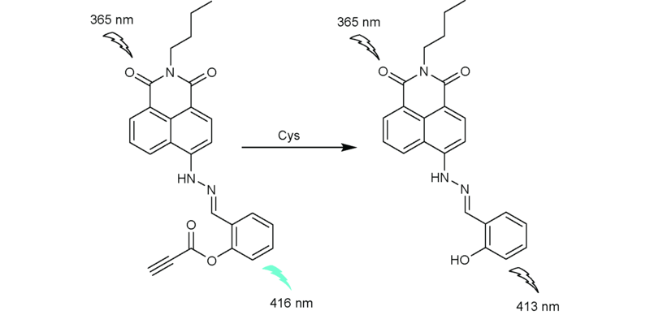
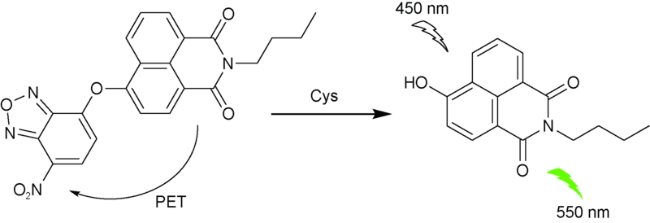
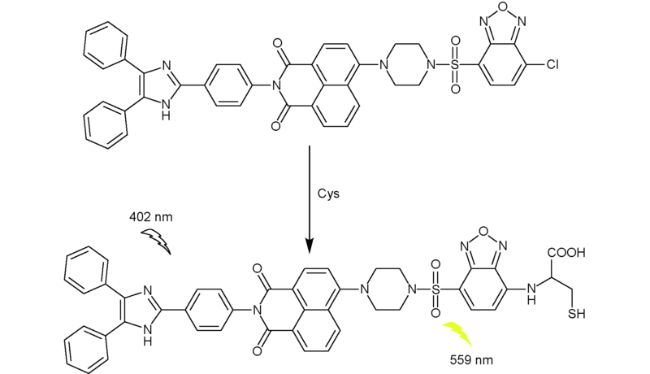
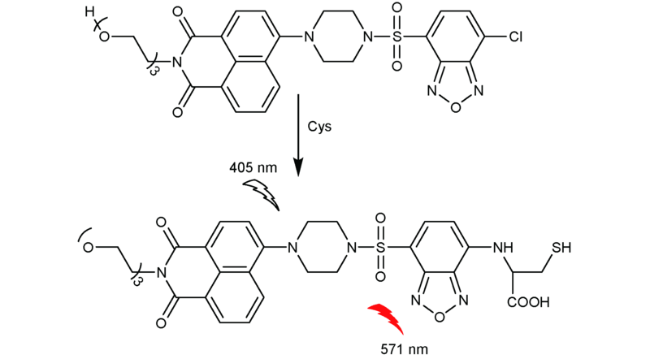
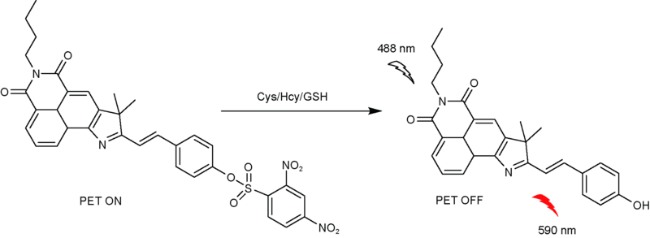
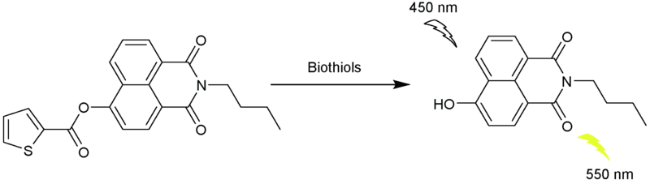
2.5 基于萘酰亚胺Cys荧光探针
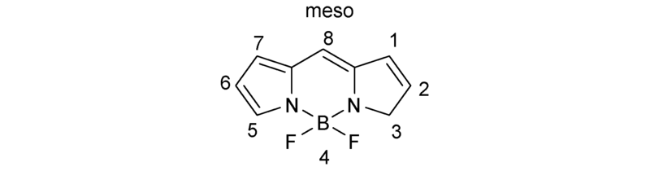
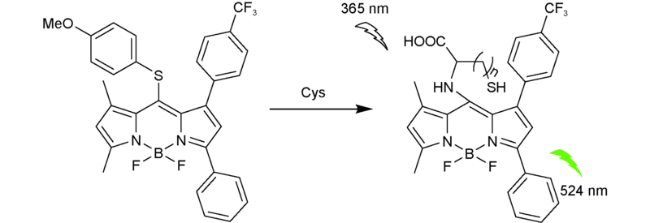
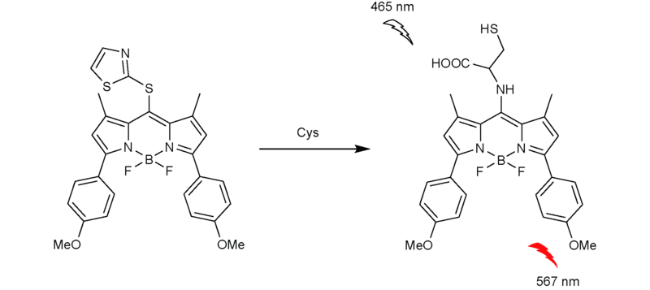
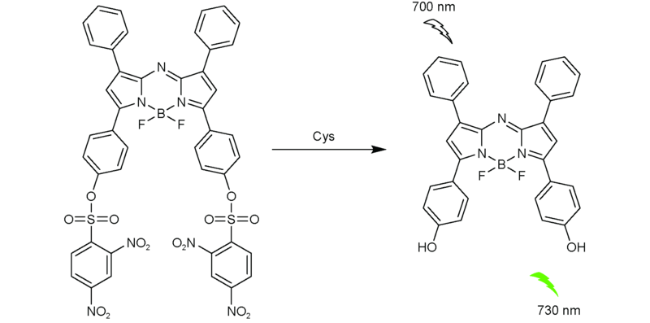
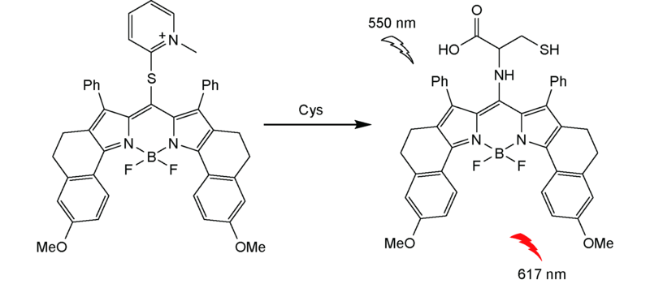
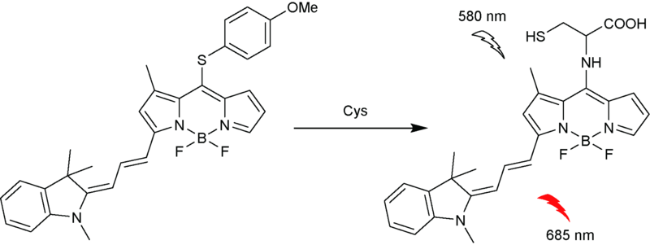
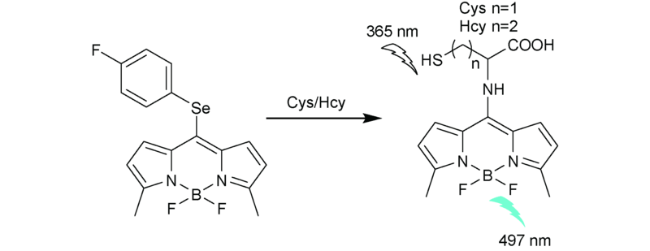
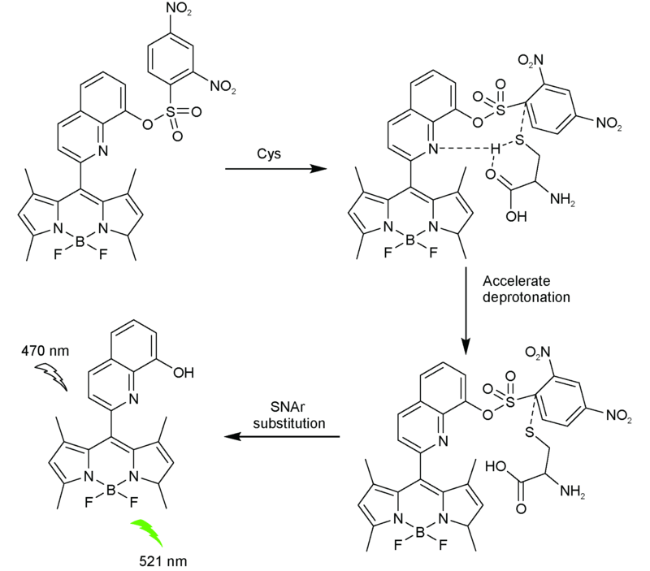
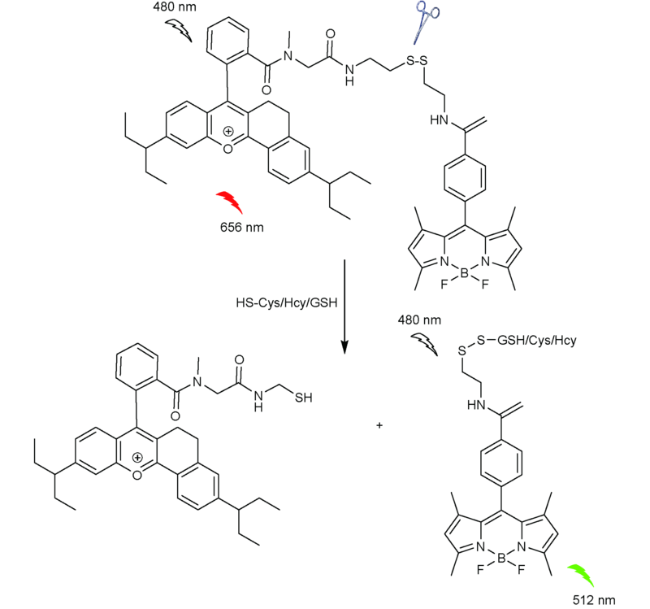
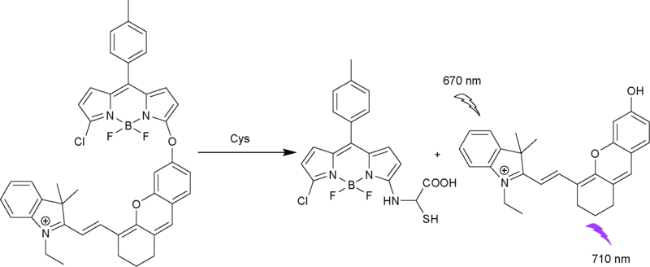
2.6 基于氟硼吡咯的Cys荧光探针
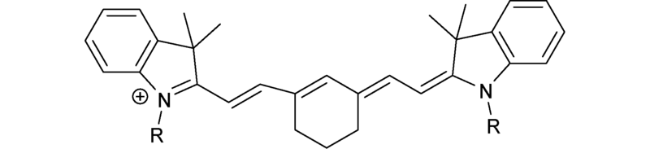
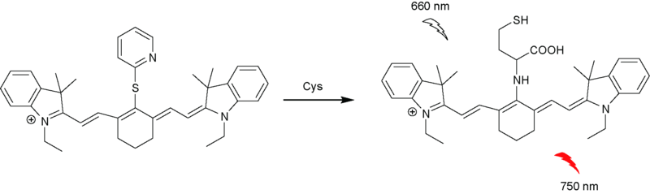
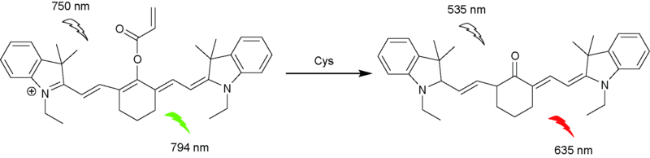
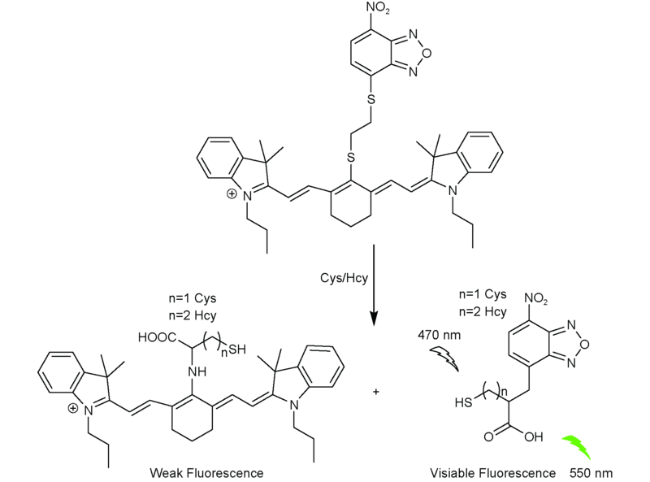
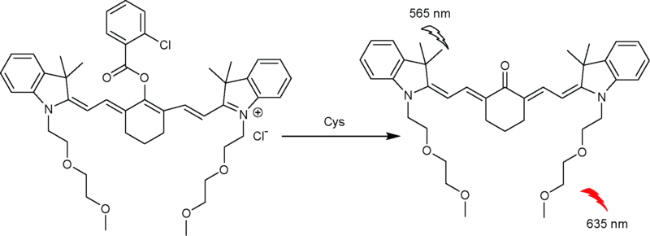
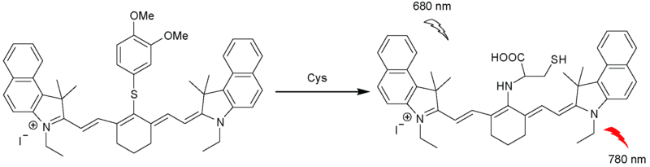
2.7 基于花菁的Cys荧光探针
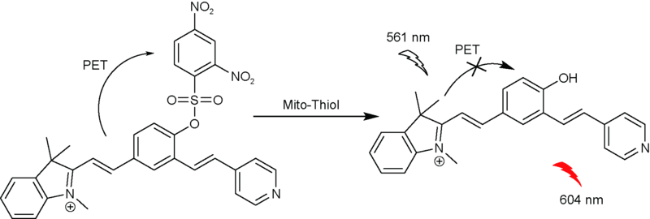
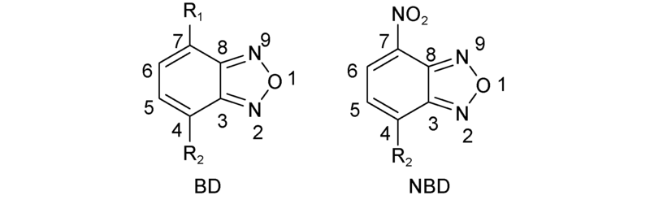
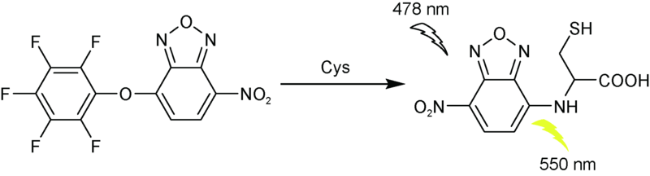
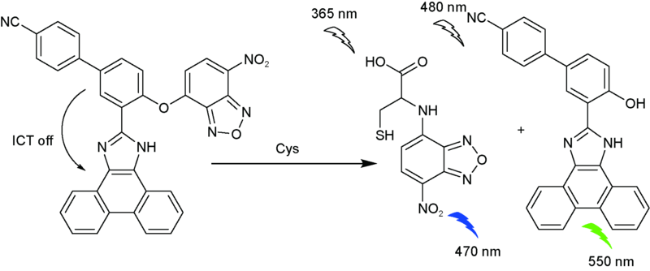
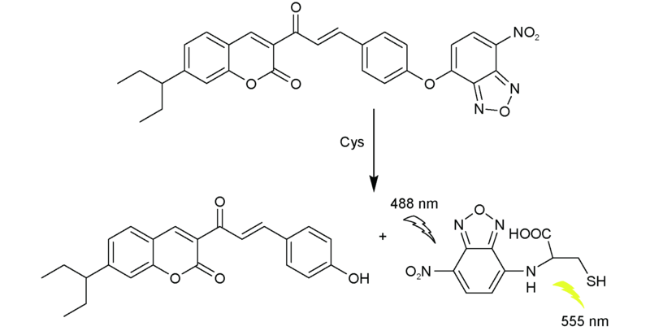
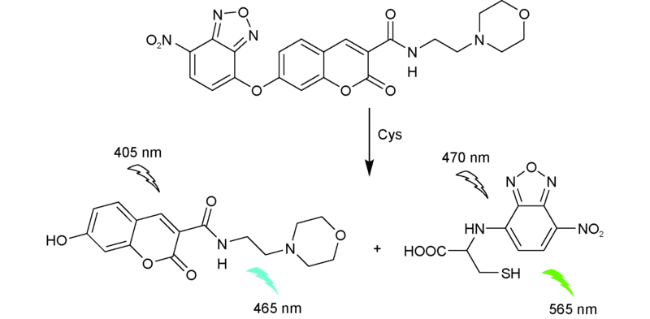
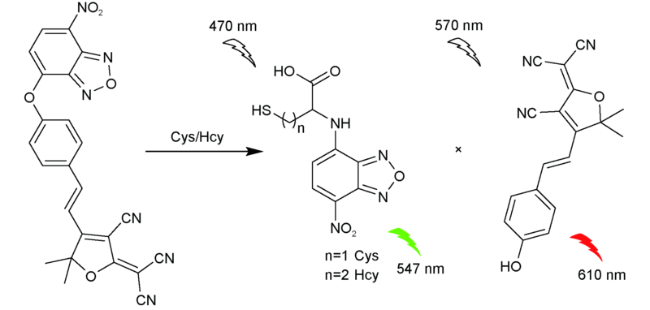
2.8 基于硝基苯并呋咱的Cys荧光探针
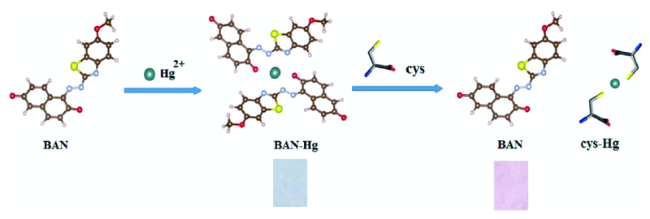
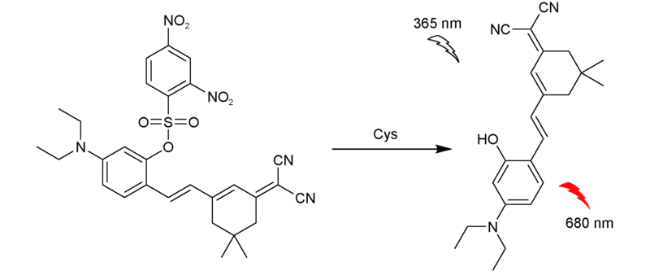
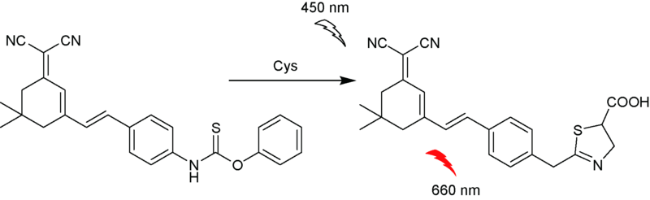
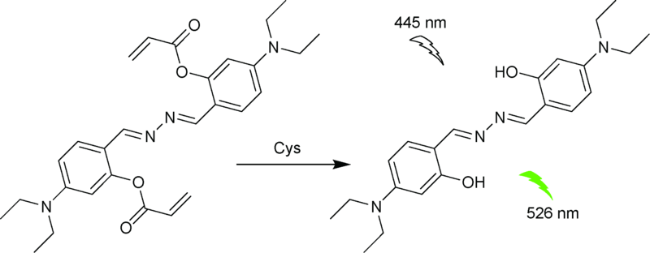
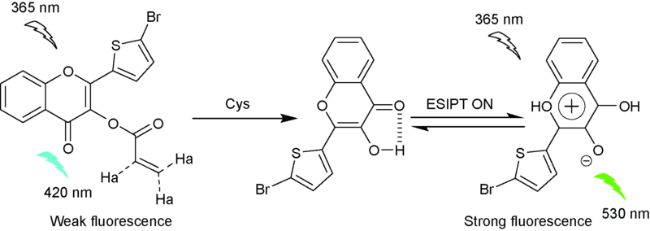
2.9 基于其他结构的Cys荧光探针
3 检测Cys的纳米荧光探针
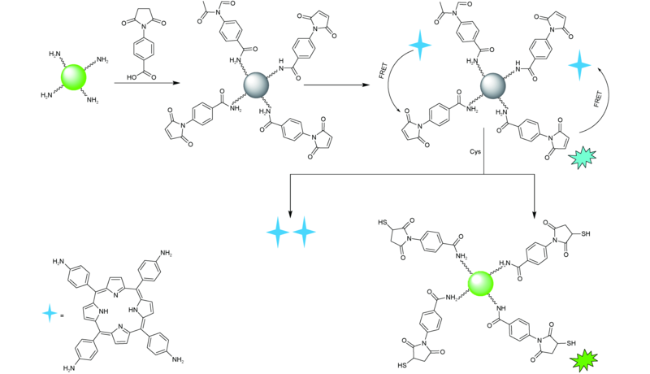
3.1 基于量子点的Cys荧光探针
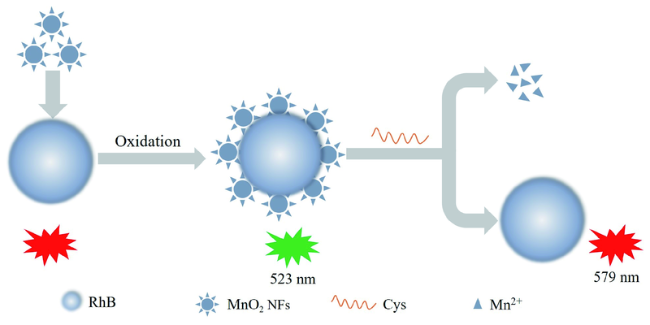
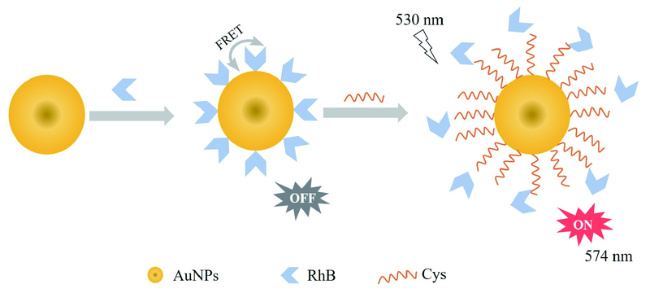
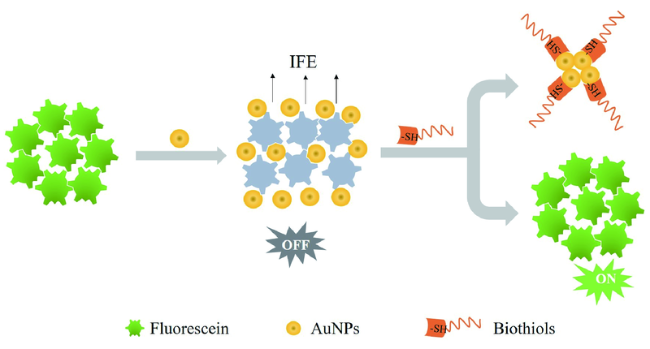
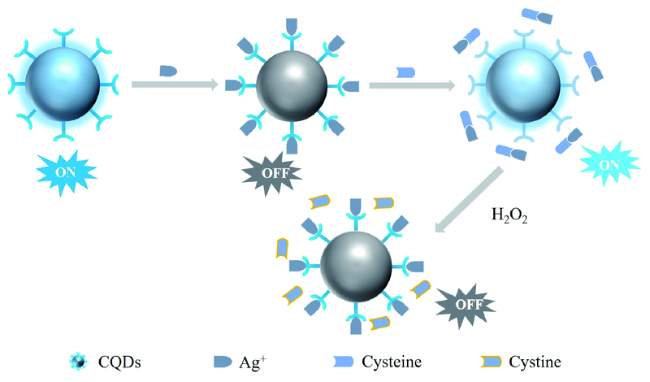
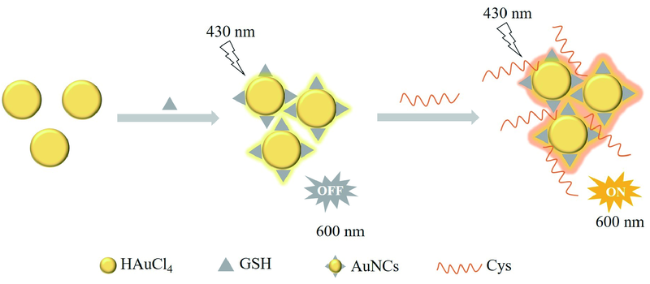
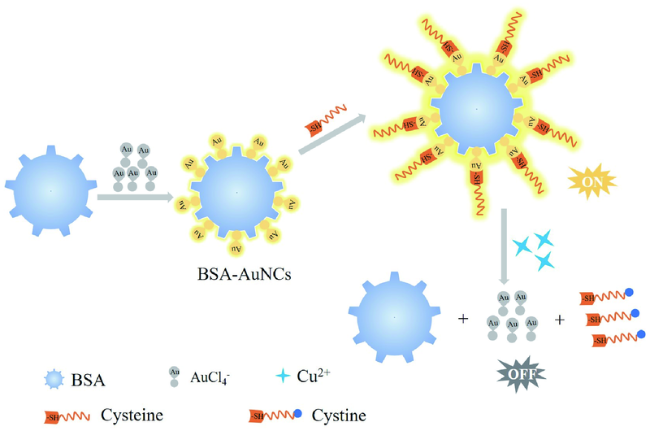
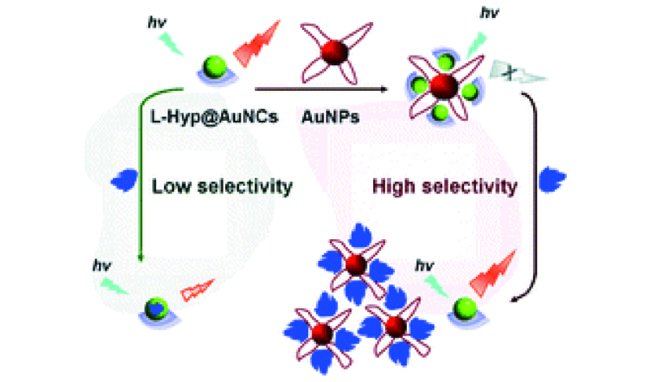
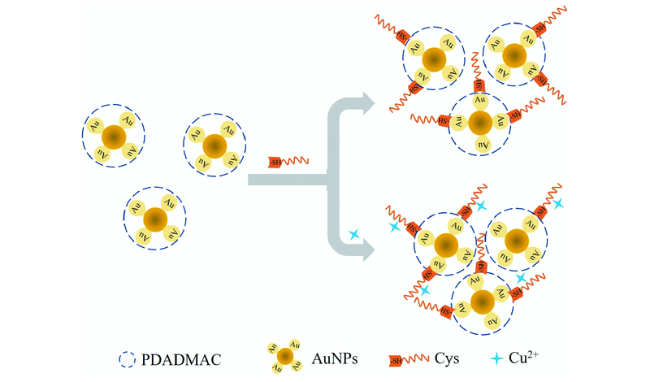
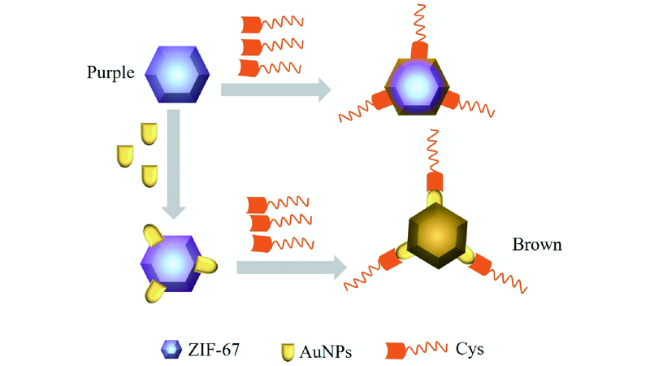
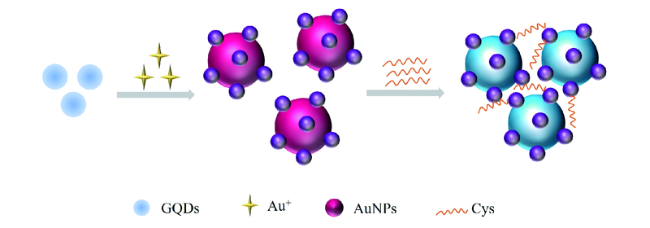
3.2 基于金纳米材料的Cys荧光探针
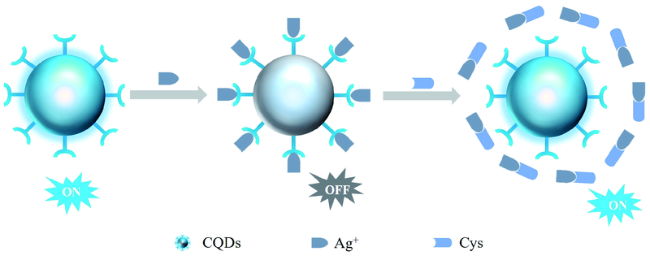
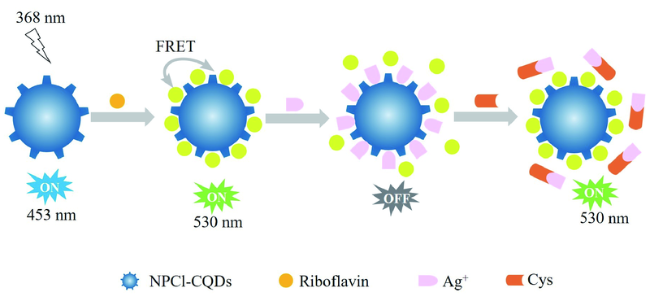
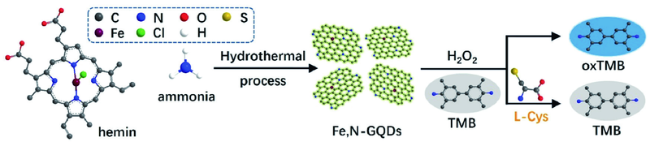
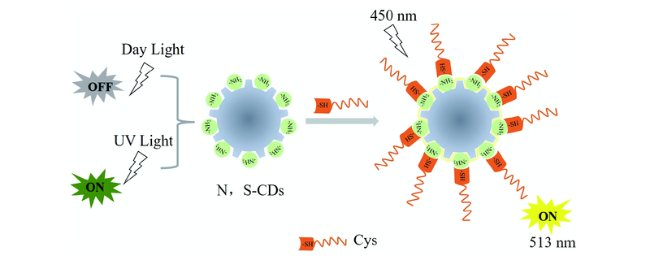
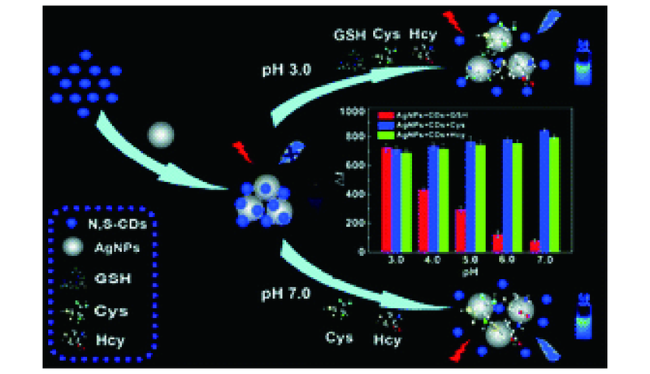
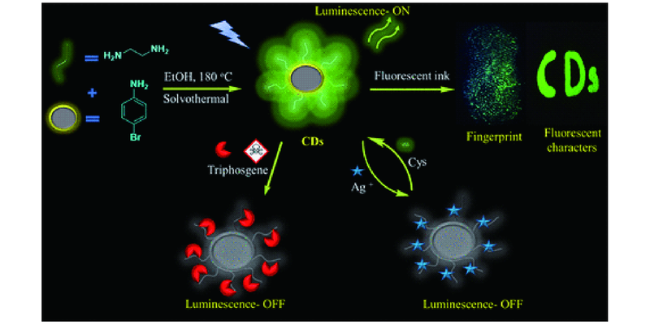
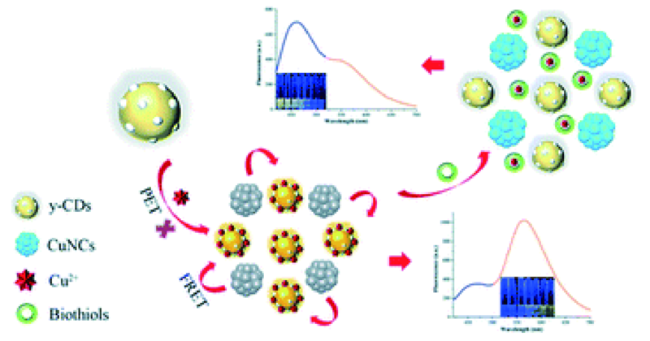
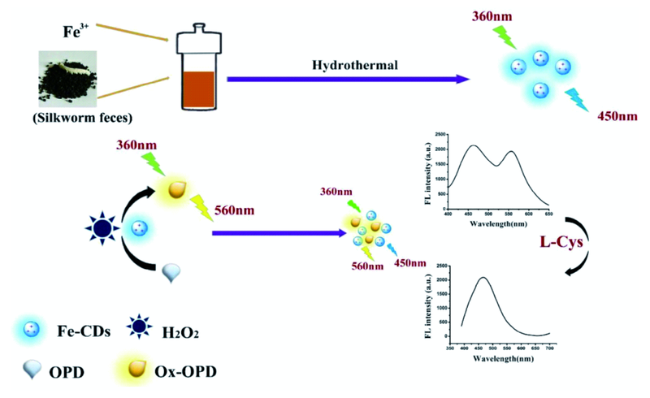
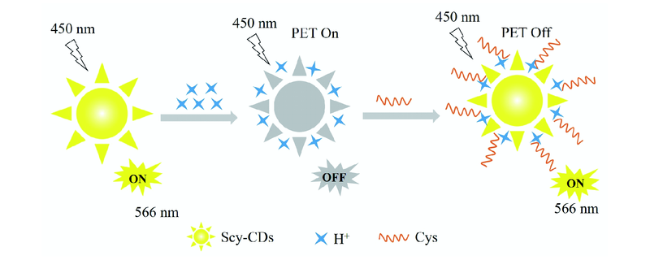
3.3 基于碳点的Cys荧光探针
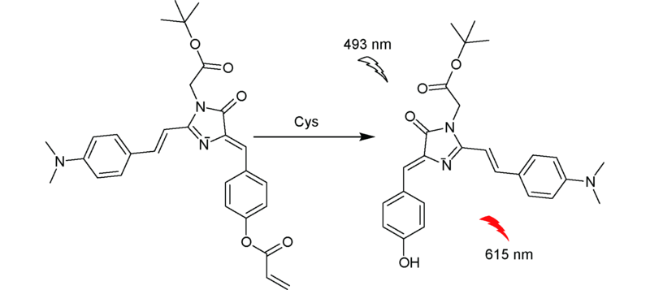
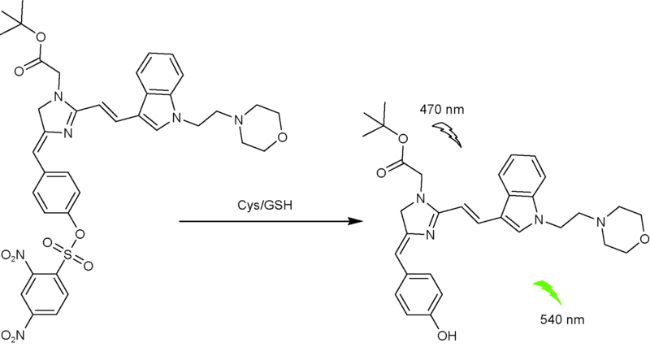
4 荧光蛋白类
5 结论和展望
表1 Cys荧光探针的总结Table 1 Summary of Cys fluorescent probe |
| Probe | Fluorophore | λex/λex | LOD | Time | Solvent | Application | ref |
|---|---|---|---|---|---|---|---|
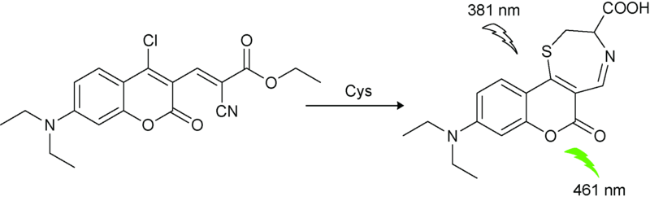
| 1 | Coumarin | 381/461 nm | 6 nM | 15 min | DMSO/PBS(V∶V=1∶9) | A357 cells | 30 |
| 2 | Coumarin | 454/505 nm | 0.24 μM | 10 min | HEPES/DMSO(V∶V=6∶4) | BHK-21 cells | 31 |
| 3 | Coumarin | 430/495 nm | 49 nM | 3 min | PBS | Liver tissues | 32 |
| 4 | Coumarin | 326/466 nm | 2 μM | - | EtOH/H2O (V∶V=9∶1) | Living cells | 33 |
| 5 | Coumarin | 322/511 nm | 88.2 nM | 18 min | PBS | Living cells | 34 |
| 6 | Coumarin | 510/560 nm | 0.28 μM | 30 min | EtOH/PBS (V∶V=1∶1) | HeLa cells | 35 |
| 7 | Coumarin | 360/470 nm | - | 60 min | DMSO/PBS (V∶V=1∶199) | HeLa cells | 36 |
| 8 | Coumarin | 460/536 nm | 0.3 μM | - | EtOH/PBS(V∶V=1∶1) | - | 37 |
| 9 | Rhodamine | 410/462 nm | 0.12 μM | 10 min | EtOH/PBS (V∶V=1∶2) | Caov 3 cells | 52 |
| 10 | Rhodamine | 549/584 nm | 20 μM | 1.5 min | DMSO/PBS(V∶V=1∶1) | BSA/water | 53 |
| 11 | Rhodamine | 440/467 nm | 1.5 μM | 20 min | EtOH/PBS (V∶V=3∶7) | HeLa cells | 54 |
| 12 | Rhodamine | 395/590 nm | 0.47 μM | 30 min | DMSO/PBS (V∶V=1∶9) | Liver tissues | 55 |
| 13 | Rhodamine | 365/579 nm | 0.282 μM | - | - | Human serum | 54 |
| 14 | Rhodamine | 530/574 nm | 0.01 μM | - | aqueous | - | 55 |
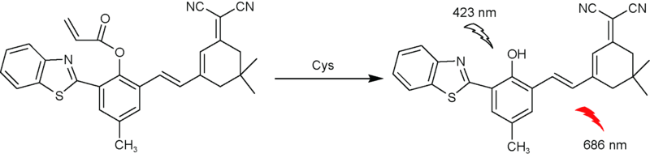
| 15 | Benzothiazole | 423/686 nm | 0.20 μM | 14 min | HEPES/ methanol / acetonitrile (V∶V∶V=1∶1∶1∶1) | HeLa cells | 62 |
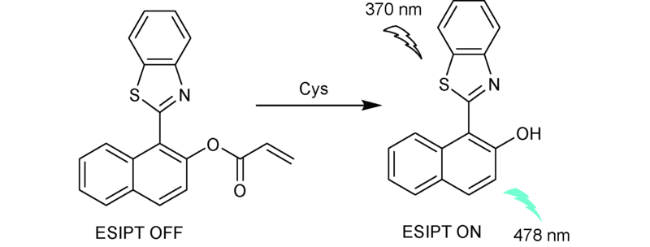
| 16 | Benzothiazole | 370/478 nm | 0.478 μM | 2 min | DMSO/PBS (V∶V=1∶1) | HeLa cells | 63 |
| 17 | Benzothiazole | 365/710 nm | 0.40 μM | 120 min | DMSO/PBS (V∶V=1∶1) | HeLa cells | 64 |
| 18 | Benzothiazole | 405/595 nm | 74 nM | 3 min | DMSO/PBS (V∶V=1∶1) | Mitochondria | 65 |
| 19 | Benzothiazole | 430/740 nm | 0.062 μM | 15 min | ACN/ H2O (V∶V=99∶1) | A549 cells | 66 |
| 20 | Benzothiazole | 411/713 nm | 116 nM | 15 min | CH3CN/PBS (V∶V=1∶1) | HeLa cells | 67 |
| 21 | Benzothiazole | 365/607 nm | 0.12 μM | 80 min | DMSO/Tris-HCl(V∶V=99∶1)(V∶V=1∶99) | MCF-7 cells | 68 |
| 22 | Benzothiazole | 340/455 nm | 37 nM | 30 min | DMSO/PBS (V∶V=1∶9) | HeLa cells | 69 |
| 23 | benzothiazole | - | 20 s | ACN/ H2O (V∶V=1∶1) | - | 70 | |
| 24 | Fluorescein | 538/567 nm | 39.2 nM | 14 min | PBS | HepG2 cells | 76 |
| 25 | Fluorescein | 480/520 nm | - | - | MeCN/PBS | A549 cells | 77 |
| 26 | Fluorescein | 460/515 nm | 182 nM | 30 min | CH3CN/PBS (V∶V=6∶4) | A549 cells | 78 |
| 27 | Fluorescein | 337/520 nm | 6.5 μM | 27 min | DMSO/PBS (V∶V=1∶3) | - | 79 |
| 28 | Fluorescein | 491/519 nm | 0.021 μM | - | DMSO/PBS (V∶V=5∶95) | HeLa cells | 80 |
| 29 | Fluorescein | 450/532 nm | 3.0 nM | 5 min | EtOH/PBS(V∶V=9∶1) | L929 cells | 81 |
| 30 | Fluorescein | - | 0.6 μM | - | PBS | Human Serum | 82 |
| 31 | Naphthalimide | 620/665 nm | 0.093 μM | 20 min | PBS | HeLa cells | 90 |
| 32 | Naphthalimide | 365/413 nm | 0.31 nM | 80 min | EtOH/PBS(V∶V=9∶1) | THLE2 cells | 91 |
| 33 | Naphthalimide | 450/550 nm | 0.31 nM | 5 min | PBS | Zebrafish | 92 |
| 34 | Naphthalimide | 402/559 nm | 0.87 μM | 55 min | DMF/ H2O (V∶V=7∶3) | Livig cells | 93 |
| 35 | Naphthalimide | 405/571nm | 16.7 nM | 40 min | PBS | MCF-7 cells | 94 |
| 36 | Naphthalimide | 488/590 nm | 9.87 nM | 4 min | CTAB/PBS (V∶V=1∶9) | MCF-7 cells | 95 |
| 37 | Naphthalimide | 450/550 nm | 0.065 μM | 2 h | CTAB/PBS (V∶V=1∶9) | MCF-7 cells | 96 |
| 38 | BODIPY | 365/524 nm | 52 nM | 10 min | ACN/PBS (V∶V=2∶3) | HeLa cells | 107 |
| 39 | BODIPY | 465/567 nm | 51 nM | - | CH3CN/PBS (V∶V=1∶1) | HeLa cells | 108 |
| 40 | BODIPY | 700/730 nm | 5.23 μM | 3 min | THF/PBS (V∶V=1∶1) | - | 109 |
| 41 | BODIPY | 550/617 nm | 72 nM | 2 min | ACN/PBS V∶V=2∶3) | HeLa cells | 110 |
| 42 | BODIPY | 580/685nm | 118 nM | 90 min | CH3CN/PBS (V∶V=1∶1) | HeLa cells | 111 |
| 43 | BODIPY | 365/407 nm | 4.1 nM | 2 min | DMSO/PBS (V∶V=1∶9) | HepG2 cells | 112 |
| 44 | BODIPY | 370/521 nm | 33 nM | - | DMSO/PBS (V∶V=1∶1) | HepG2 cells | 113 |
| 45 | BODIPY | 480/512 nm | - | 60 min | EtOH/PBS (V∶V=1∶2) | HeLa cells | 114 |
| 46 | BODIPY | 670/710 nm | 2.29 μM | - | ACN/PBS (V∶V=1∶4) | HepG2 cells | 115 |
| 47 | Cyanine | 660/750 nm | 0.39 μM | 90 min | DMSO/PBS (V∶V=1∶1) | HeLa cells | 119 |
| 48 | Cyanine | 561/604 nm | 13.4 μM | 30 min | DMSO/PBS (V∶V=1∶9) | Mitochondria | 120 |
| 49 | Cyanine | 535/635 nm | 0.09 μM | 30 min | HEPES | Lung cancer | 121 |
| 50 | Cyanine | 650/743 nm | 0.17 μM | 60 min | HEPES | HeLa cells | 122 |
| 51 | Cyanine | 650/776 nm | 0.47 μM | 25 min | DMSO/PBS (V∶V=1∶4) | MCF-7 cells | 123 |
| 52 | Cyanine | 470/550 nm | 94 nM | 60 min | MeCN/PBS (V∶V=1∶9) | MCF-7 cells U87 cells | 124 |
| 53 | Cyanine | 565/635 nm | 228 nM | - | DMSO/PBS (V∶V=3∶7) | HeLa cells | 125 |
| 54 | Cyanine | 680/780 nm | 7.7 μM | 15 min | DMSO/PBS (V∶V=1∶1) | HeLa cells | 126 |
| 55 | NBD | 478/550 nm | 0.12 μM | - | DMSO/H2O (V∶V=1∶9) | GBM cells | 133 |
| 56 | NBD | 365/470 nm | 22.6 nM | 30 min | DMF/PBS (V∶V=2∶3) | HeLa cells | 134 |
| 57 | NBD | 488/555 nm | 0.44 μM | 210 s | DMSO/PBS (V∶V=1∶9) | HeLa cells | 135 |
| 58 | NBD | 470/565 nm | 0.008 μM | 25 min | DMSO/PBS (V∶V=1∶4) | HeLa cells | 136 |
| 59 | NBD | 470/547 nm | 0.015 μM | 10 min | DMF/PBS (V∶V=1∶9) | HeLa cells | 137 |
| 60 | Isophorone | 365/680 nm | 36.93 nM | 6 min | EtOH/PBS (V∶V=1∶1) | HeLa cells | 138 |
| 61 | Isoflurone | 450/660 nm | 79 nM | - | DMSO/PBS (V∶V=3∶7) | HepG2 cells | 139 |
| 62 | Isophorone | 505/666 nm | 86.9 nM | - | DMSO/PBS (V∶V=1∶4) | HeLa cells | 140 |
| 63 | Chalcone | 400/504 nm | 80 nM | - | DMSO/PBS (V∶V=1∶1) | HeLa cells | 141 |
| 64 | Schiff base | 445/526 nm | 36.4 nM | - | EtOH/PBS (V∶V=3∶7) | Zebrafish | 142 |
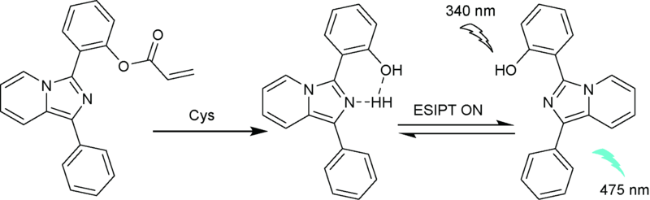
| 65 | Imidazo [1,5-a]pyridine | 340/475 nm | 0.07 μM | 10 min | DMSO/PBS (V∶V=1∶9) | HeLa cells | 143 |
| 66 | Flavonoid | 365/530 nm | 42.3 nM | 15 min | DMSO/H2O (V∶V=1∶4) | HeLa cells | 144 |
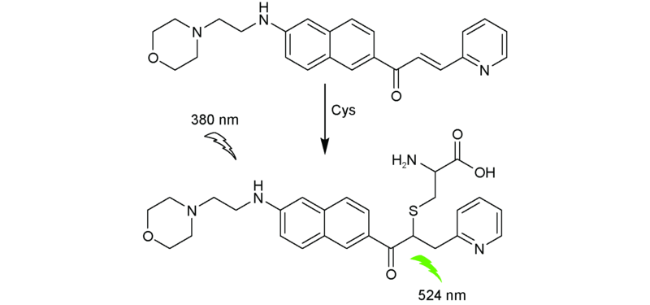
| 67 | Naphthalene | 380/524 nm | 11 nM | 10 min | DMSO/PBS (V∶V=1∶99) | HeLa cells | 145 |
| 68 | CQDs | - | 242 nM | - | Aqueous | River water | 150 |
| 69 | CQDs | 368/530 nm | 0.96 nM | 2.5 min | Aqueous | Drug/Water | 151 |
| 70 | GQDs | 420/480 nm | 140 nM | - | Aqueous | - | 158 |
| 71 | GQDs | - | - | - | Aqueous | Blood | 159 |
| 72 | GQDs | - | 1.69 nM | - | PBS | Blood | 160 |
| 73 | GQDs | - | 0.234 nM | - | PBS | Blood | 160 |
| 74 | AuNCs | 430/600 nm | 0.42 μM | 10 min | Aqueous | Serum | 161 |
| 75 | AuNCs | 495/660 nm | 30.4 nM | - | PBS | Liver | 162 |
| 76 | AuNCs/AuNPs | - | 1.4 μM | 6 min | Tris-HCl buffer solution | Serum | 163 |
| 77 | AuNPs | 88 nM | 13 min | Aqueous | Drug | 164 | |
| 78 | AuNPs | - | 1 μM | - | Aqueous | - | 166 |
| 79 | AuNPs | - | 5.88 μM | 2 min | PBS | - | 167 |
| 80 | N,S-CDs | 450/513 nm | 23 nM | - | Aqueous | HCT 116 cells | 168 |
| 81 | AgNPs/CDs | 365/425 nm | 68.5 nM | - | BR buffer | - | 169 |
| 82 | CDs | 410/530 nm | 0.34 μM | - | Aqueous | HCT 116 cells | 170 |
| 83 | N-CDs | 365/450 nm | 0.21 μM | - | PBS | Serum | 171 |
| 84 | CDs | 360/460 nm | 0.047 μM | - | Acetate buffer | - | 172 |
| 85 | CDs | 450/556 nm | - | - | Pure water | Lysosome | 173 |
| 86 | GFP | 493/620 nm | 18.7 μM | 30 min | EtOH/PBS (V∶V=1∶1) | Bel-7402 cells | 176 |
| 87 | GFP | 470/534 nm | 4.98 nM | 27 min | EtOH/PBS (V∶V=1∶1) | Bel-7402 cells | 177 |