1 引言
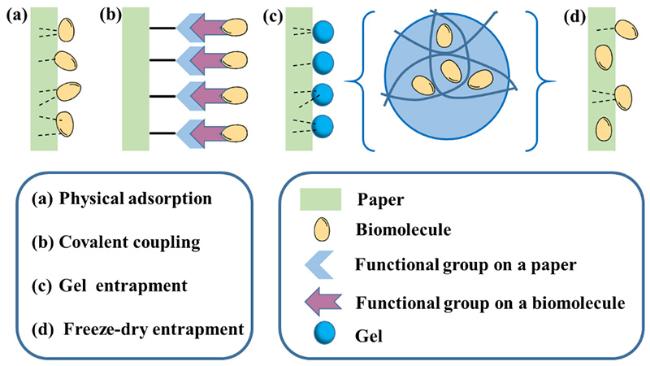
2 基于核酸的纸基荧光生物传感器的设计
2.1 物理吸附
2.2 共价偶联
2.3 包埋固定
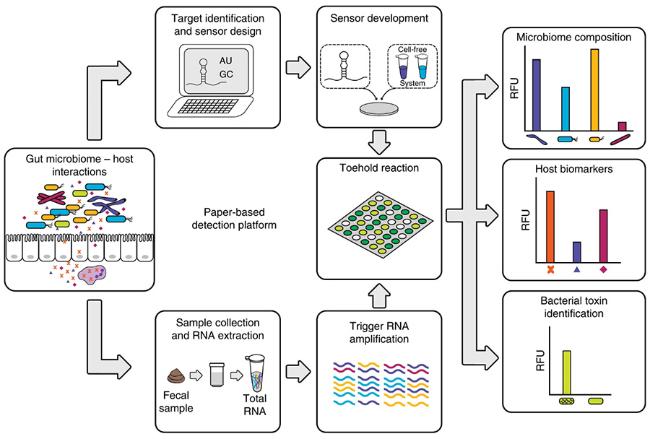
3 基于核酸的纸基荧光生物传感器的应用
3.1 临床诊断
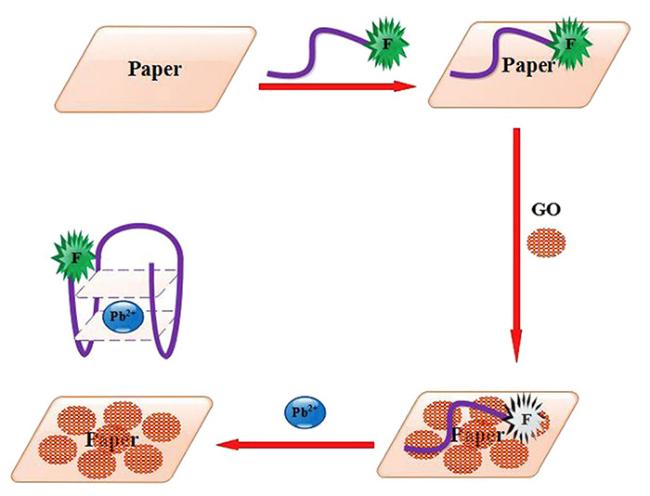
3.2 食品安全检测
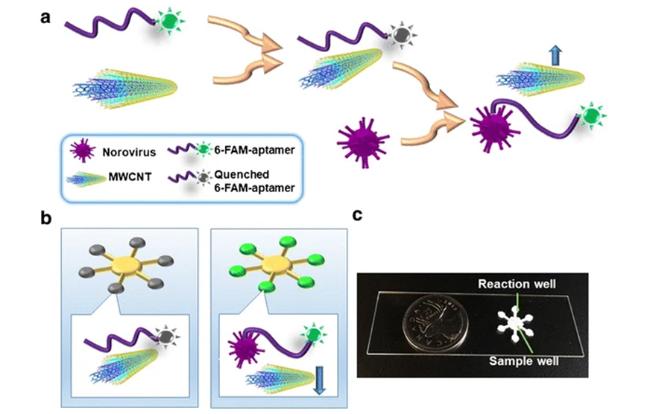
图3 (a) 基于MWCNT和6-FAM功能化适配体的荧光猝灭-恢复原理;(b) 检测诺如病毒的纸基微流控装置设计原理;(c) 纸基微流控装置图[53]Fig.3 (a) Schematic illustration of the turn-on sensor based on MWCNT and 6-FAM functionalized aptamer; (b) Schematic showing the design of the paper-based microfluidic device for norovirus detection using norovirus aptamer functionalized MWCNT; (c) The picture of the paper-based microfluidic device[53] |