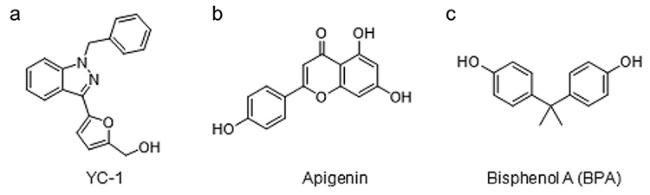
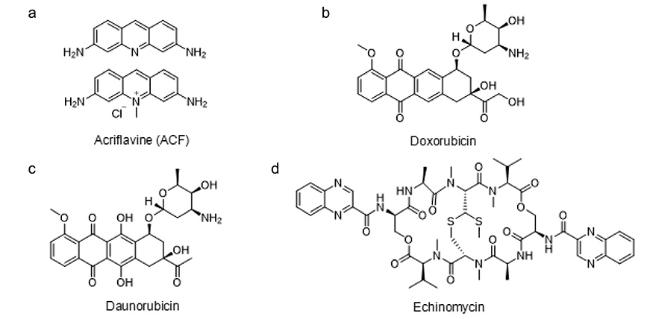
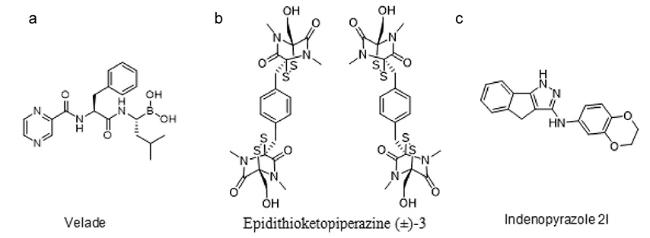
HIF家族主要由HIF-1、HIF-2和HIF-3三种亚型组成,其结构是包含由氧气感应调控的α亚基(HIF-1α、HIF-2α与HIF-3α)和结构性表达的HIF-1β亚基(又称芳基烃受体核转运蛋白,ARNT)构成的异源二聚体
[4,5]。其中,HIF-1具有非常广泛的靶基因谱,其中包括与缺氧适应、炎症发展及肿瘤生长等相关的近百种靶基因,因此已成为生物学研究和药物研发的重要靶点
[6⇓⇓⇓⇓~11]。HIF-1α是HIF-1的主要活性亚基,广泛表达于所有组织中,通过调控氧气的摄取和运输,介导细胞对体内氧气水平的应答,在氧气减少或缺氧的情况下发生活化。HIF-1β则以氧不敏感的形式存在。HIF-1α和HIF-1β均属于bHLH-PAS蛋白家族
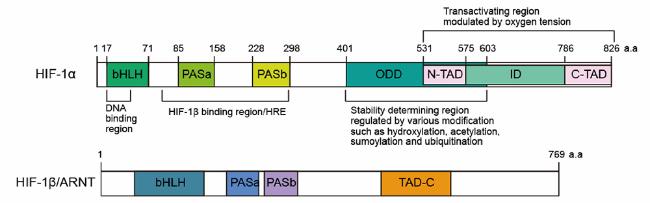
[12,13],结构如
图1所示。其中,PAS结构域对HIF-1α和HIF-1β亚基异源二聚体的形成至关重要,bHLH结构域则参与了异二聚体与靶基因上的缺氧反应元件(HRE)-DNA序列的结合。除了bHLH和PAS结构域外,还有另外两个反活化结构域(TAD):NH
2-末端(N-TAD)和COOH-末端(C-TAD)分别负责通过组蛋白乙酰转移酶CBP和p300调控HIF-1α靶基因的转录以及防止HIF-1α的降解。此外,N-TAD位于氧敏感和氧依赖降解域(ODD),只有在常氧条件下才能被泛素连接酶pVHL(von Hippel-Lindau)识别,然后经过泛素化,并引发蛋白酶体途径的快速降解
[14]。