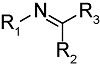
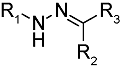
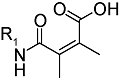
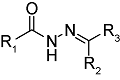
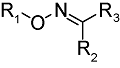
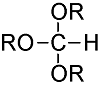
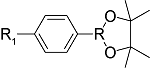
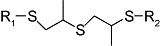
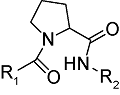
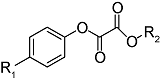
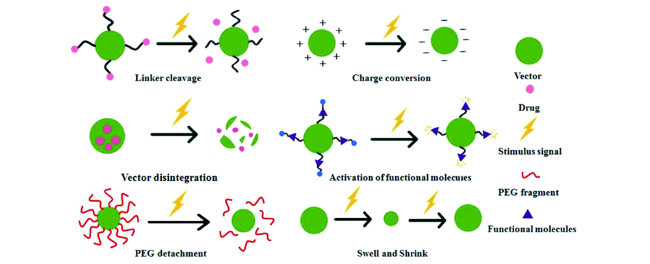
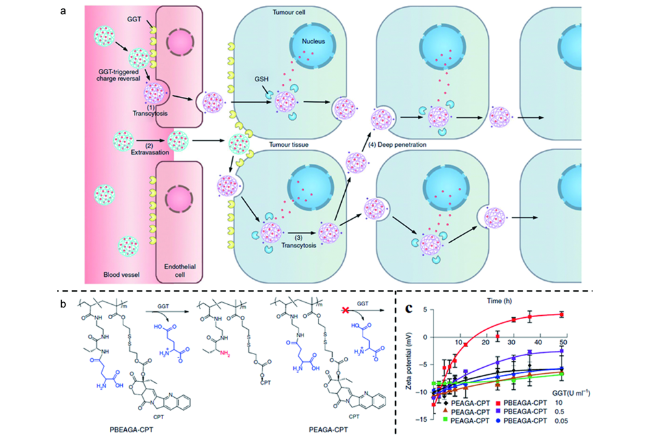
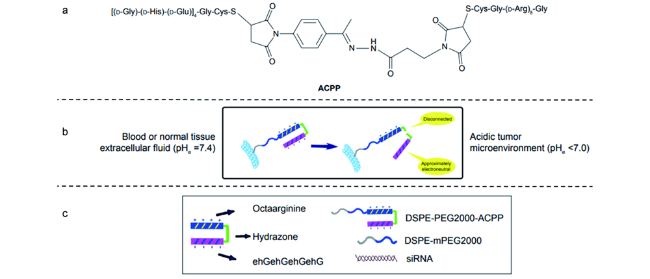
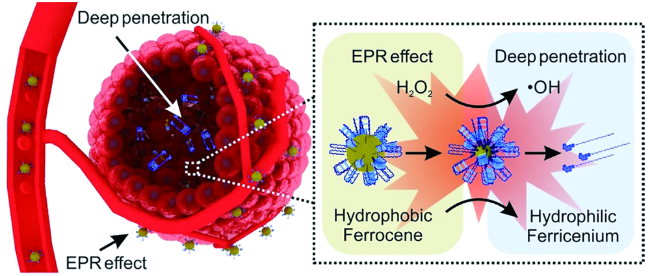
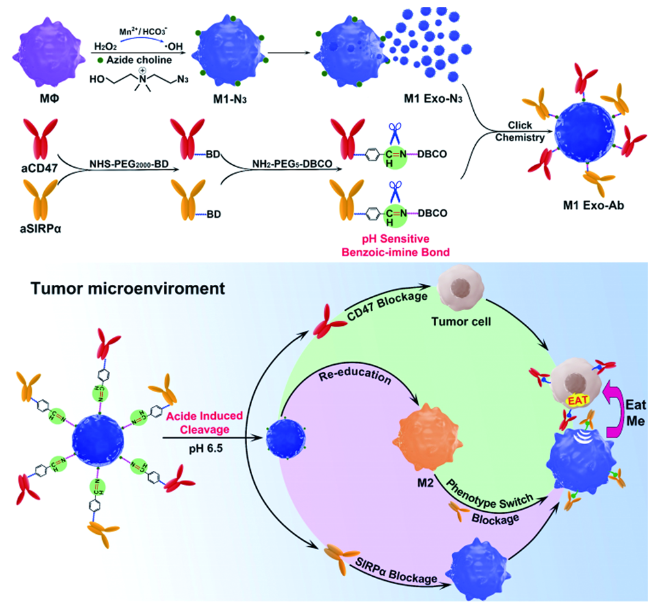
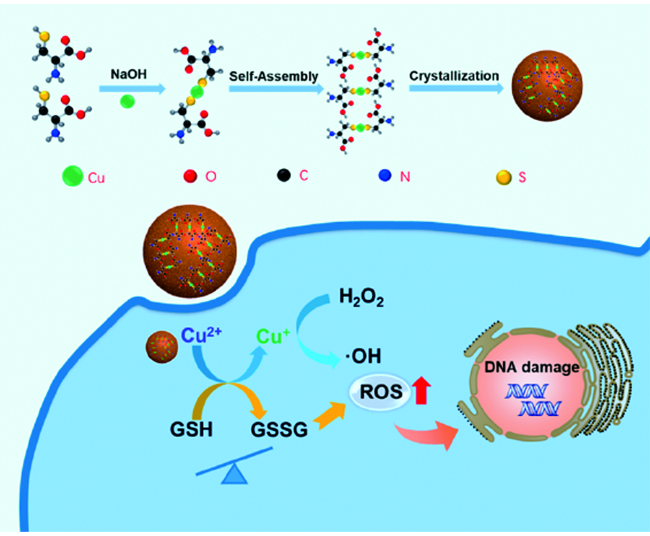
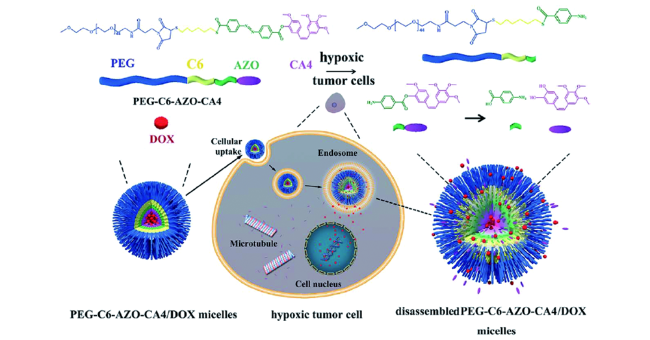
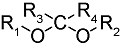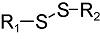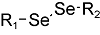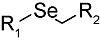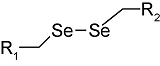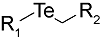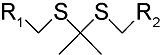化学药物治疗(化疗)是治疗恶性肿瘤最常用的方式之一,其目标是将抗肿瘤药物分子运送至肿瘤细胞中,抑制或杀死癌细胞
[1]。化疗药物分子能够通过血液循环到达身体中的各个器官去抑制癌细胞的增长,但化疗过程中依然面临许多挑战,例如:(1)血液循环时间短,小分子药物水溶性差,生物利用度低,从而限制了化疗的治疗效果;(2)肿瘤特异性治疗效果差,使得具有细胞毒性的药物分子对机体产生毒副作用(恶心、呕吐、腹泻、便秘、脱发、骨髓抑制以及肝肾功能损害等),加剧了病人在治疗过程中的痛苦;(3)长期的化疗用药还会使肿瘤细胞产生多药耐药性。针对这些问题,研究人员提出了药物传递系统(Drug Delivery System,DDS),即将化疗药物装载于载体中进行运输。一般来说,纳米药物载体经过静脉注射进入人体到进入肿瘤细胞内部发挥作用需要经历五个过程
[2],即:(1)体内循环;(2)肿瘤部位的积聚;(3)向肿瘤组织内部渗透;(4)细胞内吞;(5)药物释放发挥作用
[3]。这5个过程共同决定了化疗的治疗效果,任何一块短板都会使化疗效果大打折扣。例如阿霉素脂质体能够延长药物血液循环达30 h,并且能大量地积蓄到肿瘤部位,然而其疗效与静脉注射阿霉素的疗效相差不大
[4],究其原因就是大部分阿霉素脂质体无法渗透至肿瘤内部,导致肿瘤细胞对脂质体的摄取量较低
[5]。因此,进一步提高药物渗透性、细胞摄取及胞内释放效率,或赋予纳米药物更多的功能性,使纳米药物具有更高的抗肿瘤活性极为重要。肿瘤胞外微环境具有微酸性、缺氧、富含肿瘤细胞分泌酶等特点;同时,肿瘤细胞内也具有高浓度的活性氧(ROS)、高浓度的谷胱甘肽(GSH)等多种不同于正常细胞的生化指标
[6]。设计能够响应肿瘤微环境这些异常生理指标的纳米药物载体,实现药物在肿瘤部位的富集和释放,已经成为当前肿瘤治疗的一大热点
[7,8]。近几十年来,随着医学技术的不断发展,纳米药物传递系统在肿瘤诊断和治疗中表现出了显著的治疗效果,越来越多的纳米载体(如脂质体
[9]、白蛋白纳米颗粒
[10,11]和聚合物胶束
[12,13])已经被批准应用于临床肿瘤治疗
[14⇓⇓~17]。与单纯的使用化疗药物相比,纳米药物传递系统表现出诸多的优越性:(1)通过对小分子化疗药物进行包埋,可提高药物的水溶性及体内外稳定性,例如:亲水外壳有助于纳米粒子逃避机体的清除机制,延长在体内的循环时间,增加药物在肿瘤部位的积累量
[18];(2)纳米级载体的尺寸,可以使药物更好地通过实体肿瘤高通透性和滞留效应(Enhanced permeability and retention effect, EPR)在肿瘤部位富集,有效实现载体对肿瘤组织的被动靶向作用
[19,20];(3)在纳米药物递送体系表面连接对肿瘤细胞有特异性靶向作用的配体,通过配体与肿瘤细胞受体的特异性识别,使纳米药物递送载体具有主动靶向性
[21,22];(4)利用纳米药物递送载体可以实现小分子化疗药物的刺激响应性释放,例如:通过化学或物理的方式将小分子化疗药物包埋在载体内部
[23],纳米载体在正常组织中能够保持结构的完整性,而当载体到达肿瘤部位之后,在某些特定的刺激(如pH值、温度、GSH、ROS等)
[24],纳米药物递送体系发生解聚,释放出药物,从而减少了小分子化疗药物带来的全身性毒副作用。基于纳米递药载体的众多优势,本文讨论了针对肿瘤微环境的异常生化指标构建肿瘤微环境响应型载体的常用策略,并总结了近年来肿瘤微环境响应纳米药物载体用于肿瘤治疗的研究进展,旨在为高性能纳米药物载体的设计与制备提供参考。